相关试卷
-
1、
研究氮及其化合物的性质对化工生产和环境保护有重要意义。
Ⅰ.某小组探究浓度对硝酸氧化能力的影响。
资料显示:浓硝酸能将NO氧化成NO2 , 而稀硝酸不能氧化NO;氢氧化钠溶液能吸 收NO2 , 但不能吸收 NO。该小组按如图装置进行验证实验(夹持仪器已略去)。
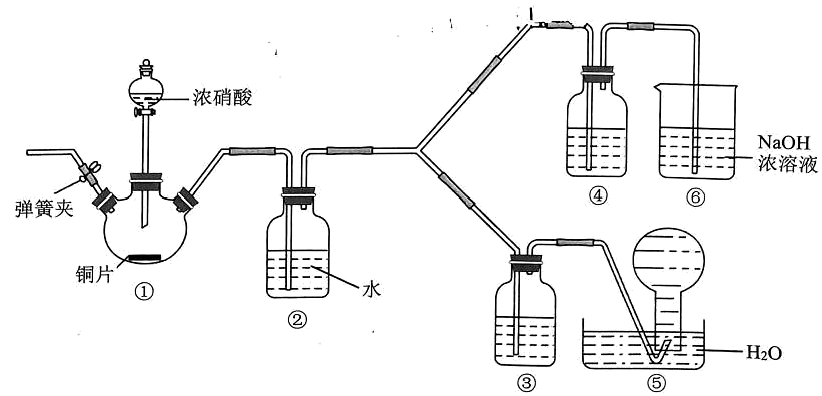 (1)装置②中反应的化学方程式为 ________。(2)装置③中盛放的试剂为________。(3)能证明不同浓度硝酸氧化能力的相对强弱的实验现象为________。
(1)装置②中反应的化学方程式为 ________。(2)装置③中盛放的试剂为________。(3)能证明不同浓度硝酸氧化能力的相对强弱的实验现象为________。Ⅱ.车尾气中的NOx是一种常见的大气污染物。在2L密闭容器中,800℃时发生反应:2NO(g)+O2 (g)=2NO2(g), 体系中n(NO) 随时间的变化如表:
时间/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
(4)下图表示NO2的浓度变化的曲线是________。 (5)0-2s内 ,v(O2)= ________。(6)能说明该反应已达到平衡状态的是___________。
(5)0-2s内 ,v(O2)= ________。(6)能说明该反应已达到平衡状态的是___________。A. 容器内气体的颜色不再变化 B. 容器内气体的总质量保持不变 C. 正反应和逆反应的速率相等 D. NO、O2和NO2的物质的量之比为2:1:2 Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应N2H4+O2=N2+2H2O 为原理设计成利用率高的燃料电池,装置如图。
 (7)N极为电池的________ (填“正”或“负”)极, M 处电极反应式为________。
(7)N极为电池的________ (填“正”或“负”)极, M 处电极反应式为________。 -
2、在实验室里制取的乙烯中常混有少量的SO2 , 某化学兴趣小组设计了如图装置验证该混合气体中含有SO2和 C2H4。
 (1)、装置Ⅱ中反应的化学方程式为。(2)、能说明SO2、C2H4气体存在的现象分别是。(3)、下列操作中,可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中混有的乙烯的是。
(1)、装置Ⅱ中反应的化学方程式为。(2)、能说明SO2、C2H4气体存在的现象分别是。(3)、下列操作中,可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中混有的乙烯的是。A.将气体通入盛有水的洗气瓶中 B.将气体通入盛有足量溴水的洗气瓶中
C.将气体通入盛有溴的四氯化碳溶液的洗气瓶中 D.将气体通入盛有酸性高锰酸钾溶液的洗气瓶中
E.将气体通入盛有硫酸的洗气瓶中
(4)、该小组同学还利用下图装置测定空气中SO2的含量。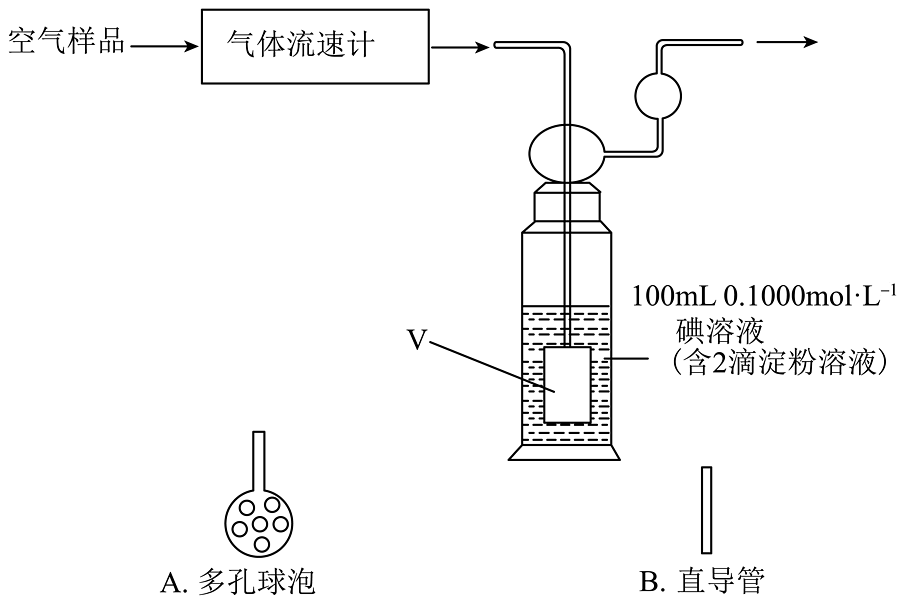
①为确保实验准确,图中V处应选择( 填“A”或“B”)连接到导管末端,否则会导致测量结果(填“偏大”或“偏小”)。
②该装置中反应的离子方程式为。
③若空气流速为a m3·min-1 , 当观察到装置内 时,结束计时,测定耗时t min。假定空气中的SO2可被溶液充分吸收,该空气样品中SO2的含量为 mg ·m-3。
-
3、基于Na2S2O3溶液与H2SO4溶液反应会出现浑浊,探究化学反应速率的影响因素,实验过程中的数据记录如下。下列说法不正确的是
实验编号
水浴温度/℃
Na2S2O3溶 液
H2SO4溶液
H2O
V/mL
c/(mol/L)
V/mL
c/(mol/L)
V/mL
1
40
2
0.1
2
0.1
0
2
20
2
0.1
2
0.1
0
3
20
1
0.1
2
0.1
a
4
40
1.5
0.1
2
0.1
1
A、通过比较出现浑浊所需时间的长短判断化学反应速率的快慢 B、该实验探究了温度、Na2S2O3溶液的浓度对化学反应速率的影响 C、实验1需先将Na2S2O3溶液和H2SO4溶液混合,再水浴加热至40℃ D、若实验2和3是探究浓度对化学反应速率的影响,则a=1 -
4、水煤气变换反应是放热反应,在双功能催化剂(能吸附不同粒子)催化下的反应过程示意 图如下下列说法正确的是
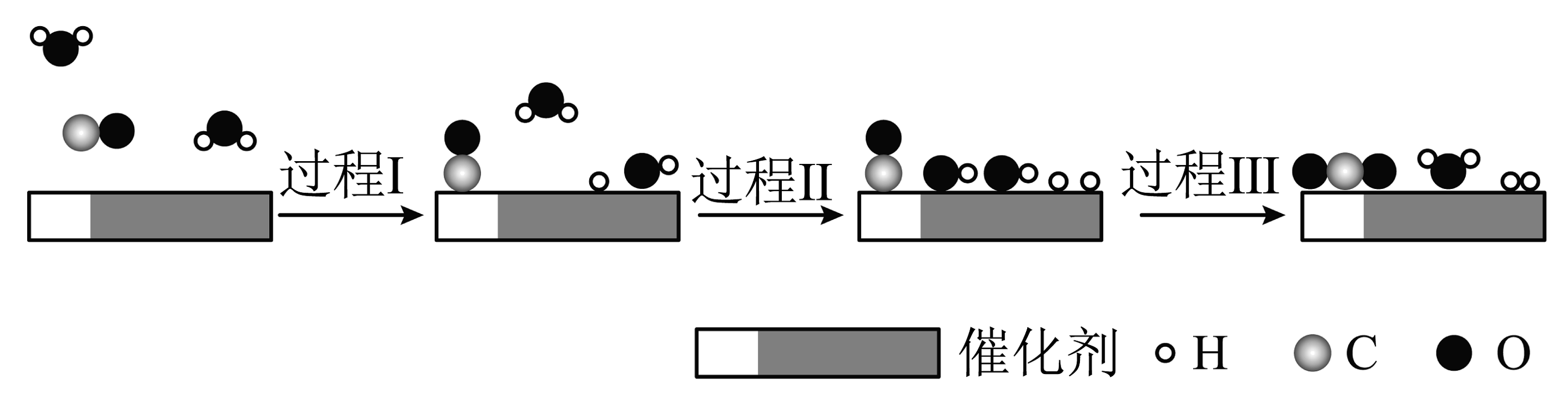 A、过 程I 中有非极性共价键断裂 B、过程Ⅱ和过程Ⅲ均为放热过程 C、该反应的化学方程式为CO+ H2O=CO2+H2 D、该反应中反应物的总能量小于生成物总能量
A、过 程I 中有非极性共价键断裂 B、过程Ⅱ和过程Ⅲ均为放热过程 C、该反应的化学方程式为CO+ H2O=CO2+H2 D、该反应中反应物的总能量小于生成物总能量 -
5、根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
取少量待测液于试管中,先加入过量稀硝酸,再加入 氯化钡溶液,有白色沉淀生成
待测液中含有或Ag+
B
向某溶液中加入NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝
溶液中不含
C
在淀粉溶液中加入稀硫酸,加热。待溶液冷却后再加 入少量新制的Cu(OH)2 , 加热,无砖红色沉淀产生
淀粉未发生水解
D
向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色
黄色溶液中可能含有Br2
A、A B、B C、C D、D -
6、设 NA为阿伏加德罗常数的值。下列说法正确的是A、标况下,44.8L甲烷中含有的共用电子对数为8NA B、2L 0.5mol/L乙醇溶液中含有的氧原子数为NA C、5.6g铁粉在0.1molCl2中燃烧,转移电子数为0.3NA D、1mol所含的质子数为10NA
-
7、下列解释事实的化学用语不正确的是A、NaCl 溶液具有导电性:NaCl=Na++Cl- B、碳酸钙做抗酸药:+2H+=CO2↑+H2O C、NaOH 固体和铝粉混合疏通厨卫管道:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ D、铝粉和氧化铁组成的铝热剂用于焊接钢轨
-
8、氨是一种重要的化工原料,下图为合成氨以及由氨制硝酸的流程示意图。下列说法不正确的
 A、提高合成塔中的反应温度,可以实现N2全部转化为NH3 B、氨分离器中,可通过加压或降温使氨液化分离 C、向吸收塔和氧化炉中通入的A 为空气 D、氧化炉中反应的氧化剂与还原剂的物质的量之比为5∶4
A、提高合成塔中的反应温度,可以实现N2全部转化为NH3 B、氨分离器中,可通过加压或降温使氨液化分离 C、向吸收塔和氧化炉中通入的A 为空气 D、氧化炉中反应的氧化剂与还原剂的物质的量之比为5∶4 -
9、部分含硫物质的分类与相应硫元素的化合价关系如图所示。下列说法不正确的是
 A、a的电子式为
A、a的电子式为 B、b是淡黄色的固体,可通过 a与c 反应制得
C、工业上由b 制 备e 的路线:bcde
D、h可被氧气氧化成g
B、b是淡黄色的固体,可通过 a与c 反应制得
C、工业上由b 制 备e 的路线:bcde
D、h可被氧气氧化成g
-
10、下列陈述Ⅰ、Ⅱ均正确且有因果关系的是
选项
陈述I
陈述Ⅱ
A
用KSCN溶液检验FeSO4溶液是否变质
Fe3+与SCN-生成红色沉淀
B
H2与F2在暗处剧烈反应,与Br2加热才能反应
非金属性:F>Br
C
用FeCl3溶液刻蚀电路板
氧化性:Cu2+>Fe3+
D
久置空气中的漂白粉遇盐酸产生CO2
漂白粉的有效成分是CaCO3
A、A B、B C、C D、D -
11、锌、铜和稀硫酸组成的原电池如图所示。下列说法正确的是
 A、电池工作时,电能转化为化学能 B、若用乙醇代替稀硫酸,也能构成原电池 C、锌片作负极,发生还原反应:Zn-2e-=Zn2+ D、溶 液 中H+向铜电极移动,在铜电极上得电子生成H2
A、电池工作时,电能转化为化学能 B、若用乙醇代替稀硫酸,也能构成原电池 C、锌片作负极,发生还原反应:Zn-2e-=Zn2+ D、溶 液 中H+向铜电极移动,在铜电极上得电子生成H2 -
12、下列实验装置或操作能达到实验目的的是


A.制备纯净的一氯甲烷
B.测氯水的pH

C.实验室制备NH3
D.配制一定物质的量浓度的NaOH溶液
A、A B、B C、C D、D -
13、海洋是一个巨大的宝藏,海水的综合利用示意图如下。下列说法不正确的是
 A、海水中元素的种类很多,总储量很大 B、通过蒸馏、反渗透等方法可以将海水淡化 C、从海水中制取钾、镁、溴均涉及氧化还原反应 D、电解食盐水可以得到钠单质和氯气
A、海水中元素的种类很多,总储量很大 B、通过蒸馏、反渗透等方法可以将海水淡化 C、从海水中制取钾、镁、溴均涉及氧化还原反应 D、电解食盐水可以得到钠单质和氯气 -
14、化学与生活息息相关。下列说法正确的是A、糯米中的淀粉一经水解就酿成了酒 B、油脂在体内水解,产物为氨基酸 C、棉花和合成纤维的主要成分均为纤维素 D、通过高温蒸煮进行消毒,蛋白质受热变性
-
15、劳动创造美好生活。下列劳动项目所涉及的化学知识不正确的是
选项
劳动项目
化学知识
A
用干燥的模具盛装熔融钢水
铁与H2O高温下会反应
B
通过煤的干馏获得煤焦油、焦炭等物质
煤的干馏属于物理变化
C
制作水果罐头时加入少量维生素C
维生素C是抗氧化剂
D
用铁罐车运输浓硫酸
常温下浓硫酸遇铁钝化
A、A B、B C、C D、D -
16、坚持绿色发展,建设美丽中国。下列做法符合绿色化学理念的是A、汽车尾气系统中安装催化转化器减少尾气排放 B、通过浓硫酸与铜加热反应制备硫酸铜 C、深挖填埋废弃塑料制品 D、大量施用农药和化肥,提高粮食产量
-
17、我国科技发展取得了巨大成就。下列说法不正确的是A、C919大型客机机身采用的铝锂合金比纯金属铝的硬度更大 B、“华龙一号”核电反应堆所用轴棒中含有的与互为同位素 C、核心舱太阳能电池采用砷化镓(GaAs) 材 料 ,GaAs 属于金属材料 D、“神舟十三号”航天员使用塑料航天面窗,塑料属于有机高分子材料
-
18、馆藏文物记载着中华文明的灿烂成就。下列文物主要由硅酸盐制成的是




A.铁熨斗
B.人面鱼纹彩陶盆
C.《编年纪》竹筒
D.人形铜灯
A、A B、B C、C D、D -
19、由氧元素形成的常见物质有H2O、H2O2、O2和O3等。(1)、基态氧原子的电子排布式是。(2)、H2O分子的VSEPR模型是形。(3)、对H2O2分子结构的研究,曾有以下推测:

①根据测定H2O2分子中(填字母序号),确定其结构一定不是甲。
a.H-O键长 b.O-O键能 c.H-O-O键角
②由于H2O2不稳定,很难得到晶体。20世纪40年代初,卢嘉锡等化学家用尿素(
 )与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。
)与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。a.H2O2为(填“极性”或“非极性”)分子。
b.用“X—H…Y”表示出上述晶体中形成的氢键:。
(4)、O2的晶胞为立方体,结构如下。
根据图中信息,可计算O2晶体密度是g·cm-3。
(5)、已知O3分子空间结构为V形,中心O为sp2杂化。除σ键外,O3分子中还形成了含4个电子的大π键。每个O3分子中用于成键的电子总数是个,中心O提供参与成键的电子数是个。 -
20、某蓄电池放电、充电时反应为: , 下列推断不正确的是A、放电时,负极上的电极反应式是: B、放电时,每转移电子,正极上有被氧化 C、充电时,阳极上的电极反应式是: D、该蓄电池的电极必须是浸在某种碱性电解质溶液中