相关试卷
-
1、某有机物的结构简式为
 , 下列说法不正确的是 A、该有机物分子中有3种官能团 B、该有机物能使酸性高锰酸钾溶液褪色 C、1mol该有机物充分燃烧消耗7mol D、该有机物能发生加聚反应生成
, 下列说法不正确的是 A、该有机物分子中有3种官能团 B、该有机物能使酸性高锰酸钾溶液褪色 C、1mol该有机物充分燃烧消耗7mol D、该有机物能发生加聚反应生成
-
2、下列化学反应与方程式相符的是A、两性氢氧化物氢氧化铍溶于强碱: B、工业上制硝酸时氨的催化氧化: C、过氧化钠溶于水: D、向红色溶液中加入过量铁粉至溶液红色褪去:
-
3、下列说法不正确的是A、根据纤维在火焰上燃烧产生的气味,可鉴别蚕丝与棉花 B、蛋白质、淀粉、纤维素和油脂均能发生水解 C、含增塑剂的聚氯乙烯薄膜因可塑性强,可用作生产食品包装材料 D、服用补铁剂(含)时,搭配维生素C(又称“抗坏血酸”)效果更好
-
4、设为阿伏加德罗常数的值。下列说法正确的是A、标准状况下,2.24L 中的原子总数为 B、1mol苯(
 )中含有的碳碳双键数为
C、含19.6g的浓硫酸与足量Zn反应得到的气体分子数为
D、通过使固体增重2g时,反应中转移的电子数为
)中含有的碳碳双键数为
C、含19.6g的浓硫酸与足量Zn反应得到的气体分子数为
D、通过使固体增重2g时,反应中转移的电子数为
-
5、化学与生产生活密切相关。下列活动与所述化学知识关联正确的是
选项
活动
化学知识
A
向薯片袋内充入氮气
氮气无色无味
B
擦干已洗净的铁锅,防止生锈
铁丝在氧气中燃烧生成
C
用氨水处理二氧化硫烟气
氨水具有挥发性
D
红酒中添加少量
可以起到抗氧化和杀菌作用
A、A B、B C、C D、D -
6、镁及其合金是用途很广的金属材料。从海水中获取镁的主要步骤如下:

下列说法不正确的是
A、试剂①常选用澄清石灰水 B、加入试剂②反应的离子方程式为 C、电解熔融所得副产物是工业制备试剂②的主要原料 D、与电解MgO相比,电解熔融的方式冶炼金属镁具有节能优势 -
7、我国古代四大发明之一的黑火药,由硫磺粉、硝酸钾和木炭粉按一定比例混合而成,其爆炸反应为S+2KNO3+3C═K2S+N2↑+3CO2↑。下列说法正确的是A、火药爆炸过程中产生能形成酸雨的气体 B、该反应的还原剂为S和C C、反应产生的气体均为氧化产物 D、反应生成1mol CO2时转移4mol电子
-
8、下列说法不正确的是A、表示质子数为6、中子数为8的核素 B、
 的名称为异丁烷
C、的离子结构示意图为
的名称为异丁烷
C、的离子结构示意图为 D、
D、 和
和 为两种不同物质
为两种不同物质
-
9、侯德榜把氨碱法和合成氨联合起来,创造了联合制碱法。下列说法不正确的是A、受热时碳酸钠比碳酸氢钠更稳定 B、碳酸钠溶液和碳酸氢钠溶液都显碱性,均可用作食用碱 C、氨碱法的第一步反应是向的饱和NaCl溶液中通入足量的 D、工业合成氨是最重要的人工固氮途径
-
10、下列物质中不属于电解质的是A、 B、HI C、 D、KOH
-
11、阿托酸甲酯能用于治疗肠道疾病,它可由阿托酸经过下列反应合成:

下列说法正确的是
A、阿托酸甲酯的分子式为 B、阿托酸可发生取代反应、加成反应和消去反应 C、阿托酸苯环上的二氯代物共有5种 D、阿托酸分子最多能与氢气发生加成反应 -
12、
聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:①
②
③
计算反应④的________;
(2)在某温度、下,向反应器中充入气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入________水蒸气作为稀释气(计算时忽略副反应);(3)在、下,以水蒸气作稀释气。作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S()随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是________,理由是________;
 (4)关于本反应体系中催化剂的描述错误的是_______;
(4)关于本反应体系中催化剂的描述错误的是_______;A. X射线衍射技术可测定晶体结构 B. 可改变乙苯平衡转化率 C. 降低了乙苯脱氢反应的活化能 D. 改变颗粒大小不影响反应速率 Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进(引发剂,X表示卤素)生成自由基 , 实现苯乙烯可控聚合。
(5)引发剂中活性最高的是________;(6)室温下,①在配体L的水溶液中形成 , 其反应平衡常数为K;②在水中的溶度积常数为。由此可知,在配体L的水溶液中溶解反应的平衡常数为________(所有方程式中计量系数关系均为最简整数比)。 -
13、
氮化钙()是重要的化工原料,在空气中易被氧化,遇水会生成和。实验室用Ca与反应制备 , 并对纯度进行测定。
Ⅰ.的制备
 (1)如图中仪器X的名称为;写出溶液和溶液反应的化学方程式:。(2)实验过程中,先启动A处反应,一段时间后再点燃C处酒精灯,目的是。(3)制备过程中E装置的导管必须始终插入水中,目的是:①便于观察的流速,从而控制反应速率;②。
(1)如图中仪器X的名称为;写出溶液和溶液反应的化学方程式:。(2)实验过程中,先启动A处反应,一段时间后再点燃C处酒精灯,目的是。(3)制备过程中E装置的导管必须始终插入水中,目的是:①便于观察的流速,从而控制反应速率;②。Ⅱ.纯度的测定
(4)某同学称取样品 , 按如图装置进行实验,倾斜Y形管,将蒸馏水倒入样品管中,将产生的气体通入装有足量溶液的装置F中充分吸收(发生的反应为)。
①写出与水反应的化学方程式:。
②反应结束后,向装置F中的吸收液加入盐酸(发生的反应为),恰好反应时消耗盐酸的体积为 , 则该样品中的质量分数为。
③某同学通过多次实验,发现测得样品中的质量分数始终偏小,经检查上述实验装置气密性良好,你认为可能的原因是。
-
14、某营养液中含有KAl(SO4)2、K2SO4、KCl三种溶质,实验测得部分离子的浓度如图甲表示。取200mL样品加水稀释,测得 Al3+的浓度(c)随溶液体积(V)的变化如图乙曲线表示。下列判断错误的是
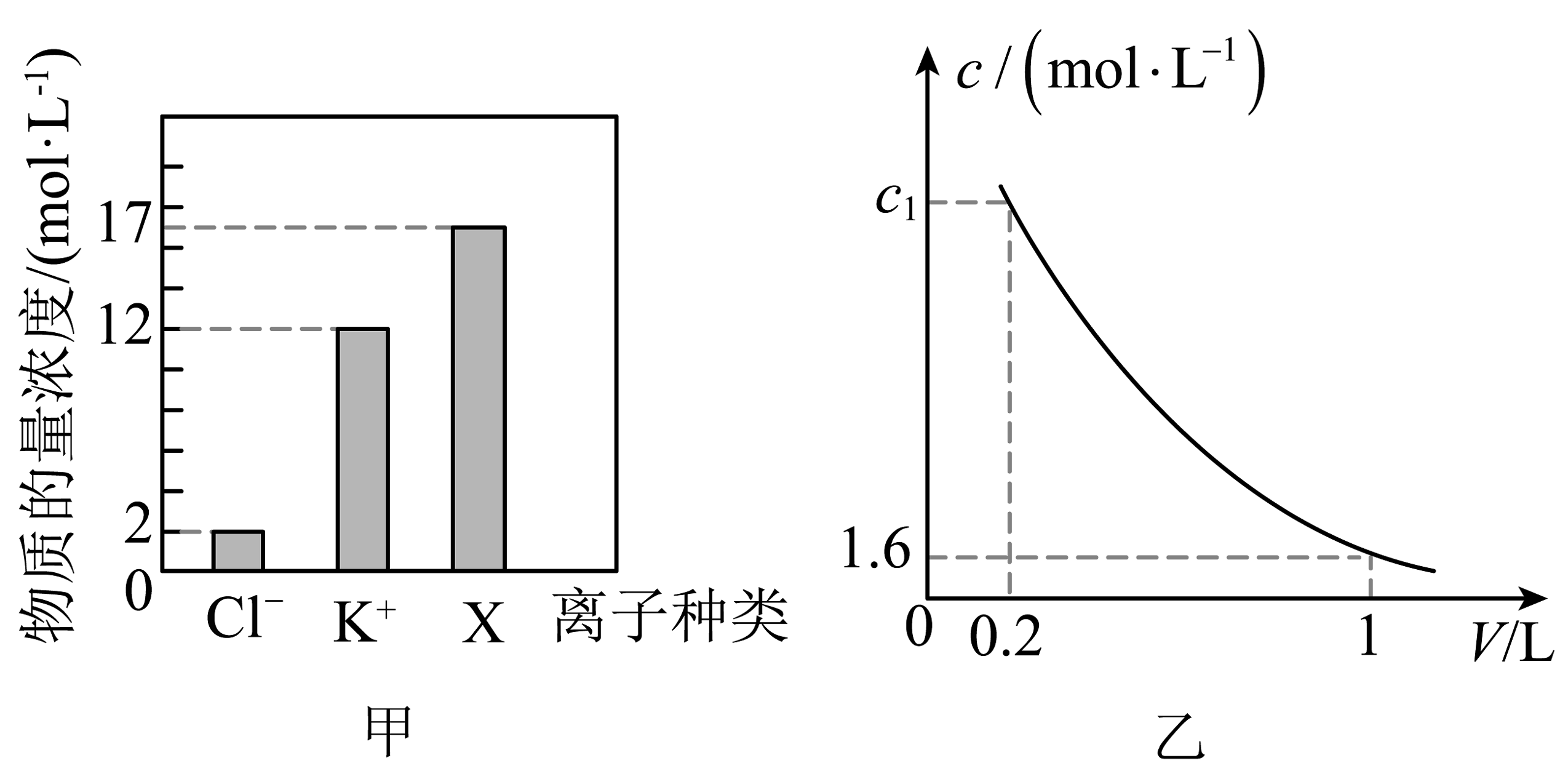 A、图甲中X离子是SO B、图乙中c1=8.0 C、营养液中 KCl与K2SO4的物质的量之比为2: 1 D、营养液中K2SO4的浓度是2mol/L
A、图甲中X离子是SO B、图乙中c1=8.0 C、营养液中 KCl与K2SO4的物质的量之比为2: 1 D、营养液中K2SO4的浓度是2mol/L -
15、甲醛是室内装修时产生的主要污染物质。用下面化学反应可检测室内甲醛含量是否超标:。其中R代表甲醛的化学式,试确定R的化学式为A、 B、 C、 D、
-
16、在有机物中有一大类物质叫做烷烃。其中CH4为甲烷,C2H6为乙烷,C3H6为丙烷,C4H10为丁烷……。含有8个碳原子的烷烃分子式为( )A、C8H14 B、C8H16 C、C8H18 D、C8H20
-
17、某红色固体粉末可能是Fe2O3、Cu2O或二者混合物,为探究其组成,称取mg该固体粉末样品,用足量的稀H2SO4充分反应后,称得固体质量为ag;
已知:①Cu2O与稀硫酸发生反应,得到紫红色固体和蓝色溶液,写出化学方程式_____________________
②Cu+Fe2(SO4)3=CuSO4+2FeSO4
(1)、写出①中化学方程式。(2)、若(用含m的最简式表示,下同),则红色固体粉末为纯净物;(3)、若 , 则红色固体粉末中Fe2O3的质量为g; -
18、某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。
已知:Fe(OH)2白色沉淀易被空气氧化,形成红褐色沉淀。

请回答:
(1)、装置5的作用是;(2)、实验开始时,关闭K2 , 打开K1 , 反应一段时间后,再打开K2 , 关闭K1 , 发现无法让3中溶液进入4中,请为装置作一处改进,使溶液能进入4中,改进的方案是;(3)、装置改进后,将3中反应后溶液压入4中,在4中立即析出了灰绿色沉淀,长时间后转变为红褐色,写出该过程的化学方程式;从实验操作过程分析没有产生白色沉淀的原因是; -
19、氢能是最绿色的能源,下图是制取与贮存氢气的一种方法。下列说法正确的是

资料:①是一种贮氢合金,吸氢后生成和合金;②和反应的化学方程式为:
A、中的化合价为价 B、循环制氢反应中需要不断加入 C、反应2产生的氢气和反应3所得混合物与足量稀盐酸反应生成的氢气质量相等 D、反应3中氩气作保护气,防止金属镁、铜在高温下与氧气反应 -
20、新冠病毒主要传播方式是经飞沫传播、接触传播(包括手污染)以及不同大小的呼吸道气溶胶近距离传播.冠状病毒对热敏感,下持续30分钟、75%酒精、含氯消毒剂)、过氧乙酸等均可有效灭活病毒。下列有关说法正确的是A、过氧乙酸属于氧化物 B、等质量的酒精与甲醚完全燃烧需要消耗的氧气量不相等 C、无水酒精的杀菌效果比75%酒精更好 D、中的化合价为价