相关试卷
-
1、氧化基纳米催化剂可用于CO2选择性加氢制备CH3OH,其反应机理如图所示,下列说法错误的是
 A、In为49号元素,其价层电子排布式为5s25p1 B、该反应过程中存在非极性键的断裂和形成 C、CH3OH和CO2中,碳原子的杂化方式不同 D、该反应的总化学方程式为CO2+3H2CH3OH+H2O
A、In为49号元素,其价层电子排布式为5s25p1 B、该反应过程中存在非极性键的断裂和形成 C、CH3OH和CO2中,碳原子的杂化方式不同 D、该反应的总化学方程式为CO2+3H2CH3OH+H2O -
2、掌握化学实验技能是进行科学探究的基本保证,下列实验方案能达到探究目的或者结论正确的是
选项
实验方案
探究目的或结论
A
用pH计分别测0.1mol•L-1NaClO与CH3COONa溶液的pH,前者pH大
Ka(HClO)>Ka(CH3COOH)
B
向丙烯醛中加入足量新制氢氧化铜悬浊液,加热至不再生成砖红色沉淀,静置,向上层清液滴加溴水,溴水褪色
说明丙烯醛中含有碳碳双键
C
向淀粉溶液中加入稀硫酸共热,冷却后再加入碘水,观察溶液颜色的变化
探究淀粉是否水解完全
D
向CuSO4溶液中滴加浓氨水至过量,观察到先产生蓝色沉淀,后逐渐溶解
Cu(OH)2是两性氢氧化物
A、A B、B C、C D、D -
3、汞钡铜氧晶体的晶胞如图A所示,通过掺杂Ca2+获得的具有更高临界温度的超导材料如图B所示。下列说法正确的是
 A、掺杂后晶体密度增大是因为晶胞中增加了1个Ca2+ B、汞钡铜氧晶体中的Hg和Cu个数比为1∶2 C、图A晶胞中一个Ba的分数坐标为( , , ),则另一个( , , ) D、图B晶胞中Ca周围距离最近的Hg数目和Hg周围距离最近的Ca的数目不同
A、掺杂后晶体密度增大是因为晶胞中增加了1个Ca2+ B、汞钡铜氧晶体中的Hg和Cu个数比为1∶2 C、图A晶胞中一个Ba的分数坐标为( , , ),则另一个( , , ) D、图B晶胞中Ca周围距离最近的Hg数目和Hg周围距离最近的Ca的数目不同 -
4、下列解释事实的离子方程式正确的是A、向氢氧化铁胶体中滴加氢碘酸:Fe(OH)3+3H+=Fe3++3H2O B、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO C、向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++S2-=CuS↓ D、往硫酸铝铵溶液中滴加氢氧化钡溶液,产生沉淀的质量最大:NH+Al3++4OH-+2Ba2++2SO=NH3•H2O+Al(OH)3↓+2BaSO4↓
-
5、X、Y、Z、W是原子半径依次增大的短周期主族元素,X与其他元素不在同一周期,Y元素的电负性仅次于氟元素,Z的基态原子中单电子与成对电子个数比为3∶4,W原子电子总数与Y原子的最外层电子数相同。下列说法正确的是A、第一电离能:Z>Y>W B、基态Z原子核外电子有7种空间运动状态 C、由四种元素组成的化合物仅含共价键 D、X、Y形成的化合物都是由极性键构成的极性分子
-
6、2020年,“新冠”席卷全球,给各个国家造成了极大的危害。口服羟甲香豆素,对治疗新冠安全有效。羟甲香豆素的结构简式如图所示,下列说法正确的是
 A、羟甲香豆素中含有4种官能团 B、1mol该物质可与4molH2发生加成反应 C、该物质能发生取代反应、加成反应和消去反应 D、该分子苯环上的一氯代物有两种
A、羟甲香豆素中含有4种官能团 B、1mol该物质可与4molH2发生加成反应 C、该物质能发生取代反应、加成反应和消去反应 D、该分子苯环上的一氯代物有两种 -
7、下列叙述正确的是A、HBrO的结构式为:H-Br-O B、醋酸的电离方程式为:CH3COOH+H2OCH3COO-+H3O+ C、基态Si原子的价层电子的轨道表示式:
 D、NH3的VSEPR模型:
D、NH3的VSEPR模型:
-
8、化学与科学、技术、社会、生活等密切相关。下列有关说法正确的是A、用于清洗伤口、杀菌、消毒的医用酒精有强氧化性 B、我国“神舟十二号”飞船返回舱的舱体外壳部件材料是由金属复合材料——专业的铝合金材料制成的,主要是利用了其硬度大的特性 C、食品袋中放置的CaO可直接防止食品氧化变质 D、客家围屋建造过程中用作黏稠剂的糯米和鸡蛋清都属于混合物
-
9、明代《天工开物》中介绍了炉甘石(主要成分).按分类法,属于A、碱 B、化合物 C、酸 D、氧化物
-
10、在固体、熔融状态、溶于水三种状态下的导电实验,如图所示
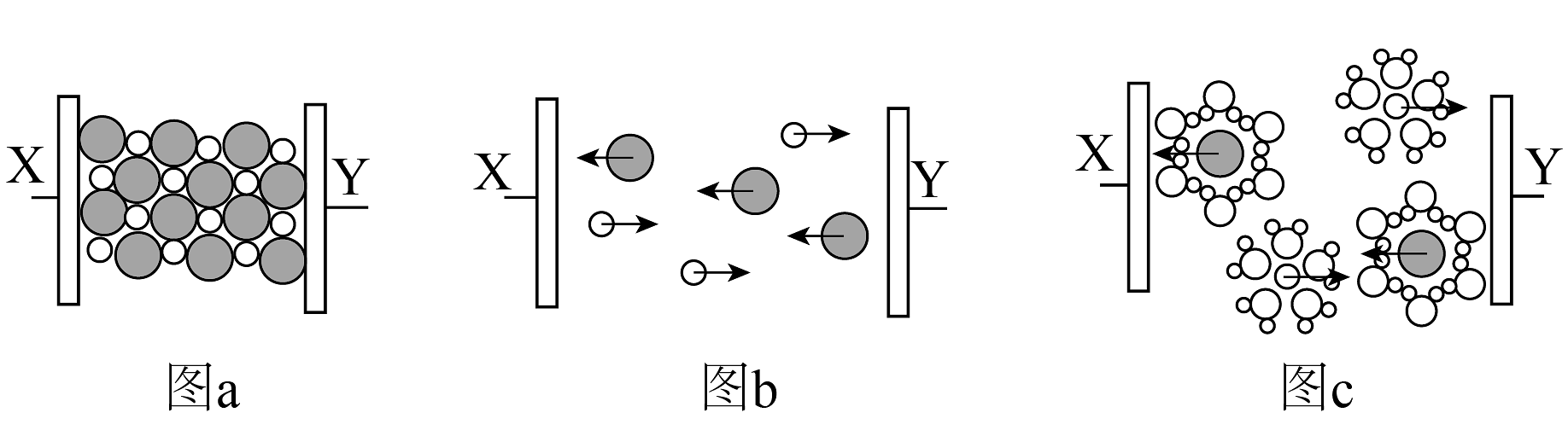
下列说法正确的是
A、固体中不存在离子,不能导电 B、通电情况下才能电离 C、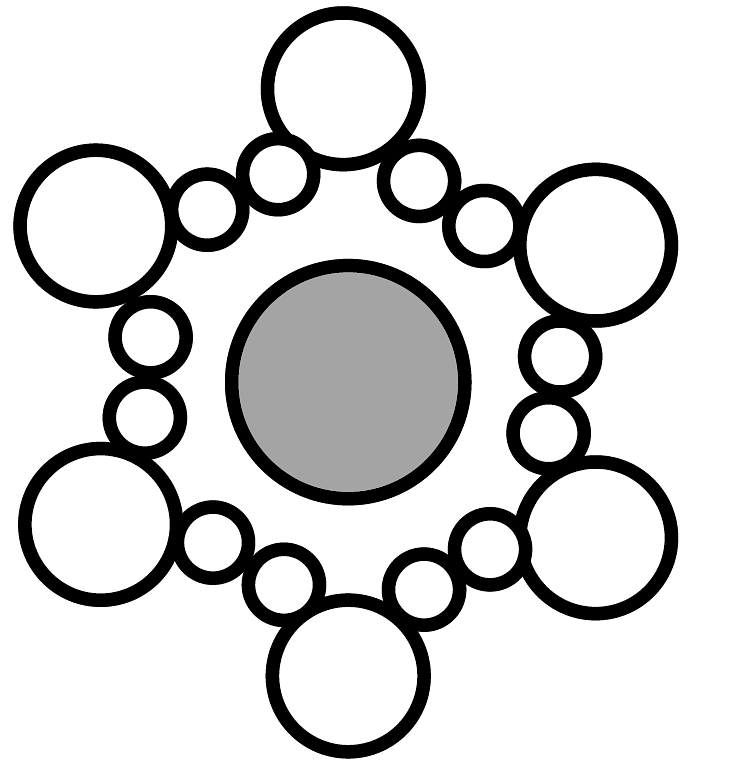 表示水合氯离子
D、、、分别溶于少量的水后,都有明显的放热现象
表示水合氯离子
D、、、分别溶于少量的水后,都有明显的放热现象
-
11、常温下,向溶液中逐滴加入0.1mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法不正确的是
 A、a点的 B、反应过程中的值不断增大 C、c点时, D、b点时,
A、a点的 B、反应过程中的值不断增大 C、c点时, D、b点时, -
12、已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,在酸性溶液中的还原性顺序为:SO2>I->Fe2+>H2O2>Cl- , 则下列反应不可能发生的是A、2Fe3++SO2+2H2O=2Fe2++SO+4H+ B、2Fe2++I2=2Fe3++2I- C、I2+SO2+2H2O=H2SO4+2HI D、H2O2+SO2=H2SO4
-
13、青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:

下列有关此工艺操作不正确的是
A、破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率 B、操作I需要用到的玻璃仪器有漏斗、玻璃棒、烧杯 C、操作II是蒸馏,利用了乙醚与青蒿素的沸点相差较大 D、操作III的主要过程加水溶解,蒸发浓缩、冷却结晶、过滤 -
14、如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(式中为阿伏加德罗常数)A、 B、 C、 D、
-
15、硫化氢的转化是资源利用和环境保护的重要研究课题将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS溶于水)。下列说法正确的是
 A、过程①中,Cu2+起催化剂作用 B、过程②中,发生反应为S2-+2Fe3+=S↓+2Fe2+ C、过程③中,氧气被还原 D、回收S的总反应为H2S+O2=H2O+S↓
A、过程①中,Cu2+起催化剂作用 B、过程②中,发生反应为S2-+2Fe3+=S↓+2Fe2+ C、过程③中,氧气被还原 D、回收S的总反应为H2S+O2=H2O+S↓ -
16、下列图示实验装置和原理能达到实验目的的是
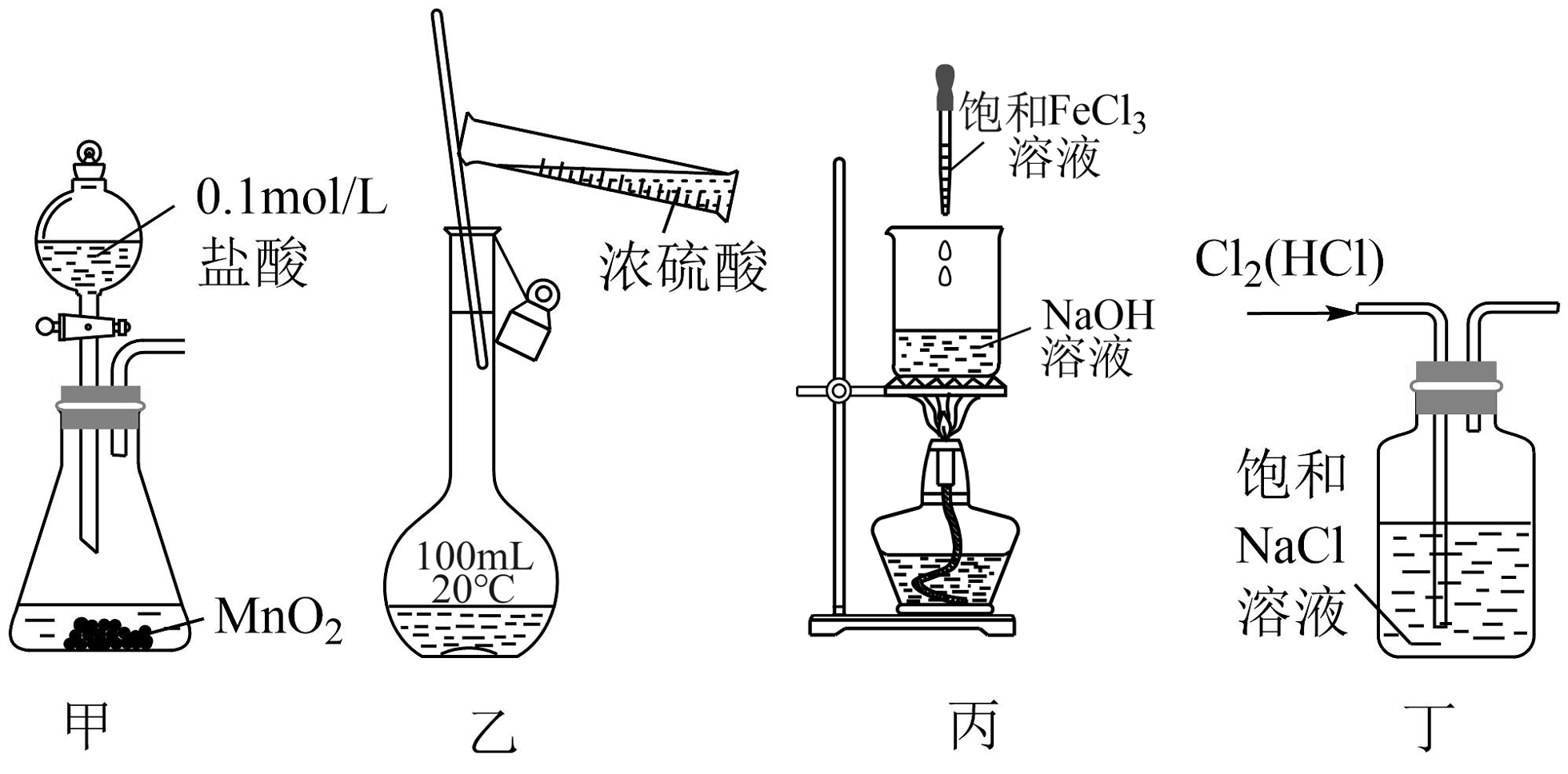 A、装置甲:实验室制取少量Cl2 B、装置乙:用浓硫酸配制一定物质的量浓度的稀硫酸 C、装置丙:制备氢氧化铁胶体 D、装置丁:除去氯气中混有的少量HCl
A、装置甲:实验室制取少量Cl2 B、装置乙:用浓硫酸配制一定物质的量浓度的稀硫酸 C、装置丙:制备氢氧化铁胶体 D、装置丁:除去氯气中混有的少量HCl -
17、下列关于Na2CO3和NaHCO3的性质说法正确的是A、碳酸氢钠晶体中加少量水会溶解,并伴有放热现象 B、碳酸钠溶液中逐滴滴加稀盐酸,开始无明显现象,一段时间后产生大量气泡 C、等物质的量的碳酸钠和碳酸氢钠固体分别与足量盐酸反应,相同条件下产生CO2体积后者多 D、可用澄清石灰水鉴别Na2CO3和NaHCO3溶液
-
18、下列有关描述对应的离子方程式书写正确的是A、食醋除去瓶胆内的水垢: B、碳酸氢钙溶液与过量的澄清石灰水混合: C、向中投入固体: D、乙醇被酸性溶液氧化成乙酸:
-
19、
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要化学反应为:。C(s)、CO(g)和完全燃烧的热化学方程式分别为:
① ;
② ;
③ 。
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和的热化学方程式:。(2)比较反应热数据可知,和完全燃烧放出的热量之和,比完全燃烧放出的热量(填“多”或“少”)。甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”。
乙同学根据盖斯定律作出了下列循环图
 (3)请你写出、、、之间存在的关系式。(4)乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现错误观点的原因是。
(3)请你写出、、、之间存在的关系式。(4)乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现错误观点的原因是。 -
20、超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为: , 下列说法正确的是A、AlN是氧化产物 B、C在反应中被还原 C、Al2O3在反应中得到电子 D、生成1mol AlN时,转移3mol电子