相关试卷
-
1、广东有众多非物质文化遗产,如粤绣、剪纸、陶瓷、藤编等。下列说法不正确的是A、粤绣用的“线”是由蚕丝纤维制成的,属于天然高分子蛋白质纤维 B、剪纸的“纸”是由植物纤维经过加工制成的,是人工高分子化合物 C、陶瓷是以黏土为主要原料,经过高温烧制形成的无机非金属材料 D、藤编使用的藤条是由植物的茎部组成的,是有机高分子材料
-
2、一种从含锗氧化锌烟尘(主要含、、及少量、的氧化物)中分离回收锌、锗的流程如下:

已知:①
②废电解液中主要含、和少量
回答以下问题:
(1)、“酸浸”时,烟尘中硫化物转化为硫单质。①可提高“酸浸”效率的措施有(写一种即可)。
②从“滤渣1”中可回收的金属主要有。
③该温度下, , 的 , 。反应的平衡常数K=。结合平衡移动原理,分析“酸浸”过程通入的目的是。
(2)、“中和还原”时,溶液中与反应生成S,该反应的离子方程式为。(3)、“沉锗”时,与结合生成的沉淀中含有(结构简式如图)。
①基态原子的核外电子排布式为。
②(单宁)的结构简式为。
(4)、“滤液4”经电沉积回收锌,电解时阴极反应式为。经电沉积后的液体可以在循环利用(填流程操作)。(5)、一种锗晶胞结构如下左图,与锗原子距离最近且相等的锗原子有个,锗原子C的原子坐标为[或],锗原子B的原子坐标为。将该晶胞沿图中体对角线投影,下左图中锗原子B投影的位置是下右图的号位(填数字)。
-
3、“诺氟沙星”(化合物G)是一种常见的治疗由敏感菌引起的各类感染的药,其工业合成路线如下(部分试剂和条件略去):
 (1)、A的化学名称是。(2)、B的结构简式为。(3)、C生成D的反应类型为。(4)、从结构角度分析,D能与反应的原因是。(5)、由D到E的化学方程式为。(6)、G中含氧官能团的名称是。(7)、具有相同官能团的B的芳香族同分异构体还有种;其中核磁共振氢谱显示2组峰的所有同分异构体结构简式是。
(1)、A的化学名称是。(2)、B的结构简式为。(3)、C生成D的反应类型为。(4)、从结构角度分析,D能与反应的原因是。(5)、由D到E的化学方程式为。(6)、G中含氧官能团的名称是。(7)、具有相同官能团的B的芳香族同分异构体还有种;其中核磁共振氢谱显示2组峰的所有同分异构体结构简式是。 -
4、铋及其化合物在医药、电子、量子材料等高精尖领域有重要的应用。一种从电解铜的副产物阳极泥熔炼渣(主要含和少量的等元素)中提取铋及贵金属银和金的工艺如图。已知:的氧化性强于。
 (1)、位于元素周期表第六周期第VA族,其基态原子的价层电子排布式为。(2)、“酸溶”时,以形式进入浸出液中,反应的离子方程式为。(3)、在溶液中会发生水解反应 , 结合平衡移动原理,解释“沉铋”时的作用:。(4)、经过“酸溶”后,和在滤渣中进一步富集,“溶金”的过程中转化为 , “操作I”之后可以重新得到金粉,则X可能是_______。A、 B、 C、 D、(5)、“脱砷”时,会转化为可溶的 , 该过程发生反应的化学方程式为。(6)、用“还原”时,并没有隔绝空气。一定温度下,的沉淀率随反应进行会先增大后减小。解释一段时间后的沉淀率逐渐减小的原因:。
(1)、位于元素周期表第六周期第VA族,其基态原子的价层电子排布式为。(2)、“酸溶”时,以形式进入浸出液中,反应的离子方程式为。(3)、在溶液中会发生水解反应 , 结合平衡移动原理,解释“沉铋”时的作用:。(4)、经过“酸溶”后,和在滤渣中进一步富集,“溶金”的过程中转化为 , “操作I”之后可以重新得到金粉,则X可能是_______。A、 B、 C、 D、(5)、“脱砷”时,会转化为可溶的 , 该过程发生反应的化学方程式为。(6)、用“还原”时,并没有隔绝空气。一定温度下,的沉淀率随反应进行会先增大后减小。解释一段时间后的沉淀率逐渐减小的原因:。 -
5、
碘酸钙可用作防臭剂、药物和食品添加剂等。实验室制备六水合碘酸钙并测定碘酸钙的方法如下。
I.六水合碘酸钙的制备
已知:。
①按图组装好仪器,加入试剂,加热,反应完全后,停止加热;
②将反应液转移至烧杯并置于冷水浴中,搅拌下依次滴入和溶液,析出白色沉淀;
③过滤,用冷水、无水乙醇依次洗涤白色沉淀,干燥,重结晶得到产品。
 (1)仪器a的名称为 , 装置b的作用是。(2)步骤①中加热方式是 , 判断反应完全的现象是。(3)步骤②中发生反应的化学方程式为。(4)步骤③中用无水乙醇洗涤滤渣的优点是。
(1)仪器a的名称为 , 装置b的作用是。(2)步骤①中加热方式是 , 判断反应完全的现象是。(3)步骤②中发生反应的化学方程式为。(4)步骤③中用无水乙醇洗涤滤渣的优点是。Ⅱ.测定碘酸钙的
称取样品并配成饱和溶液,取该溶液于碘量瓶,加过量溶液和稀 , 加入指示剂,用 , 标准溶液滴定至终点,消耗标准溶液。测定过程中发生下列反应:。
(5)指示剂为(填试剂),滴定终点现象为。 -
6、合成甲醚的反应: , 实现了二氧化碳资源化利用。在相同容器和催化剂的作用下,该反应在投料比分别为1.5、3.0时,测得的平衡转化率随温度变化如图所示。下列说法正确的是
 A、该反应的 B、代表投料比为1.5的是曲线I C、图中A、B、C、D各点,不可能同一时刻到达平衡 D、反应平衡常数:
A、该反应的 B、代表投料比为1.5的是曲线I C、图中A、B、C、D各点,不可能同一时刻到达平衡 D、反应平衡常数: -
7、寿山石的主要成分为 , X、Y、Z、W为四种原子序数递增的短周期不同族元素,X是周期表中半径最小的原子,基态Y原子有2个未成对电子,W的L层电子数是M层的2倍。下列说法正确的是A、原子半径Z<W B、简单氢化物的稳定性Y<W C、电负性Z>X D、Z最高价氧化物的水化物呈两性
-
8、“价-类-途”体现了元素化合物的内在联系和应用价值。氮及其化合物的三维关系图如图所示,下列说法不正确的是
 A、铵盐通过氧化还原反应直接得到X或W B、工业制硝酸的基础是X到Y C、雷雨天空气中存在的物质转化: D、汽车尾气处理中可能涉及反应:
A、铵盐通过氧化还原反应直接得到X或W B、工业制硝酸的基础是X到Y C、雷雨天空气中存在的物质转化: D、汽车尾气处理中可能涉及反应: -
9、中科院福建物构所制备了一种新型的铋基有机复合框架(),电池用其做电极能大大提高放电效率,电池结构如图所示,下列说法错误的是

已知:双极膜能在直流电场的作用下,将膜复合层间的解离成和并移向两极。
A、锌片为负极 B、放电时,电极上发生的反应: C、该电池工作时,锌片上每消耗锌,双极膜内将解离 D、铋基有机复合框架在电池中主要起吸附、催化转化为的作用 -
10、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
氯化铜在碱性溶液中生成沉淀
能与氨水反应生成络合离子
B
金属钠与水反应生成氢气
金属钠表面变暗
C
铜丝在氯气中燃烧生成氯化铜烟雾
铜丝质量增加
D
氯化铵受热易分解
可用加热法除去氯化钠中的氯化铵
A、A B、B C、C D、D -
11、和两种气体的制备和性质一体化探究实验装置(已省略夹持装置)如图所示。下列说法正确的是
 A、制备氯气可以采用浓盐酸与反应 B、A-2/B-2两处的品红溶液变色的原理相同,都是利用其氧化性 C、A-3/B-3两处的实验现象是一样的,都是蓝色石蕊试纸变红 D、试剂瓶C中的溶液若是氯化钡溶液,则会出现白色沉淀
A、制备氯气可以采用浓盐酸与反应 B、A-2/B-2两处的品红溶液变色的原理相同,都是利用其氧化性 C、A-3/B-3两处的实验现象是一样的,都是蓝色石蕊试纸变红 D、试剂瓶C中的溶液若是氯化钡溶液,则会出现白色沉淀 -
12、铋酸钠()是分析化学中的重要试剂。某同学设计实验制取铋酸钠,装置如图所示(加热和夹持仪器已略去),部分物质性质如表。
物质
性质
不溶于冷水,浅黄色
难溶于水,白色

下列说法错误的是
A、装置B用于除去中 B、装置C中反应的离子方程式为: C、拆除装置前必须进行的操作是关闭 , 打开 D、装置D用于除去多余的氯气 -
13、利用下列实验药品,不能达到实验目的的是
实验目的
实验药品
A
检验加碘盐中的
加碘盐、碘化钾溶液、淀粉溶液、白醋
B
判断淀粉是否水解
淀粉溶液、20%硫酸溶液、银氨溶液
C
比较镁和铝的金属性强弱
MgCl2溶液、AlCl3溶液、NaOH溶液
D
探究浓度对化学平衡移动的影响
K2CrO4溶液、HNO3溶液、NaOH溶液
A、A B、B C、C D、D -
14、亚氯酸钠()用于各种纤维和某些食品的漂白,其制备流程如下:
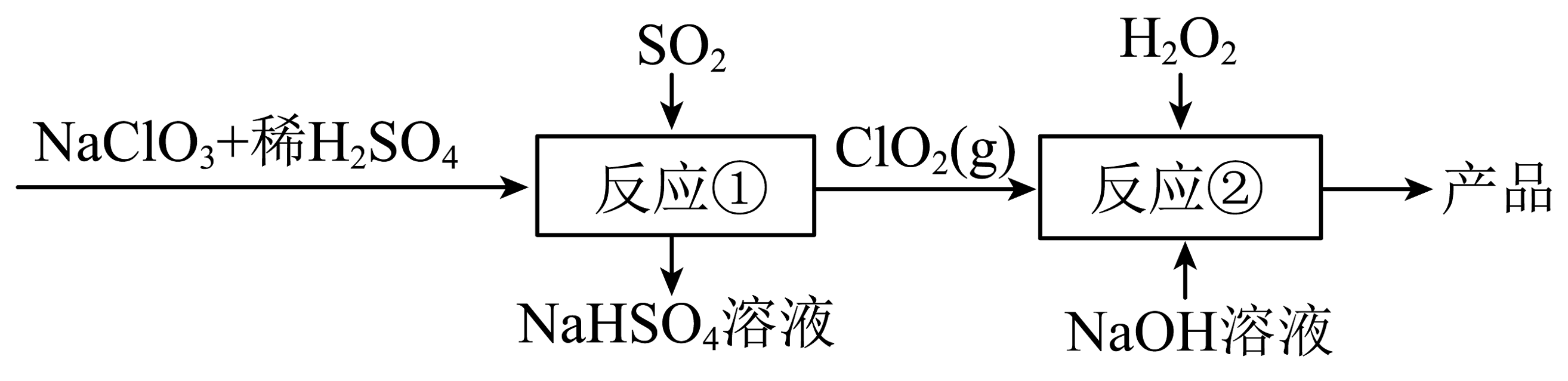
已知:下列有关离子反应错误的是
A、溶液呈碱性的原因: B、用足量氨水吸收含的尾气: C、反应①中主要发生的反应: D、反应②中主要发生的反应: -
15、利用绿矾()制备电极材料的前驱体的流程如下:
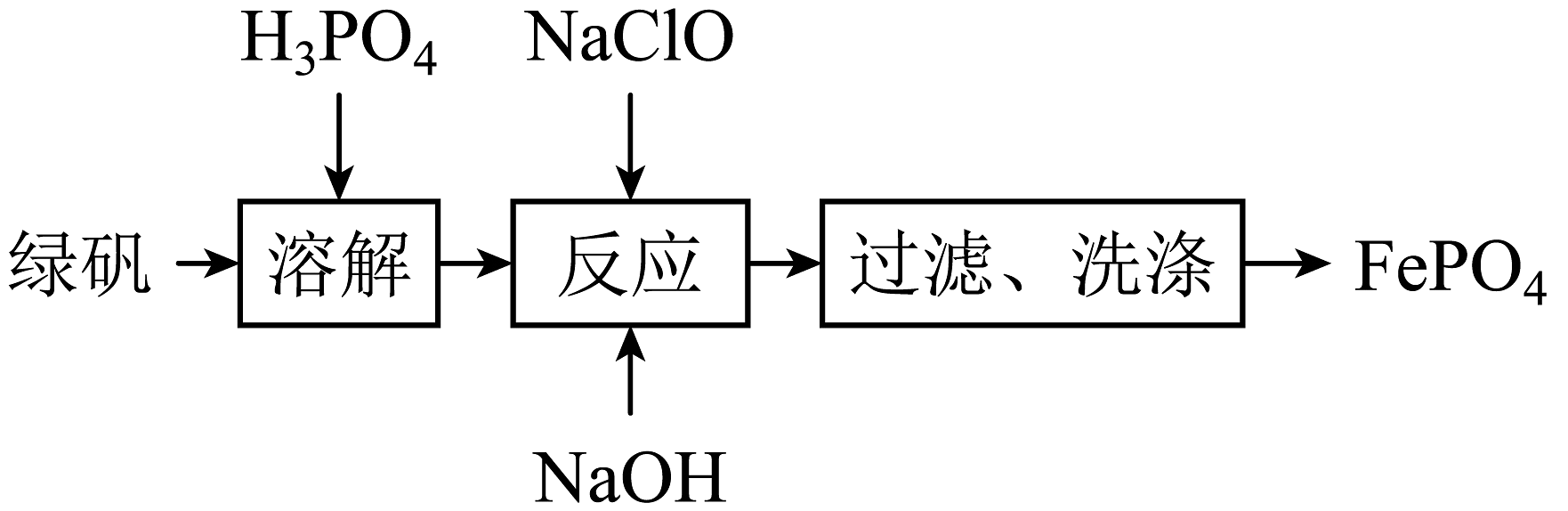
下列说法正确的是
A、溶解过程中可抑制的水解 B、可以用KSCN溶液判断反应是否完全 C、过滤需要的玻璃仪器有烧杯、玻璃棒、分液漏斗 D、反应中氧化剂与还原剂的物质的量之比为 -
16、下列选项中的物质能按图示路径一步转化,且甲和丙反应不能直接生成乙的是

选项
甲
乙
丙
A
B
C
C
D
A、A B、B C、C D、D -
17、设为阿伏加德罗常数的值。下列说法正确的是A、25℃,时,4g氦气所含分子数为 B、4.48L由乙烯、丙烯组成的混合气体中含有的氢原子数为 C、100mL的盐酸与醋酸溶液中氢离子数目均为 D、1mol与足量水蒸气反应转移电子数为
-
18、下列实验装置对应的操作正确的是
 A、加热NaOH溶液 B、制备乙酸乙酯 C、从碘水中萃取并分液提取碘 D、制备溴苯并证明发生取代反应
A、加热NaOH溶液 B、制备乙酸乙酯 C、从碘水中萃取并分液提取碘 D、制备溴苯并证明发生取代反应 -
19、下列化学用语表示正确的是A、基态铁原子价电子的轨道表示式:
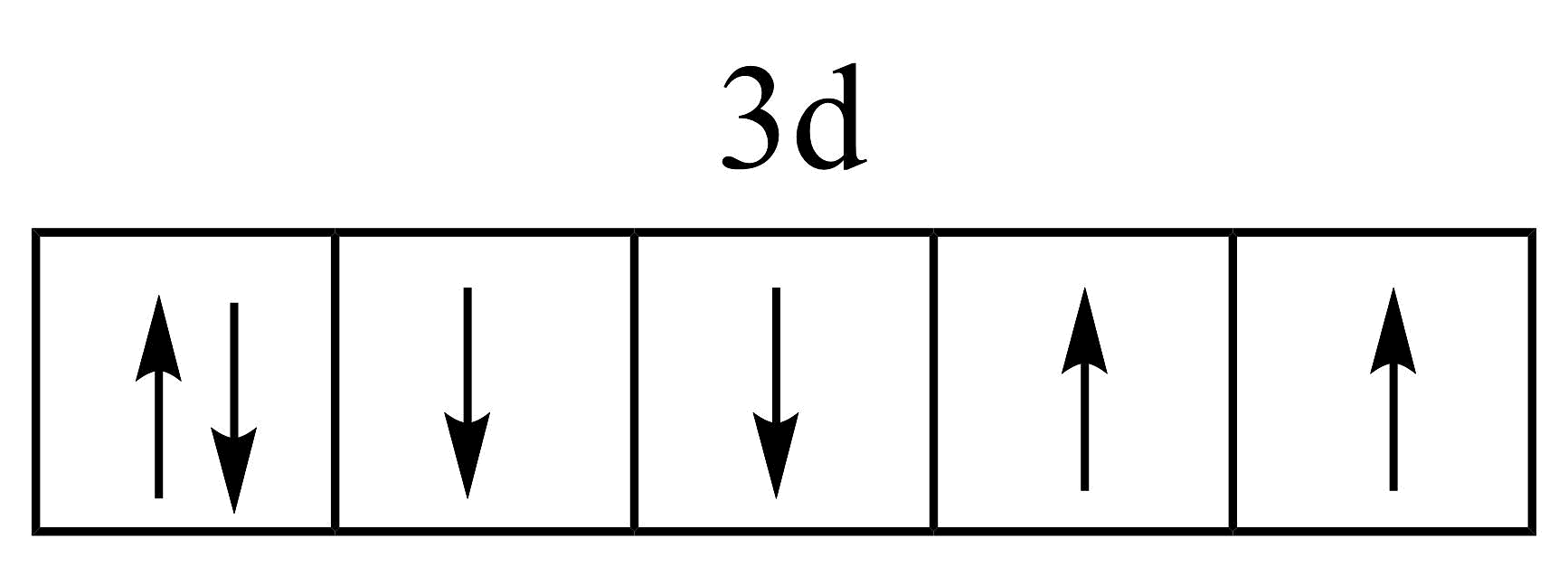 B、电子式表示NaH的形成过程:
B、电子式表示NaH的形成过程: C、的键电子云轮廓图:
C、的键电子云轮廓图: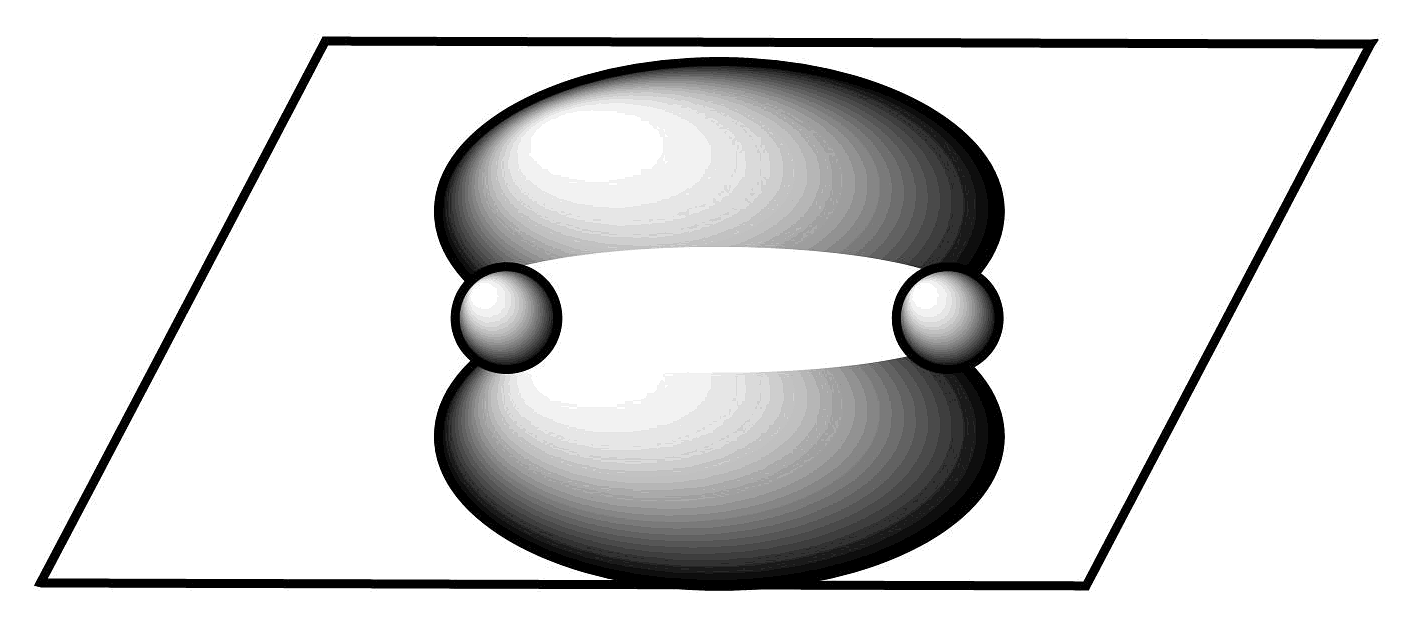 D、次氯酸的结构式:
D、次氯酸的结构式:
-
20、“扑热息痛”是重要的解热镇痛药,其结构如下。下列有关该物质的说法正确的是
 A、分子式为 B、含有2种官能团 C、所有原子可能处于同一平面 D、能与溴水发生加成反应
A、分子式为 B、含有2种官能团 C、所有原子可能处于同一平面 D、能与溴水发生加成反应