相关试卷
-
1、关于下列实验的说法中合理的是

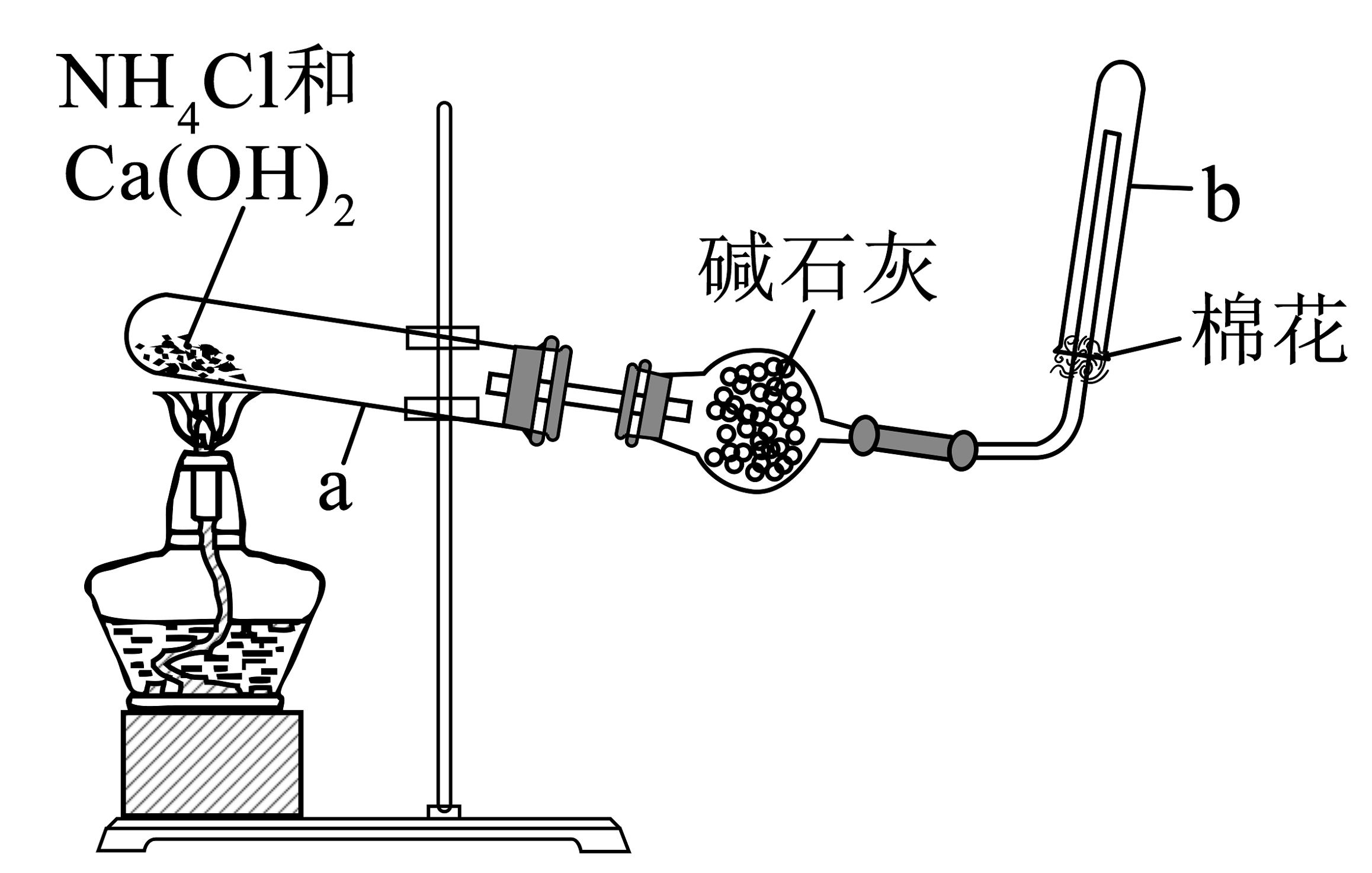
A.若将少量还原性铁粉放入试管中,再加入适量的水,加热后也可获得相同实验效果
B.图中碱石灰可替换为无水CaCl2

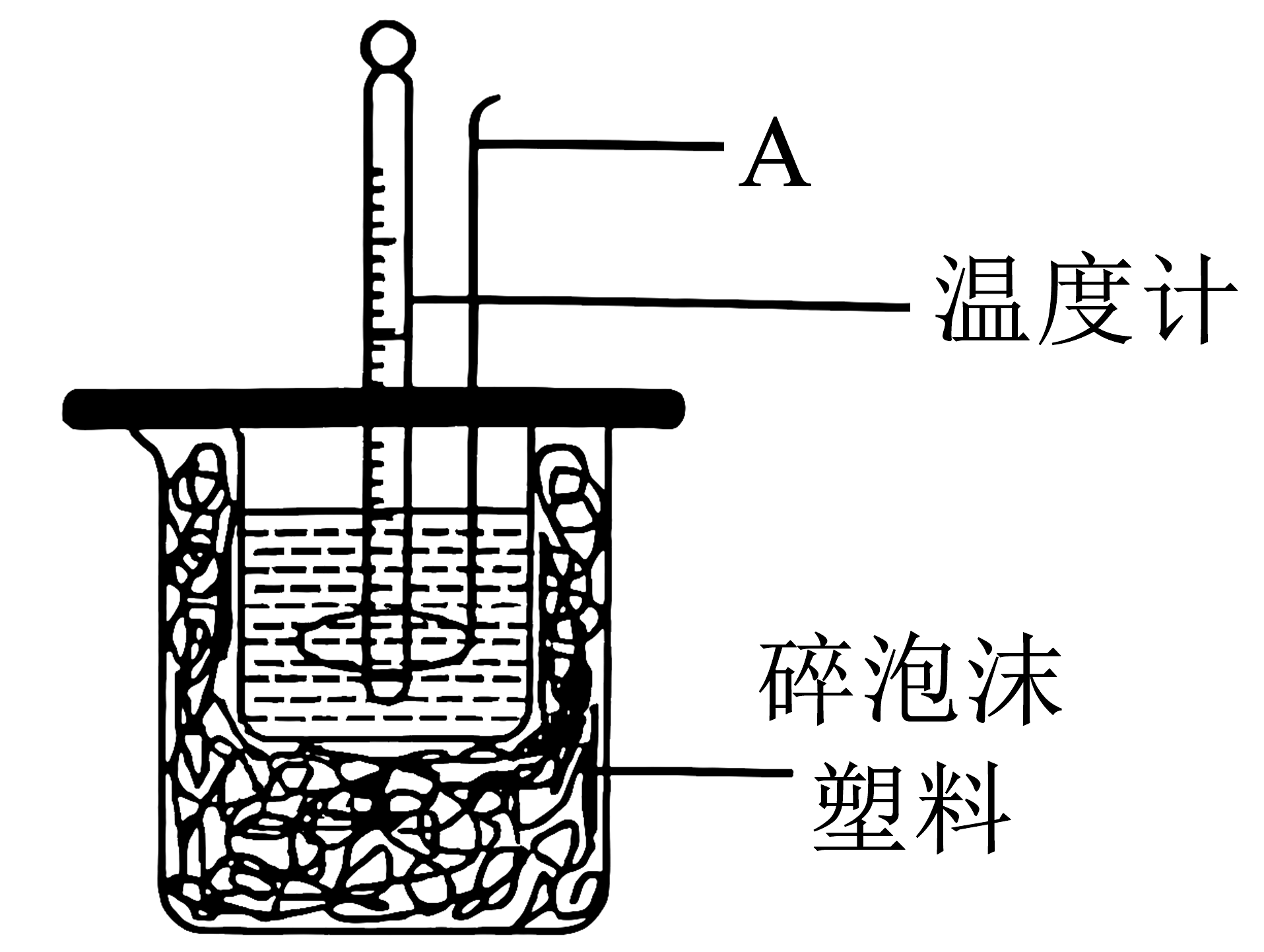
C.该装置可以证明Cu和浓HNO3反应放热
D.若用铜丝代替玻璃搅拌器,则测得的偏小
A、A B、B C、C D、D -
2、从中药茯苓中提取的茯苓新酸DM,其结构简式如图所示。下列有关茯苓新酸DM的说法错误的是
 A、分子中含有4种含氧官能团 B、可发生取代反应、加成反应和氧化反应 C、该物质在分子间和分子内都可以脱水形成酯 D、1mol该物质和足量NaOH溶液反应,可以消耗2molNaOH
A、分子中含有4种含氧官能团 B、可发生取代反应、加成反应和氧化反应 C、该物质在分子间和分子内都可以脱水形成酯 D、1mol该物质和足量NaOH溶液反应,可以消耗2molNaOH -
3、用表示阿伏加德罗常数的值,下列说法正确的是A、标准状况下,中含有的N原子数为 B、常温常压下,17g羟基中所含有的电子数为 C、用溶液制备氢氧化铁胶体,充分反应后,所得胶粒数目为 D、在反应中,每生成 , 转移的电子数为
-
4、《黄帝内经》中记载:“五谷为养,五果为助,五畜为益,五菜为充”。关于其中涉及的营养物质,下列说法中正确的有几项
①润滑油、地沟油、甘油和人造奶油都难溶于水
②淀粉和纤维素的分子式相同,但不属于同分异构体
③很多蛋白质与浓硝酸作用时呈黄色,该性质可用于蛋白质检验
④淀粉通过发酵法制得的乳酸是乙酸的同系物
⑤糖类、油脂和蛋白质都是天然高分子化合物,且均能发生水解反应
⑥在大豆蛋白溶液中,分别加入硫酸钠和硫酸铜溶液,蛋白质均析出且原理相同
⑦油脂是燃烧热最高的营养物质,形成油脂的脂肪酸饱和程度越大,油脂的熔点越高
⑧检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制悬浊液,加热,观察是否有砖红色沉淀
A、1项 B、2项 C、3项 D、4项 -
5、金属的冶炼体现了人类文明的发展水平。下列有关金属冶炼的说法正确的是A、金属被人类开发利用的先后顺序主要取决于金属的活动性 B、我国金属矿物资源丰富,储量巨大,可无限制地开采利用 C、工业上,金属Mg、Al都可由电解对应的熔融氯化物制得 D、通过电解饱和食盐水可制得单质Na
-
6、下列关于化学物质用途或性质的叙述不正确的是A、利用浓硫酸的难挥发性,可用NaCl固体和浓硫酸在加热条件下制HCl气体 B、可以用表示食醋清洗含水垢的过程 C、向饱和溶液中通入气体,会产生细小晶体 D、和热NaOH溶液都可用于清洗沾有硫单质的试管
-
7、下列资源利用过程中,在给定工艺条件下转化关系正确的是A、淀粉乙醇 B、煤水煤气 C、油脂脂肪酸 D、石油煤油
-
8、北宋科学家沈括所著的《梦溪笔谈》一书中总结了我国古代的许多科技成就,堪称“中国科学史的里程碑”。下列关于书中记载的相关说法正确的是A、“方家以磁石磨针锋,则能指南”中磁石的主要材料为FeO B、“用胶泥刻字,薄如钱唇”中胶泥的主要成分均可以和稀盐酸反应 C、“古方言云母粗服,则著人肝肺不可去”中云母的主要成分为铝硅酸盐 D、“大卤之水,不得甘泉和之不能成盐,唯巫咸水入则盐不复结……原其理,盖巫咸乃浊水,入卤中则淤淀卤脉,盐遂不成,非有他异也”中的“巫咸水”是一种悬浊液
-
9、下列反应可以得到多卤化物:、。下列说法不正确的是A、中阴阳离子个数比是 B、苯与在催化剂作用下发生取代反应可生成碘苯 C、受热分解生成的产物含有 D、能使湿润的淀粉试纸变蓝色
-
10、化学技术和化学物质可造福人类生活。下列说法不正确的是A、利用液氮、液氢做火箭推进剂,可有效减少对环境的污染 B、硫酸亚铁可用作处理污水的混凝剂 C、丙三醇有吸水性,可用于配制化妆品 D、氯化镁、硫酸钙等可用作生产豆腐的凝固剂
-
11、氯化铁是一种常见水处理剂,实验室通过下列装置制取少量氯化铁:

已知:①氯化铁的熔点306℃、沸点316℃,
②氯化铁易升华,易吸收空气里的水分而变质。
③氯化铁的摩尔质量为。
(1)、仪器G的名称是 , C中装入的试剂是。(2)、A中发生的化学方程式是。装置F的作用是。(3)、实验时,先点燃处(填“A”或“D”)的酒精灯。(4)、有同学提出改进意见:B处增加长颈漏斗,下端插入液面下(如图)。
该改进意见主要考虑实验安全,则该改进的作用是。
-
12、铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。日常生活中可通过食物摄入铁元素,例如黑木耳中就含有比较丰富的铁元素。某研究性学习小组为测定某地黑木耳中铁的含量,开展了如下研究与实践活动。
【研究与实践活动一】
研究黑木耳中含铁物质的水溶性:称取a g黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
【研究与实践活动二】
研究黑木耳中铁的含量:称取a g黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。

回答下列问题:
(1)、浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质溶于水(选填“能”或“不能”)。(2)、取少量滤液于试管中,滴入KSCN溶液,溶液变红。则滤液中铁元素的存在形式有、(填离子符号)。(3)、滤液与Fe生成A的离子方程式是。(4)、由A转化为B可加入的试剂X可以是(填字母)a.() b. c.
(5)、由C转化成D的现象是:白色沉淀迅速变为灰绿色,最终变为。(6)、将a g黑木耳中的铁元素经流程A→C-D进行完全转化,将D经过一系列处理,得到b g红棕色固体。若流程中加入的铁反应掉c g,则该黑木耳中铁元素的质量分数为(用含a、b、c的代数式表示)。 -
13、过氧化钠作为呼吸面具和潜水艇的供氧剂研究。请用下图中的实验装置,选用适当的化学试剂和实验用品进行实验,证明过氧化钠可作供氧剂。
 (1)、A是制取CO2的装置。B中加入的试剂,下列合理的是___________(填序号)。A、NaOH溶液 B、饱和食盐水 C、Na2CO3溶液 D、饱和NaHCO3溶液(2)、C中加入的试剂是(填化学式),其中发生的化学反应有。(3)、D中加入的试剂是 , 其目的是。
(1)、A是制取CO2的装置。B中加入的试剂,下列合理的是___________(填序号)。A、NaOH溶液 B、饱和食盐水 C、Na2CO3溶液 D、饱和NaHCO3溶液(2)、C中加入的试剂是(填化学式),其中发生的化学反应有。(3)、D中加入的试剂是 , 其目的是。 -
14、化学应用分析。(1)、火药是中国的四大发明之一、黑火药在发生爆炸时,发生如下反应:。其中氧化剂的是(填化学式)。(2)、中国古代著作中有“银针验毒”的记录,其原理为: , 则X的化学式是 , 其中H2S在该反应中(填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)、波尔多液是一种保护性杀菌剂,因首先在法国波尔多大量使用而得名。某化学课外小组按照以下流程制备了波尔多液。i.将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜,蒸发浓缩结晶即可以得到胆矾。写出生成硫酸铜的化学方程式。
ii.将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液。
①此波尔多液中Cu2+离子和Ca2+离子的物质的量比为(最简整数比)。
②波尔多液有效成分的化学式可表示为 , 此种配比中,当x=1时,则y=。
-
15、铁与水蒸气反应的实验装置如图,下列说法正确的是
 A、实验时,试管口应高于试管底 B、加热时试管内生成红棕色物质,点燃肥皂泡可听到爆鸣声 C、反应的化学方程式为2Fe+3H2O(g)Fe2O3+3H2 D、试管中发生置换反应
A、实验时,试管口应高于试管底 B、加热时试管内生成红棕色物质,点燃肥皂泡可听到爆鸣声 C、反应的化学方程式为2Fe+3H2O(g)Fe2O3+3H2 D、试管中发生置换反应 -
16、科学家开发出一种低成本光伏材料-蜂窝状石墨烯。生产原理是:下列说法错误的是A、该反应中氧化剂与还原剂的质量之比为1:1 B、Na2O和Na2CO3都属于电解质 C、Na2O是氧化剂,属于碱性氧化物 D、石墨烯是还原产物
-
17、下列离子方程式书写错误的是A、溶液中通入 B、溶液与盐酸的反应: C、钠与水的反应: D、大理石中加入盐酸:
-
18、下列离子在稀硫酸中能大量存在的是A、HCO B、OH- C、Cl- D、Ba2+
-
19、下列电离方程式正确的是A、 B、 C、 D、
-
20、依据下列实验事实,所得结论正确的是
选项
A
B
C
D
实验




结论
铁是电解质
NaCl固体中不含离子
NaCl在通电条件下发生电离
NaCl是电解质
A、A B、B C、C D、D