相关试卷
-
1、草酸H2C2O4是二元弱酸。向100 mL 0.40 mol·L-1 H2C2O4溶液中加入1.0 mol·L-1NaOH或HCl溶液调节pH,加水控制溶液体积为200 mL。测得溶液中微粒的δ(x)随pH变化如图所示,其中δ(x)=
, x代表微粒H2C2O4、或。下列叙述正确的是
 A、曲线I是的变化曲线 B、pH=4时, C、c(H2C2O4)+c()+c()=0.40 mol·L-1 D、c()+c(OH-)= c(H2C2O4)+c(H+)
A、曲线I是的变化曲线 B、pH=4时, C、c(H2C2O4)+c()+c()=0.40 mol·L-1 D、c()+c(OH-)= c(H2C2O4)+c(H+) -
2、锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备和交通工具的常用电池。一种锂离子电池, 其负极材料为嵌锂石墨,正极材料为LiCoO2 , 放电总反应为: LixCy+Li1-xCoO2 =LiCoO2+Cy。下列说法不正确的是A、放电时, 有1 mol Li +迁移到负极时,外电路中有1mol电子通过 B、放电时,正极反应可表示为Li1-xCoO2+xLi+ +xe-= LiCoO2 C、充电时,阴极反应可表示为Cy+xe- +xLi+=LixCy D、该电池不可用水做溶剂
-
3、在VSEPR中,电子对斥力大小顺序可认为:孤对电子-孤对电子>孤对电子-成键电子>成键电子-成键电子,当电子对之间的夹角大于90°时,斥力可忽略。当价层电子对数为5时,构型为三角双锥。PCl5是典型的三角双锥分子,两个编号为①的Cl原子和P在一条直线上,三个编号为②的Cl原子构成平面正三角形。SF4和BrF3价层电子对数也都是5,但它们分别有1对和2对孤对电子,以下图为参照。则它们的孤对电子分别占据什么位置时,价层电子对间斥力最小。

A
B
C
D
SF4
①
①
②
②
BrF3
①①
①②
①①
②②
A、A B、B C、C D、D -
4、如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述正确的是
X
W
Y
R
Z
A、X的简单氢化物沸点高于W的简单氢化物 B、X2、Z2的分子中均存在π键 C、氧化物水化物酸性:X>W D、第一电离能:W<Y<R -
5、用NA表示阿伏加德罗常数的值,下列说法正确的是A、25℃时, 将1mL1×10-6 mol·L-1的盐酸稀释至1000mL, 溶液中H+数目为10-9NA B、25℃时,pH=9的CH3COONa溶液中所含OH-数目为10-5NA C、标况下,12g金刚石中所含的碳碳键数为2NA D、常温常压下,28g乙烯中含有的σ键数为6NA
-
6、下列“类比”结果正确的是A、H2S晶体中一个H2S分子周围有12个H2S紧邻,则冰中一个水分子周围也有12个紧邻分子 B、AlCl3中Al原子是sp2杂化,则Al2Cl6中Al原子也是sp2杂化 C、Mg在过量氧气中燃烧生成MgO,则锂在过量氧气燃烧也生成Li2O D、乙醇CH3CH2OH能与水互溶,则戊醇CH3CH2CH2CH2CH2OH也能与水互溶
-
7、下列说法不正确的是A、超分子是由两种或两种以上的分子通过化学键作用形成的分子聚集体 B、过渡金属配合物远比主族金属配合物多 C、石墨中电子不能从一个平面跳跃到另一个平面 D、晶体具有自范性,某些物理性质会表现出各向异性
-
8、下列说法正确的是A、对于氢键A- H…B, 氢键键长指的是H…B的长度 B、基态原子中,电子填入所有轨道总是先单独分占,且自旋平行 C、烃基是吸电子基团,羧酸的烃基越长,使羧基中的羟基极性越大,羧酸酸性越强 D、玛瑙是熔融态SiO2快速冷却形成的,水晶是熔融态SiO2缓慢冷却形成的
-
9、下列说法正确的是A、用广泛pH试纸测得某溶液pH为10.2 B、实验中出现几次误差较大的数据,可计算它们的平均值减小误差 C、用TiCl4制备TiO2时,需要加入大量的水并加热,促使水解趋于完全 D、电镀时,通常把待镀的金属制品一端作阳极
-
10、下列说法正确的是A、在等温条件下进行的化学反应,其反应热等于反应的焓变 B、化学反应速率首先由反应物的组成、结构和性质等因素决定 C、化学平衡常数通常受温度、压强、浓度等影响 D、改变影响平衡的一个因素, 平衡就向能够抵消这种改变的方向进行
-
11、关于方程式中正确的是A、表示丙烷燃烧热的热化学方程式:C3H8(g)+ 5O2(g)=3CO2(g)+4H2O(g) ΔH= -2219.9 kJ/mol B、HI分解的基元反应: 2HI=H2+I2 C、碳酸的第二步电离: HCOH++CO D、铅酸蓄电池负极反应式: Pb-2e-=Pb2+
-
12、下列说法正确的是A、s电子的形状为球形 B、单质气体分子均为非极性分子 C、Fe 和Zn位于元素周期表不同区 D、3p2 表示3p能级有两个轨道
-
13、下列属于基态Na原子的电子排布式的是A、1s22s22p6 B、1s22s22p53s2 C、1s22s22p33p1 D、1s22s22p63s1
-
14、下列表示不正确的是A、HCN分子中的极性 B、CO2 的空间结构模型
 C、sp2杂化轨道
C、sp2杂化轨道 D、H2O的VSEPR模型
D、H2O的VSEPR模型
-
15、在测定Zn与H2SO4反应速率实验中,下列仪器不需要用到的是A、
 B、
B、 C、
C、 D、
D、
-
16、下列物质的化学成分不正确的是A、铁锈: Fe2O3 B、纯碱: Na2CO3 C、白磷: P4 D、硫黄: S8
-
17、下列物质属于弱电解质的是A、NH3 B、H2O C、H2SO4 D、KOH
-
18、在试管中进行的盐酸与NaOH溶液之间的反应,属于环境的是A、盐酸 B、NaOH溶液 C、发生的反应 D、试管
-
19、
I纯碱和小苏打都是重要的化工原料,在生产和生活中有若广泛的应用。

(1)图1、2中,能更简便说明二者的稳定性,图2中受热处发生反应的化学方程式为。
(2)与水反应生成一种强碱和可燃性气体,写出反应的化学方程式并用单线桥表示电子转移的方向和数目。
II.我国化学家侯德榜发明了联合制碱法(),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去)。

(3)流程图中标注的物质属于电解质的有种,①~③所涉及的操作方法中,包含过滤的是(填序号)。
(4)和可以相互转化,若要除去溶液中的 , 最好的方法是:(用化学方程式表示)。
(5)关于上述流程,下列说法中正确的是(填字母)。
a.两种气体的先后顺序为先通入 , 再通入
b.先析出的原因是可能析出的各种物质中的溶解度最小
c.整个流程中涉及氧化还原反应
d.溶液B中的主要离子为、、、
-
20、1810年,英国化学家戴维以大量事实为依据,确认一种黄绿色气体是一种新元素组成的单质——氯气。某化学兴趣小组同学利用以下装置制备干燥的氯气并对氯气的性质进行探究。
 (1)、仪器b的名称为。B中试剂的作用。(2)、仪器a中发生反应的化学方程式为 , 根据氯气的性质D中的收集装置可以选择(填序号)。
(1)、仪器b的名称为。B中试剂的作用。(2)、仪器a中发生反应的化学方程式为 , 根据氯气的性质D中的收集装置可以选择(填序号)。 (3)、下列有关该实验的说法中不正确的是(填字母)。
(3)、下列有关该实验的说法中不正确的是(填字母)。A.将b中液体换为稀盐酸,同样可以产生氯气
B.C中试剂是浓硫酸,目的是干燥氯气
C.E中红色布条不褪色,F中红色布条褪色证明氯气具有漂白性
(4)、某同学用含酚酞的稀溶液吸收尾气,一段时间后含酚酞的溶液褪色。可能原因有。①不断通入的氯气与氢氧化钠发生反应,将氢氧化钠消耗完所致。
②。
(5)、甲同学用足量与含的浓盐酸反应制氯气,乙同学用与足量浓盐酸反应制氯气,两者制得氯气(填“甲多”,“乙多”,“一样多”)。(6)、用收集满氯气的D做如图1的实验:先添加适量的蒸馏水,振荡,然后用注射器滴加溶液,再用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是_______(双项)(加入的液体和盐酸溶液的体积对压强的影响忽略不计)。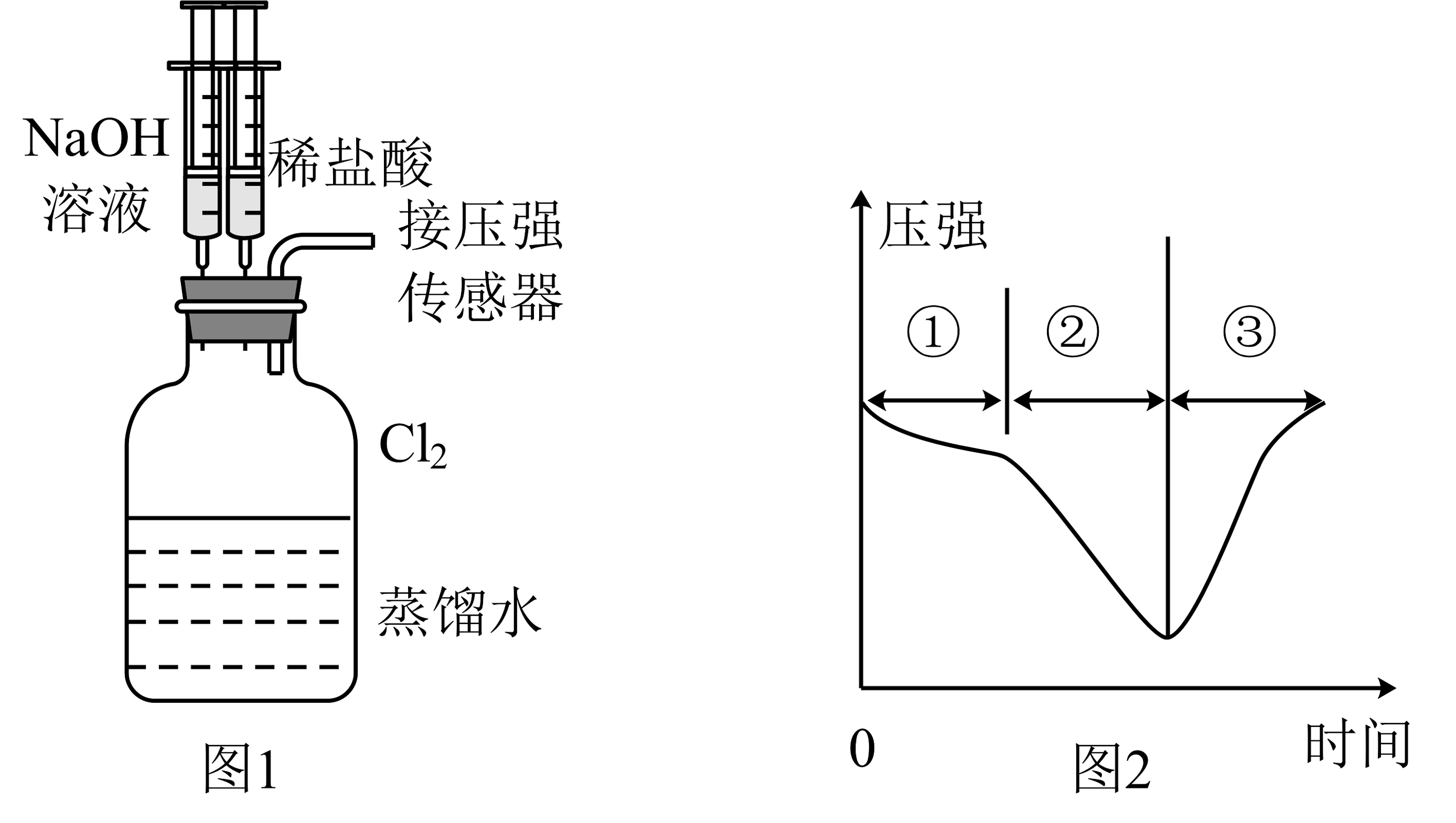 A、阶段①说明溶于水,溶于水的全部与水反应 B、阶段②的压强变小,说明被溶液完全吸收 C、阶段③发生反应的离子方程式为 D、若将换成 , 所得的压强变化趋势可能与图2相似
A、阶段①说明溶于水,溶于水的全部与水反应 B、阶段②的压强变小,说明被溶液完全吸收 C、阶段③发生反应的离子方程式为 D、若将换成 , 所得的压强变化趋势可能与图2相似