相关试卷
-
1、下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色(部分反应物或生成物已略去)。
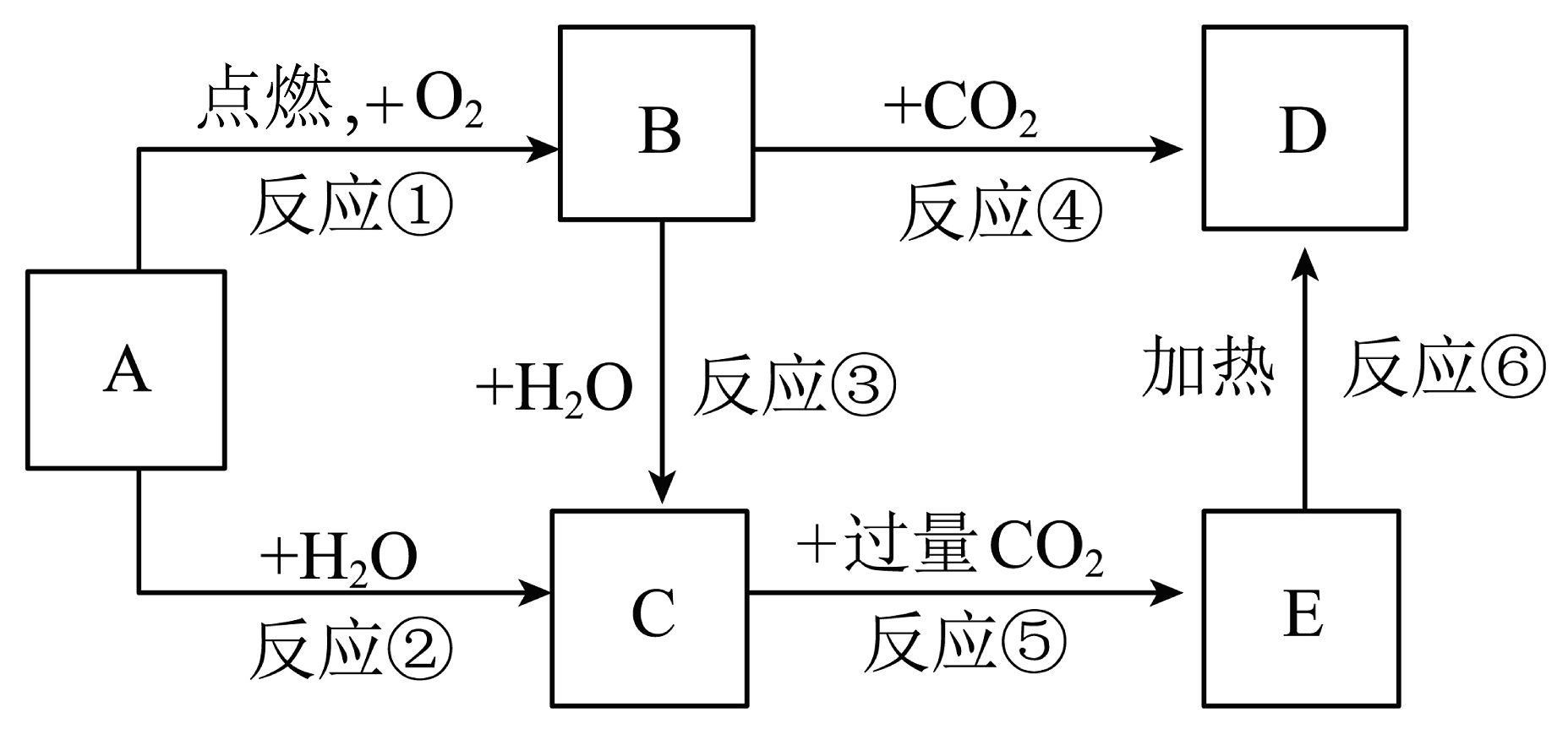
回答问题:
(1)、写出下列化学式:A , D。(2)、写出反应②的离子反应方程式:。(3)、写出反应④的化学反应方程式:。(4)、若取7.8g B与足量水反应,则转移电子的物质的量为mol。(5)、除去E溶液中混入的D杂质最佳方法是。 -
2、回答下列问题:(1)、化合价是学习氧化还原反应的基础。写出以下几种物质中加点元素的化合价。
, , 。
(2)、根据氧化还原反应的价态变化规律判断以下三个化学方程式(未配平)可能实现的是(填序号)。①;②;③
(3)、是未来的清洁能源。一种可以利用太阳能制氢的方法如下:i. ii.
①反应i中的氧化剂是 , 氧化产物是。
②反应ii在标准状况下制得 , 共转移0.3mol电子。
③该方法中循环利用的物质是。
-
3、实验室用和浓盐酸制取氯气时,有7.3g氯化氢被氧化,所得全部用冷的石灰乳吸收,可制得漂白粉的质量是A、14.3g B、12.7g C、25.4g D、50.8g
-
4、下列几种离子在稀硫酸溶液中的转化关系如图所示。下列说法正确的是
 A、反应1中氧化剂是 B、反应2的还原产物为 C、反应能发生 D、氧化性:
A、反应1中氧化剂是 B、反应2的还原产物为 C、反应能发生 D、氧化性: -
5、下列离子方程式书写正确的是A、氧化铜与稀盐酸混合: B、锌片插入硝酸银溶液中: C、实验室用大理石和稀醋酸制取 D、氢氧化钡溶液与足量硫酸铜溶液混合:
-
6、下列基本概念错误的是A、物质的量是表示含有一定数目微粒的集合体,其单位为mol B、阿伏加德罗常数是指1mol任何粒子的粒子数,其单位为 C、摩尔质量指的是单位物质的量的物质所具有的质量,单位为g D、气体摩尔体积是单位物质的量的气体所占的体积,单位有
-
7、设表示阿伏加德罗常数的数值,下列叙述中正确的是A、所含有的原子数为 B、常温常压下,22.4L氦气所含的原子数为 C、中所含的氧原子数为 D、18g水所含电子数目为
-
8、焰色试验过程中铂丝的清洗和灼烧与钾焰色的观察两项操作如图所示。下列叙述中正确的是
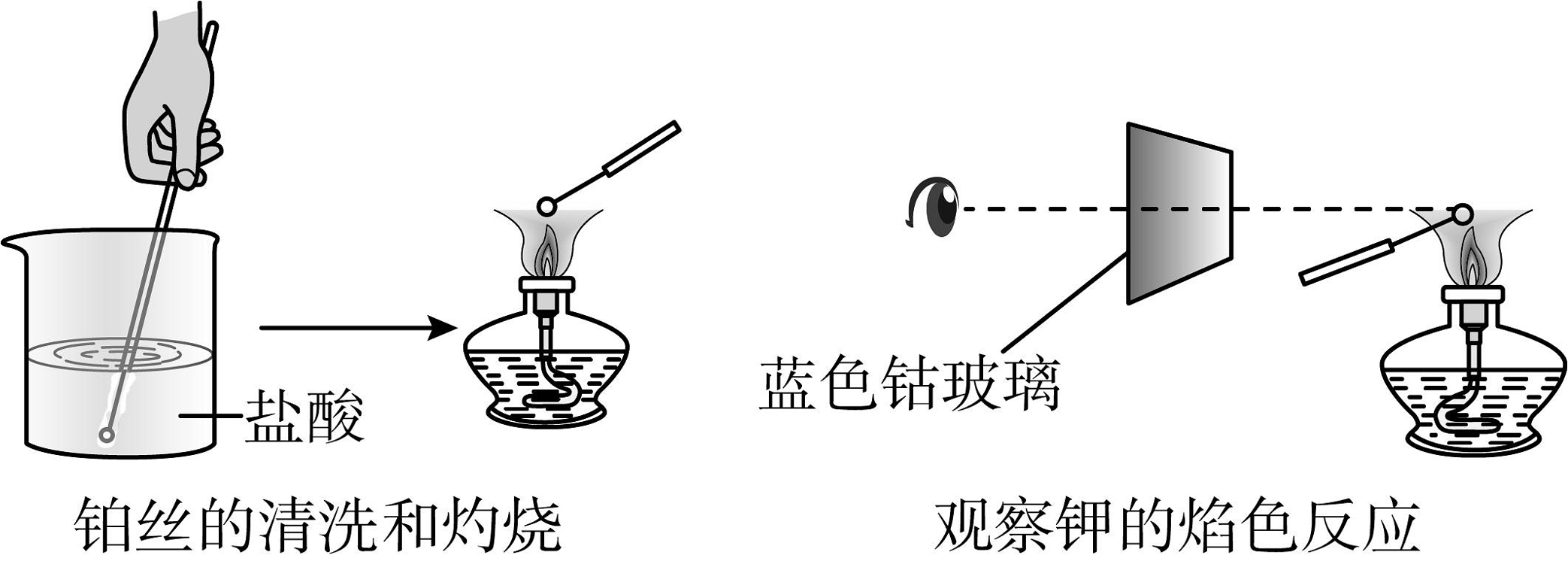 A、所有金属或其化合物灼烧时都会使火焰呈现特征颜色 B、可用稀硫酸代替盐酸清洗铂丝 C、用灼热的铂丝蘸取某固体样品进行焰色实验,火焰颜色为黄色,证明该固体样品中一定含有钠盐 D、为了滤去黄色的光,需透过蓝色钴玻璃观察钾元素的焰色
A、所有金属或其化合物灼烧时都会使火焰呈现特征颜色 B、可用稀硫酸代替盐酸清洗铂丝 C、用灼热的铂丝蘸取某固体样品进行焰色实验,火焰颜色为黄色,证明该固体样品中一定含有钠盐 D、为了滤去黄色的光,需透过蓝色钴玻璃观察钾元素的焰色 -
9、下列生活中的物质与其有效成分,用途一一对应关系中,不正确的是
选项
A
B
C
D
生活中的物质
纯碱
苏打
漂白液
漂白粉
有效成分
用途
制玻璃
做食用碱
做消毒剂
做漂白剂
A、A B、B C、C D、D -
10、下列选项中所示的物质间转化不能一步实现的是A、 B、 C、 D、
-
11、实验室用如下原理制备:(浓) , 下列说法正确的是A、该反应中氧化产物是 B、该反应中还原剂与氧化剂物质的量之比为1:2 C、该反应中每生成转移电子1mol D、随反应进行硫酸浓度逐渐减低,则可能发生反应
-
12、下列各物质所含原子数由多到少的顺序是
①(标准状况) ②个氦气分子 ③ ④(标准状况)
A、①③②④ B、①②③④ C、③④①② D、④②③① -
13、“价-类”二维图是学习元素及其化合物知识的重要模型。氯元素的“价-类”二维图如图所示。下列说法错误的是
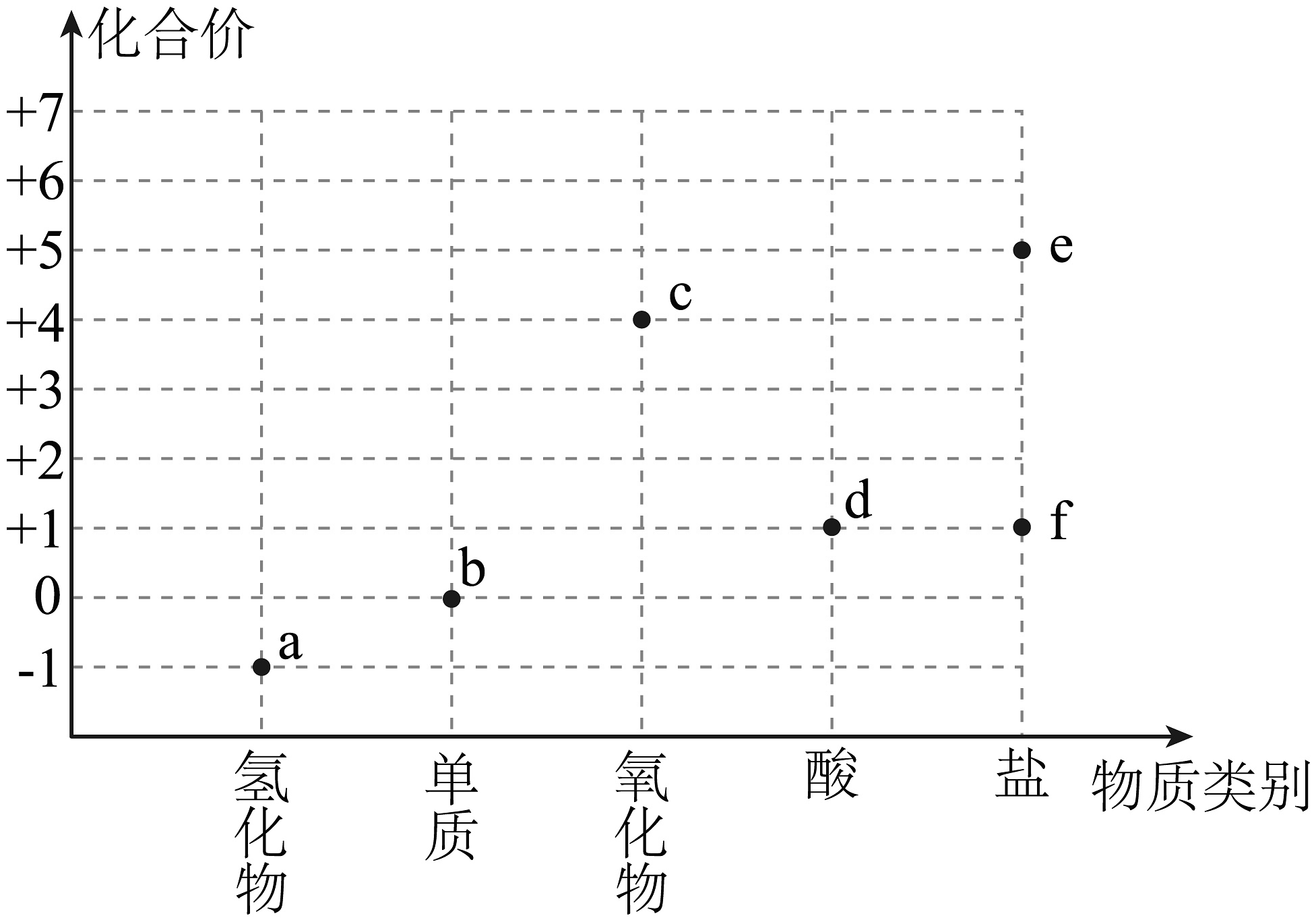 A、从氧化还原反应角度分析:a与d反应制取b B、从类别的角度分析:a与f反应制取b C、d的水溶液性质不稳定,其溶液久置后酸性减弱 D、b、c、d、f都具有强氧化性,可用于杀菌消毒
A、从氧化还原反应角度分析:a与d反应制取b B、从类别的角度分析:a与f反应制取b C、d的水溶液性质不稳定,其溶液久置后酸性减弱 D、b、c、d、f都具有强氧化性,可用于杀菌消毒 -
14、在做“氢气在氯气中燃烧”实验时,不需要标识的图标是A、
 B、
B、 C、
C、 D、
D、
-
15、下列说法正确的是A、中含有分子 B、标准状况下,所占的体积约为44.8L C、中含有的氢原子数目约为 D、硫酸溶液中含有个氧原子,则硫酸的物质的量是0.125mol
-
16、下列两种物质间的反应,不可用离子方程式“”表示的是A、NaOH溶液与溶液 B、澄清石灰水与盐酸 C、溶液与稀硝酸 D、KOH溶液与次氯酸
-
17、下列各组离子在水溶液中一定能大量共存的是A、、、、 B、、、、 C、、、、 D、、、、
-
18、下列关于和的性质说法正确的是
 A、时,碳酸氢钠在水中的溶解度比碳酸钠大 B、分别向和溶液中滴加溶液产生白色沉淀 C、分别向和固体中加入少量水,温度变化不同 D、可利用图示装置来比较和的热稳定性
A、时,碳酸氢钠在水中的溶解度比碳酸钠大 B、分别向和溶液中滴加溶液产生白色沉淀 C、分别向和固体中加入少量水,温度变化不同 D、可利用图示装置来比较和的热稳定性 -
19、下列关于金属钠的叙述不正确的是A、金属钠保存在石蜡油或煤油中 B、钠未用完应放回原试剂瓶 C、钠具有强还原性,能置换出溶液的Cu D、当火灾现场存放有大量金属钠时,需用干燥的沙土来灭火
-
20、下列转化中,需要加入氧化剂才能实现的是A、 B、 C、 D、