相关试卷
-
1、吸收工厂烟气中的 , 能有效减少对空气的污染。氨水、水悬浊液吸收烟气中后经催化氧化,可得到硫酸盐。
已知:室温下,微溶于水,易溶于水;溶液中的物质的量分数随的分布如图-1所示。
 (1)、氨水吸收。向氨水中通入少量 , 该反应的离子方程式为;当通入至溶液时,溶液中浓度最大的阴离子是(填化学式)。(2)、水悬浊液吸收。向水悬浊液中匀速缓慢通入 , 在开始吸收的内,吸收率、溶液均经历了从几乎不变到迅速降低的变化(见图-2)。溶液几乎不变阶段,主要产物是(填化学式);吸收率迅速降低阶段,主要反应的化学方程式为。
(1)、氨水吸收。向氨水中通入少量 , 该反应的离子方程式为;当通入至溶液时,溶液中浓度最大的阴离子是(填化学式)。(2)、水悬浊液吸收。向水悬浊液中匀速缓慢通入 , 在开始吸收的内,吸收率、溶液均经历了从几乎不变到迅速降低的变化(见图-2)。溶液几乎不变阶段,主要产物是(填化学式);吸收率迅速降低阶段,主要反应的化学方程式为。 (3)、催化氧化。其他条件相同时,调节吸收得到溶液的在范围内,越低生成速率越大,其主要原因是;随着氧化的进行,溶液的将(填“增大”、“减小”或“不变”)。
(3)、催化氧化。其他条件相同时,调节吸收得到溶液的在范围内,越低生成速率越大,其主要原因是;随着氧化的进行,溶液的将(填“增大”、“减小”或“不变”)。 -
2、工业合成的反应为 。(1)、已知:时,部分物质的相对能量如表所示。
物质
相对能量/()
0
, 此条件下的燃烧热的燃烧热(填“>”“<”或“=”)。
(2)、催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是___________(填选项字母)。A、 B、
B、 C、
C、 D、
D、 (3)、恒容密闭容器中充入一定量的和合成 , 下列示意图正确且能说明该反应进行到时刻达到平衡状态的是___________(填选项字母)。A、
(3)、恒容密闭容器中充入一定量的和合成 , 下列示意图正确且能说明该反应进行到时刻达到平衡状态的是___________(填选项字母)。A、 B、
B、 C、
C、 D、
D、 (4)、恒温、恒容的密闭容器中充入和(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(4)、恒温、恒容的密闭容器中充入和(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
①用表示的化学反应速率为(用单位时间内压强变化量表示)。
②反应达到平衡时的转化率为。
③此反应的分压平衡常数为以分压表示的平衡常数,物质的量分数;用含的式子表示)。
-
3、二氧化碳加氢制甲烷过程中的主要反应:
反应Ⅰ
反应Ⅱ
压强为101kPa下,在密闭容器中投入1mol和4mol在催化剂作用下发生反应。平衡时,转化率、产率及另外2种含氢气体的物质的量随温度的变化如题图所示。CO选择性可表示为。下列说法正确的是
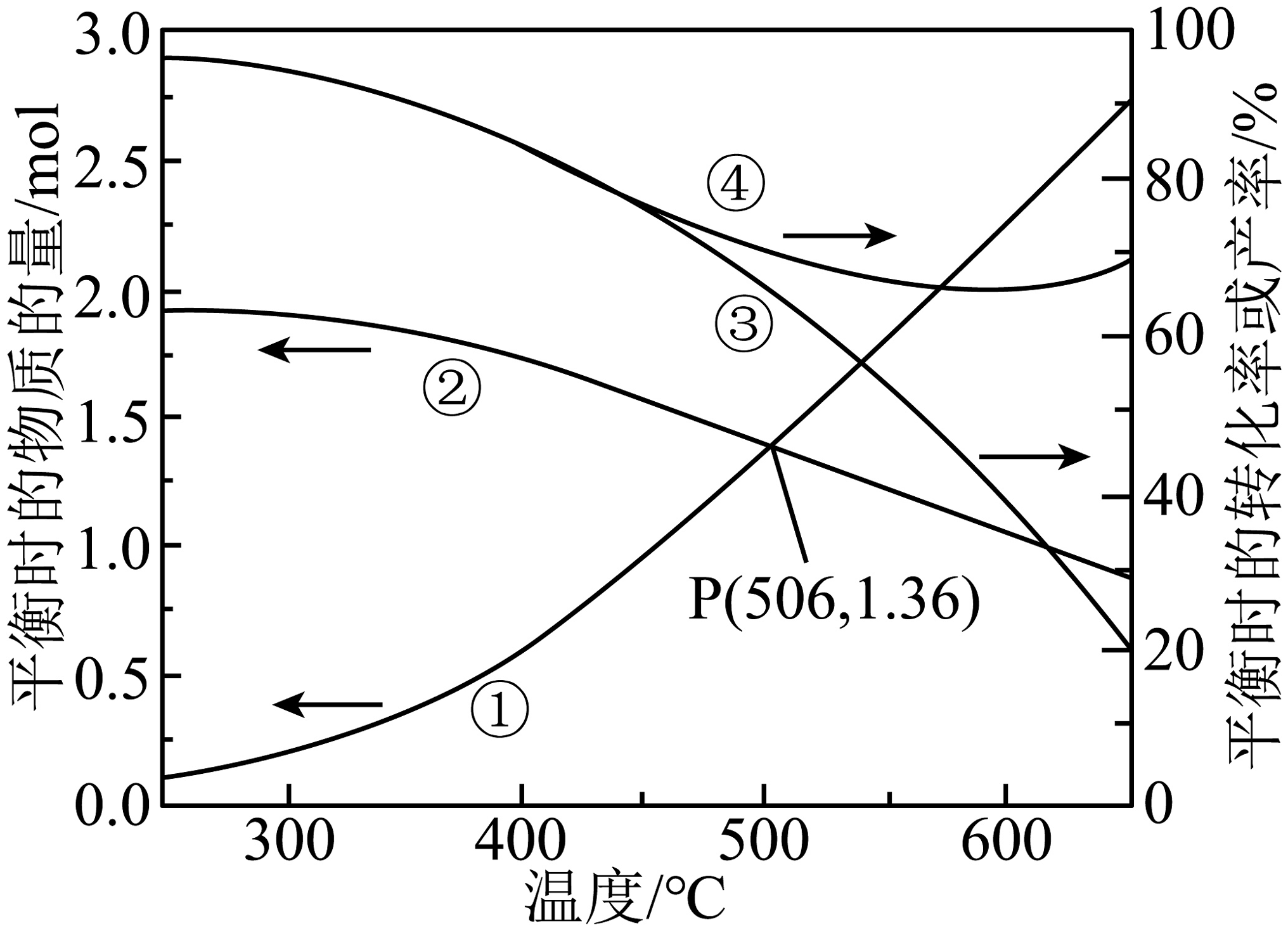 A、图中曲线②、曲线④分别表示平衡时物质的量、转化率随温度的变化 B、反应Ⅰ的、反应Ⅱ的 C、图中P点对应温度下,平衡时CO选择性为11.1% D、450℃之后,温度升高导致催化剂活性降低,从而导致甲烷平衡产率减小
A、图中曲线②、曲线④分别表示平衡时物质的量、转化率随温度的变化 B、反应Ⅰ的、反应Ⅱ的 C、图中P点对应温度下,平衡时CO选择性为11.1% D、450℃之后,温度升高导致催化剂活性降低,从而导致甲烷平衡产率减小 -
4、室温下,通过下列实验探究SO2的性质。
已知。
实验1:将SO2气体通入水中,测得溶液pH=3。
实验2:将SO2气体通入0.1mol∙L-1NaOH溶液中,当溶液pH=3时停止通气。
实验3:将SO2气体通入0.1mol∙L-1酸性KMnO4溶液中,当溶液恰好褪色时停止通气。
下列说法不正确的是
A、实验1所得溶液中: B、实验2所得溶液中: C、实验2所得溶液经蒸干、灼烧会产生Na2SO4固体 D、实验3所得溶液中: -
5、下列实验操作和现象,能得出相应结论的是
实验操作和现象
结论
A
向一定浓度的溶液滴加盐酸,出现白色沉淀
非金属性:Cl>Si
B
用计测定盐酸和溶液的 , 的大
是弱酸
C
向溶液中滴加溶液3~4滴,充分反应后,再加KSCN,溶液变红
与的反应存在限度
D
反应平衡后,缩小容器的体积,气体的颜色变深
平衡向逆反应方向移动
A、A B、B C、C D、D -
6、下表是常温下几种弱酸的电离平衡常数。下列说法正确的是
CH3COOH
HClO
A、向溶液加入少量溶液: B、反应的平衡常数 C、向溶液通入少量气体: D、中,结合质子能力最强的是 -
7、室温下,下列各组离子在指定溶液中一定能大量共存的是A、的溶液中: B、水电离的的溶液中: C、的溶液中: D、的溶液中:
-
8、常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g的变化如右图所示。下列说法正确的是
 A、稀释相同倍数时:c(Aˉ)>c(Bˉ-) B、水的电离程度:b=c>a C、溶液中离子总物质的量:b>c>a D、溶液中离子总浓度:a>b>c
A、稀释相同倍数时:c(Aˉ)>c(Bˉ-) B、水的电离程度:b=c>a C、溶液中离子总物质的量:b>c>a D、溶液中离子总浓度:a>b>c -
9、实验室制取少量并研究其性质,下列实验装置和操作能达到实验目的的是


A.制取
B.除去杂质


C.测量氯水pH
D.吸收尾气的
A、A B、B C、C D、D -
10、平流层中氯氟烃的光解产物会对臭氧层产生破坏,反应过程如图。下列说法不正确的是
 A、 B、反应①是决速步 C、催化剂降低了反应活化能,改变了反应过程 D、总反应为催化剂和均为催化剂
A、 B、反应①是决速步 C、催化剂降低了反应活化能,改变了反应过程 D、总反应为催化剂和均为催化剂 -
11、下列说法正确的是A、在低温下能自发进行,该反应 B、增大压强、升高温度均可提高反应物中活化分子百分数 C、一定条件下,某可逆反应 , 则逆反应的活化能大于 D、工业合成氨选择温度 , 既利于平衡正向移动又利于提高化学反应速率
-
12、“碳达峰•碳中和”是我国社会发展重大战略之一,的减排、吸收、封存及转化,都是学术研究和工业应用中的重要课题。(1)、还原是实现“双碳”经济的有效途径之一,相关的主要反应有:
I:
Ⅱ:
还原能力可衡量转化效率,(同一时段内与的物质的量变化量之比)。常压下和按物质的量之比1:3投料,某一时段内和的转化率随温度变化如下图1,时的值为 , 请在下图2中画出间的变化趋势,并标明时值。
 (2)、与2-甲基咪唑(结构简式:
(2)、与2-甲基咪唑(结构简式: )的酸根离子(可形成一种金属有机骨架结构ZIF-8,ZIF-8具有空间笼状骨架(结构如下图3),其空隙可以吸附 , 并促进转化为高附加值化学品。①ZIF-8具有较高的热稳定性且能循环利用。然而,在潮湿的酸性环境中使用时,会有生成,以表示ZIF-8,该反应的化学方程式为。试从结构的角度分析,潮湿环境下ZIF-8重复捕获的能力将大大降低的原因是。
)的酸根离子(可形成一种金属有机骨架结构ZIF-8,ZIF-8具有空间笼状骨架(结构如下图3),其空隙可以吸附 , 并促进转化为高附加值化学品。①ZIF-8具有较高的热稳定性且能循环利用。然而,在潮湿的酸性环境中使用时,会有生成,以表示ZIF-8,该反应的化学方程式为。试从结构的角度分析,潮湿环境下ZIF-8重复捕获的能力将大大降低的原因是。
②ZIF-8催化转化为环状碳酸酯的可能机理如下:

在上述催化过程中,ZIF-8由提供空轨道作为活性位点,与反应物的孤电子对结合。从下列选项中选择合理的中间体完成反应:I、Ⅱ依次为。
 (3)、催化电解吸收的KOH溶液可将转化为CO或有机物。在相同条件下,恒定通过电解池的电量,还原产物的法拉第效率()随电解电压的变化如下图4所示。
(3)、催化电解吸收的KOH溶液可将转化为CO或有机物。在相同条件下,恒定通过电解池的电量,还原产物的法拉第效率()随电解电压的变化如下图4所示。
其中,表示电解生成还原产物所转移电子的物质的量,表示法拉第常数。
①阴极由生成CO的电极反应式为。
②在相同条件下,催化电解相同时间,阴极施加的电解电压过高或过低,生成CO的量都会减少,原因是。
③阴极施加的电解电压为1.0V,电解进行一段时间后共产生了0.46molCO,该过程同时产生的在标准状况下的体积为。
-
13、CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液形成 , 不溶于乙醇,在空气中易被氧化。某小组使用如下装置制备。
 (1)、图1中用来盛放溶液的仪器名称为。(2)、用固体配制溶液时,需称量的固体质量为g。(3)、上述制备反应进行一段时间后,溶液pH约为4,写出该过程发生的离子方程式。(4)、反应过程中,和NaCl的用量对CuCl产率的影响如下图3所示:
(1)、图1中用来盛放溶液的仪器名称为。(2)、用固体配制溶液时,需称量的固体质量为g。(3)、上述制备反应进行一段时间后,溶液pH约为4,写出该过程发生的离子方程式。(4)、反应过程中,和NaCl的用量对CuCl产率的影响如下图3所示:
当时,CuCl产率先升高后降低,其降低的原因是。
(5)、用“醇洗”可快速去除滤渣表面的水分,防止滤渣被空气氧化为被氧化为的化学方程式为。(6)、为获得较高产率的CuCl,请补充实验方案:向三颈烧瓶中加入溶液, , 得CuCl固体。(实验须使用的试剂或装置:溶液,溶液,溶液,蒸馏水,无水乙醇,真空干燥箱) -
14、伐尼克兰(F)是戒烟辅助药物,其合成路线如下:
 (1)、B中的官能团名称为。(2)、过程中以为催化剂。酸性强于 , 其原因是:;过程中,以浓硫酸为催化剂时可能发生副反应,请写出其中一种副产物的结构简式:。(3)、过程中经历 , 已知分子式为的反应类型为。(4)、请写出一种满足以下条件的链状化合物的结构简式:。
(1)、B中的官能团名称为。(2)、过程中以为催化剂。酸性强于 , 其原因是:;过程中,以浓硫酸为催化剂时可能发生副反应,请写出其中一种副产物的结构简式:。(3)、过程中经历 , 已知分子式为的反应类型为。(4)、请写出一种满足以下条件的链状化合物的结构简式:。i.与比A多一个碳原子的同系物是同分异构体;
ii.存在2种不同化学环境的氢原子;
iii.能够与盐酸发生反应生成盐。
(5)、已知:① 与
与 性质相似;②
性质相似;② 。写出以
。写出以 和
和 为原料制备
为原料制备 的合成路线流程图,无机试剂任选,两碳及以下有机试剂任选。
的合成路线流程图,无机试剂任选,两碳及以下有机试剂任选。 -
15、硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为MnS及少量FeS)为原料制备硫酸锰的工艺流程如下:

已知:
①“混合焙烧”后烧渣含及少量。
②酸浸时,浸出液的pH与锰的浸出率关系如下图1所示。
③金属离子在水溶液中的平衡浓度与pH的关系如下图2所示 , 此实验条件下开始沉淀的pH为7.54;当离子浓度时,可认为该离子沉淀完全。
 (1)、的价电子排布式为。(2)、传统工艺处理高硫锰矿时,若不经“混合焙烧”,而是直接用浸出,其缺点为。(3)、实际生产中,酸浸时控制硫酸的量不宜过多,使pH在2左右。请结合图1和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:。(4)、“中和除杂”时,应调节pH的范围为;其中除去的离子方程式为。(5)、“氟化除杂”时,若维持 , 溶液中的和(填“能”或“不能”)都沉淀完全[已知:;]。(6)、产品纯度测定:称取1.000g产品,在适宜条件下用适量将氧化为 , 再用溶液20.00mL刚好把转化为。通过计算可知,产品纯度为(写出计算过程)。
(1)、的价电子排布式为。(2)、传统工艺处理高硫锰矿时,若不经“混合焙烧”,而是直接用浸出,其缺点为。(3)、实际生产中,酸浸时控制硫酸的量不宜过多,使pH在2左右。请结合图1和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:。(4)、“中和除杂”时,应调节pH的范围为;其中除去的离子方程式为。(5)、“氟化除杂”时,若维持 , 溶液中的和(填“能”或“不能”)都沉淀完全[已知:;]。(6)、产品纯度测定:称取1.000g产品,在适宜条件下用适量将氧化为 , 再用溶液20.00mL刚好把转化为。通过计算可知,产品纯度为(写出计算过程)。 -
16、在与反应制甲醇的反应体系中,主要反应的热化学方程式为
反应I:
反应Ⅱ:
向恒压密闭容器中通入1molCO2和3molH2 , CO2的平衡转化率、CH3OH的平衡产率随温度的变化如下图所示。下列说法正确的是
 A、反应I的平衡常数 B、和充分反应,吸收热量40.9kJ C、平衡时的体积分数可能大于0.5 D、曲线a代表的是的平衡转化率
A、反应I的平衡常数 B、和充分反应,吸收热量40.9kJ C、平衡时的体积分数可能大于0.5 D、曲线a代表的是的平衡转化率 -
17、草酸亚铁是生产磷酸铁锂电池的原料,实验室可通过如下反应制取:

已知室温时:。
下列说法正确的是
A、室温下,向溶液中加酸调节时溶液中存在: B、“酸化溶解”后的溶液中存在: C、室温时,能与反应生成沉淀 D、室温时,“沉铁”后的上层清液中: -
18、下列由实验操作和现象推出的结论正确的是
实验操作和现象
结论
A
向含有ZnS和的白色悬浊液中滴加少量溶液,有黑色沉淀生成
B
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,冷却后向其中加入足量稀NaOH溶液,再加入新制的银氨溶液,并水浴加热,产生了银镜
蔗糖水解产物具有还原性
C
向浓中插入红热的炭,有红棕色气体生成
炭可与浓反应生成
D
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液,无血红色出现
食品脱氧剂样品中无+3价铁
A、A B、B C、C D、D -
19、回收利用工业废气中的和 , 实验原理示意图如下。
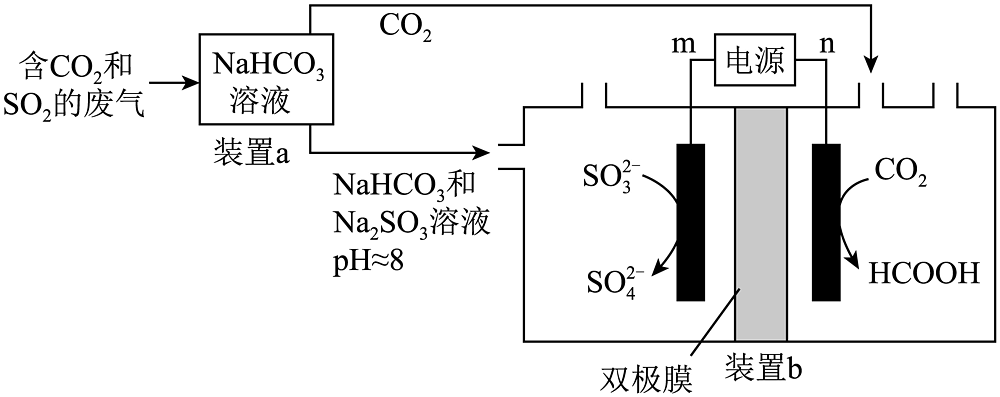
下列说法不正确的是
A、m极为电源正极 B、电解过程中,双极膜中产生的移向右侧,产生的移向左侧 C、装置a中溶液的作用是吸收废气中的和 D、装置b中,每当有标准状况下参与反应时,得电子数为2mol -
20、植物提取物阿魏萜宁具有抗菌活性,其结构简式如下图所示。下列关于阿魏萜宁的说法错误的是
 A、可与Na2CO3溶液反应 B、消去反应产物最多有2种 C、酸性条件下的水解产物均可生成高聚物 D、该有机物与足量H2反应所得产物有5个手性碳原子
A、可与Na2CO3溶液反应 B、消去反应产物最多有2种 C、酸性条件下的水解产物均可生成高聚物 D、该有机物与足量H2反应所得产物有5个手性碳原子