相关试卷
-
1、碳与水反应可获得 , 添加后,其主要反应如下;
(Ⅰ)
(Ⅱ)
(Ⅲ)
恒压条件下,体系达平衡后,气相中、和 物质的量分数随温度的变化关系如图所示[图示温度范围内已完全反应,在温度时完全分解]。下列说法不正确的是
 A、低温时可自发进行 B、图中曲线a对应物质为 C、当温度高于时,随温度升高,曲线c逐渐降低的原因是温度升高,反应Ⅱ逆向移动 D、保持压强不变、温度为 , 向平衡体系中通入少量 , 重新达平衡后,的物质的量分数变大
A、低温时可自发进行 B、图中曲线a对应物质为 C、当温度高于时,随温度升高,曲线c逐渐降低的原因是温度升高,反应Ⅱ逆向移动 D、保持压强不变、温度为 , 向平衡体系中通入少量 , 重新达平衡后,的物质的量分数变大 -
2、室温下,用溶液吸收的过程如图所示。

已知: , , 下列说法正确的是
A、溶液中: B、充分吸收烟气后的溶液中: C、完全转化为时: D、“氧化”时通入过量并灼烧制得石膏 -
3、室温下,根据下列实验事实或现象,所得实验结论正确的是
选项
事实或现象
实验结论
A
向溶液中通入气体,出现黑色沉淀
酸性强于
B
烯烃中溶入冠醚后,水溶液与烯烃反应的氧化速率明显加快
冠醚具有氧化作用
C
酸性:
烷基是推电子基团,烷基碳原子数越少,推电子效应越小
D
为基元反应,将盛有的密闭烧瓶浸入冷水,红棕色变浅
正反应活化能大于逆反应活化能
A、A B、B C、C D、D -
4、在给定条件下,下列制备过程涉及的物质转化均可实现的是A、Al2(SO4)3制备:溶液无水Al2(SO4)3固体 B、制镁工业:海水 C、纯碱工业:NaCl溶液 D、硝酸工业:
-
5、合成抗肿瘤药氟他胺的部分流程如下。已知吡啶的结构简式为(
 )。下列说法正确的是
)。下列说法正确的是 A、甲分子中所有原子共平面 B、乙在水中的溶解度小于甲 C、1 mol丙最多与4 mol H2发生加成反应 D、乙→丙过程中加入吡啶是为了结合反应中产生的HCl
A、甲分子中所有原子共平面 B、乙在水中的溶解度小于甲 C、1 mol丙最多与4 mol H2发生加成反应 D、乙→丙过程中加入吡啶是为了结合反应中产生的HCl -
6、一种可植入体内的微型电池工作原理如图所示,通过CuO催化血糖反应,从而控制血糖浓度。下列有关说法正确的是
 A、电池工作时,化学能全部转化为电能 B、电池工作时,电子由a电极沿导线流向b电极 C、a电极反应式为 D、反应中每生成1 molC6H12O7 , 转移电子数为
A、电池工作时,化学能全部转化为电能 B、电池工作时,电子由a电极沿导线流向b电极 C、a电极反应式为 D、反应中每生成1 molC6H12O7 , 转移电子数为 -
7、实验室进行炭与浓硫酸反应的实验。下列装置和操作能达到实验目的是
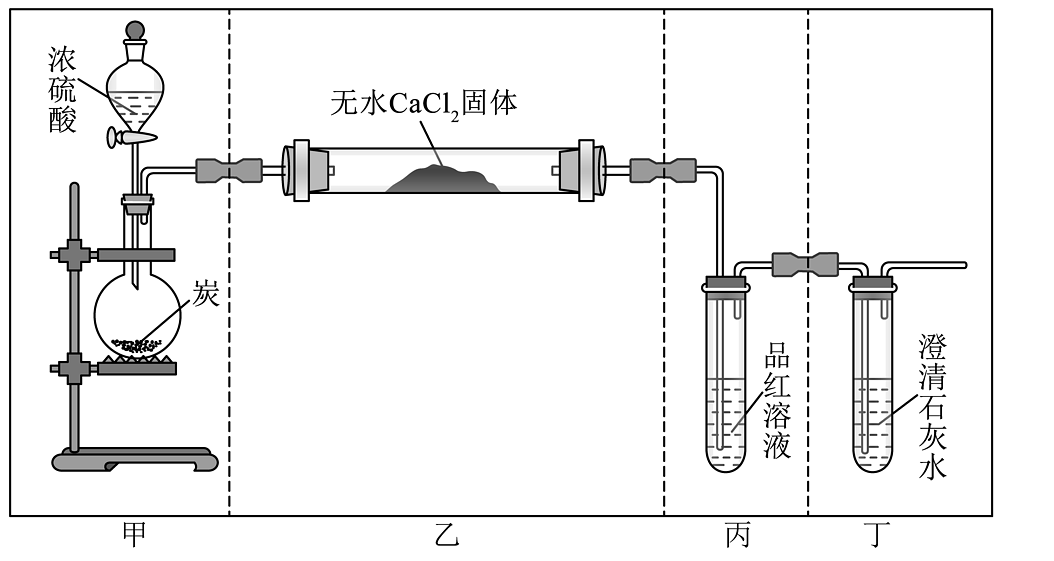 A、用装置甲进行炭与浓硫酸的反应 B、用装置乙检验 C、用装置丙检验 D、用装置丁检验
A、用装置甲进行炭与浓硫酸的反应 B、用装置乙检验 C、用装置丙检验 D、用装置丁检验 -
8、我国科研团队发现月壤中存在一种矿物。下列说法正确的是A、基态核外电子排布式: B、的空间构型:三角锥型 C、:仅含离子键 D、的电子式:

-
9、
钠的化合物在生产生活中应用广泛。
(一)工业上,用NaCl溶液制备KClO3 , 转化途径如下:
(1)完成①中反应的总化学方程式:________ NaCl + H2O NaClO3 + ______
(2)转化②的反应类型为________,该过程能析出KClO3晶体而无其它晶体析出的原因是________(二)叠氮化钠(NaN3)是汽车安全气囊中重要的重要成分。受撞击时,叠氮化钠分解产生钠和氮气,钠在高温隔绝空气的条件下与Fe2O3反应生成白色化合物甲和单质乙。请回答下列问题:
(3)若产生40.32L(标准状况下)氮气,至少需要叠氮化钠________g。(4)用双线桥法表示Na与Fe2O3反应的电子转移情况________。(5)若化合物甲在空气中转化为碳酸氢盐,则反应的化学方程式为________。(6)以下物质中,有可能作为安全气囊中Fe2O3替代品的是___________。A. KCl B. KNO3 C. Na2S D. CuO (7)设计一个实验方案,探究化合物甲与空气接触后生成可溶性盐的成分(不考虑结晶水合物)________。 -
10、“84”消毒液是常见的含氯消毒液,在日常疫情防控中发挥了重要作用。某化学小组利用如下装置进行制备。已知:3Cl2 + 6NaOH5NaCl + NaClO3 +3H2O
 (1)、试剂瓶a中装的试剂是。(2)、制备实验开始,以下操作依次是 (填序号)。
(1)、试剂瓶a中装的试剂是。(2)、制备实验开始,以下操作依次是 (填序号)。A.往烧瓶中加入MnO2粉末 B.加热
C.往烧瓶中加入浓盐酸 D.检查装置气密性
(3)、烧瓶中发生的离子方程式为(4)、小组同学查阅资料得知:氯气与NaOH溶液反应会放热,导致NaClO产率下降。请对该装置提出一个改进措施。(5)、“84”消毒液的使用要遵守使用说明,如果不小心将“84”消毒液滴在了有色衣物上,会出现褪色现象。请用化学知识解释(6)、“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO的有效氯含量为(保留2位小数)。 -
11、按要求填空(1)、请写出一种与O2互为同素异形体的物质的化学式。(2)、碳酸氢钠在水中的电离方程式。(3)、药物“胃舒平”中含有氢氧化铝,可用来治疗胃酸(主要成分是盐酸)过多,离子方程式为。(4)、某氯化物MCl227g,含有0.4mol Cl- , 则M的相对原子质量为。(5)、“活性氧”能加速人体老化,被称为“生命杀手”,服用亚硒酸钠可以消除人体中的活性氧。从氧化还原反应角度分析,亚硒酸钠的作用是。
-
12、氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中Cl2、HClO和ClO-三种微粒所占百分数与pH变化的关系如图所示。下列表述不正确的是
 A、向氯水中滴加少量石蕊试液,先变红,后红色消失 B、用强光照射氯水,溶液酸性增强,杀菌能力减弱 C、为了达到氯水最大的杀菌效果,溶液的pH最佳控制范围是3~5.5 D、氯处理饮用水时,在夏季的杀菌效果比在冬季好
A、向氯水中滴加少量石蕊试液,先变红,后红色消失 B、用强光照射氯水,溶液酸性增强,杀菌能力减弱 C、为了达到氯水最大的杀菌效果,溶液的pH最佳控制范围是3~5.5 D、氯处理饮用水时,在夏季的杀菌效果比在冬季好 -
13、某温度下,向图中所示a、b中分别通入等质量的CH4和O2(密封隔板Ⅰ、Ⅱ可自由滑动,且与容器内壁的摩擦忽略不计)。下列说法不正确的是
 A、a中通入的气体是O2 B、a和b中原子个数之比为2:5 C、a和b中气体密度之比是2:1 D、a和b的体积比为1:2
A、a中通入的气体是O2 B、a和b中原子个数之比为2:5 C、a和b中气体密度之比是2:1 D、a和b的体积比为1:2 -
14、下列说法正确的是A、将0.585 g氯化钠固体加入到100mL水中溶解,得到的氯化钠溶液浓度为0.1 mol/L B、向NaOH溶液中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体 C、氯化钠溶液在电流的作用下能电离产生Na+、Cl- D、CO的摩尔质量为60 g/mol
-
15、某无土栽培的植物培养液成分为:KCl : 0.3mol/L、K2SO4: 0.2mol/L、ZnSO4: 0.1mol/L,若以KCl、K2SO4、ZnCl2为原料配制1 L培养液,需要KCl的物质的量为A、0.1mol B、0.2 mol C、0.3mol D、0.4 mol
-
16、向一定体积的Ba(OH)2中逐滴滴入稀硫酸,导电能力随时间变化的曲线如图所示,下列说法不正确的是
 A、A点导电能力强,是因为:Ba(OH)2 = Ba2+ + 2OH- B、AB段发生的反应为:Ba2+ + 2OH-+ SO+ 2H+ = BaSO4 ↓+ 2H2O C、a时刻恰好完全反应,导电性约为零,说明BaSO4是非电解质 D、BC段导电性增强,是因为过量的硫酸电离出的离子导电
A、A点导电能力强,是因为:Ba(OH)2 = Ba2+ + 2OH- B、AB段发生的反应为:Ba2+ + 2OH-+ SO+ 2H+ = BaSO4 ↓+ 2H2O C、a时刻恰好完全反应,导电性约为零,说明BaSO4是非电解质 D、BC段导电性增强,是因为过量的硫酸电离出的离子导电 -
17、下列离子方程式正确的是A、澄清石灰水中通入过量的二氧化碳CO2+OH- = HCO B、金属钠和水:Na +2H2O = Na+ + 2OH- + H2↑ C、碳酸钡和稀硝酸:CO+2H+=CO2↑+H2O D、将稀硫酸滴加到铜片上:Cu + 2H+ = Cu2+ + H2↑
-
18、NA为阿伏加德罗常数的值,下列说法正确的是A、Fe在1mol Cl2中完全反应,转移电子数3NA B、常温常压下,22 g CO2 含有分子数为0.5NA C、标况下,11.2 L H2O含有氢原子数为NA D、1 L 0.1 mol·L-1Na2SO4溶液中含有的氧原子数为0.4 NA
-
19、下列离子在指定条件下能共存的是A、澄清透明的溶液中:Mg2+、Cu2+、SO、NO B、含有NH的溶液:K+、CO、OH-、Ba2+ C、石蕊变红的溶液:Cl-、Na+、ClO-、Mg2+ D、常温下pH=13的溶液:K+、HCO、CH3COO-、Ca2+
-
20、已知离子方程式:As2S3+H2O+NO→AsO+SO+NO↑+___________(未配平),下列说法错误的是A、配平后H2O的化学计量数为4 B、反应后溶液呈酸性 C、配平后氧化剂与还原剂的化学计量数之比为3∶28 D、氧化产物为AsO和SO