相关试卷
-
1、下列通过制取硫酸铝、氢氧化铝,获得氧化铝的装置和原理能达到实验目的的是
A
B
C
D



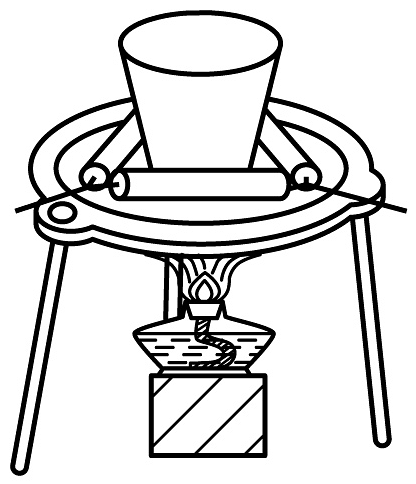
制硫酸铝
制氢氧化铝
过滤氢氧化铝
灼烧制氧化铝
A、A B、B C、C D、D -
2、乙硫醇()的综合利用及治理是当前环境领域关注的焦点之一。(1)、家用煤气中可掺入微量具有难闻气味的乙硫醇。
已知: kJ·mol
kJ·mol
kJ·mol
的。
(2)、是一种高效多功能的新型绿色水处理剂,可用于除去废水中的。已知水溶液中的物种分布分数如图所示。
①已知 , 比较和酸性强弱并从结构的角度说明理由:。
②写出工业废水时,氧化生成和的离子方程式:。
③一种采用电化学方法制取的装置原理如图所示。阳极使用的是易被氧化的活性铁电极。电解池阳极室中KOH溶液的浓度为14 mol·L、电解60 min,调节不同的电压,测得反应后溶液中的浓度与电流密度(其他条件一定,电压与电流密度大小成正比)的关系如图所示。
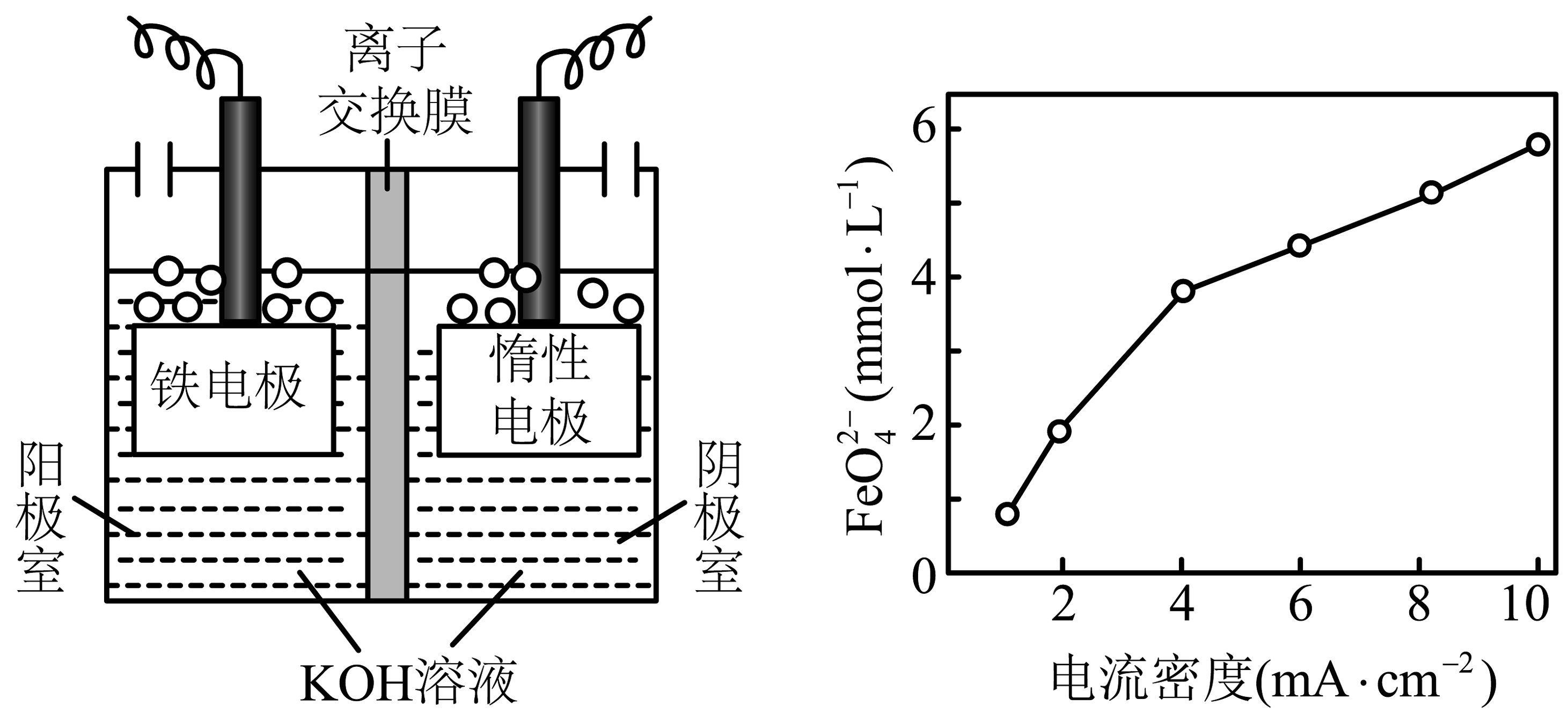
I 写出制取的电极反应式:。
II 电流密度大于4 mA·cm时,所得反应后溶液中的浓度上升幅度变小的原因是。
-
3、
草酸亚铁晶体( FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。
 (1)装置D的名称为 , 作用是。(2)按照气流从左到右的方向,上述装置的连接顺序为a→→d→e→b→c→尾气处理装置(填仪器接口的小字母编号)。(3)能证明分解产物中存在CO的现象是。
(1)装置D的名称为 , 作用是。(2)按照气流从左到右的方向,上述装置的连接顺序为a→→d→e→b→c→尾气处理装置(填仪器接口的小字母编号)。(3)能证明分解产物中存在CO的现象是。II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:
 (4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为。
(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为。Ⅲ.文献表明:相同条件下,草酸根(C2O)的还原性强于Fe2+。为检验这一结论进行以下实验。
资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3−Fe3++ 3C2O K=6.3×10−21
通过Fe3+和C2O在溶液中的反应比较Fe2+和C2O的还原性强弱
操作
现象
在避光处,向10mL0.5mol∙L-1FeCl3溶液中缓慢加入0.5mol∙L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤
得到翠绿色溶液和翠绿色晶体
(5)取实验中的少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红。加硫酸后溶液变红的原因是。(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是。 -
4、一种化合物的合成路线如图:
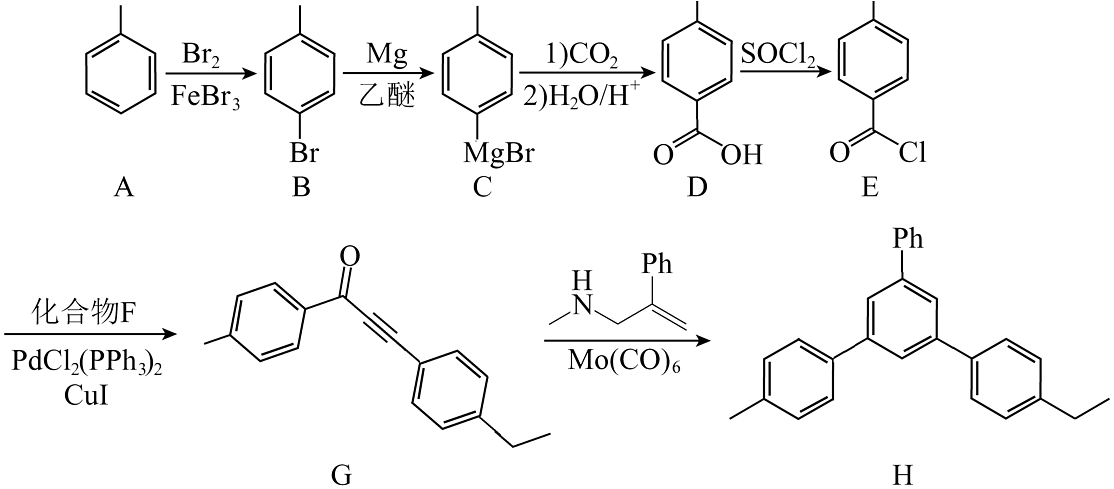
(代表苯基)。
(1)、化合物中含有的官能团名称是。(2)、有机物F的分子式为 , 则其结构简式为。(3)、D和乙二醇以物质的量比为完全酯化的产物有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:。①分子中含有3种不同化学环境的氢原子;
②能发生银镜反应;
③能发生水解反应,且该分子水解时消耗。
(4)、的过程中,第一步反应C与反应生成物的结构简式为。(5)、写出以苯乙烯、苯甲酸、 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。 -
5、根据实验操作和现象,下列得出的结论正确的是
选项
实验操作和现象
实验结论
A
某待测溶液中先加入Ba(NO3)2溶液,产生白色沉淀,再加足量的盐酸,仍有白色沉淀
该待测溶液含有
B
向FeCl3溶液中滴加KI-淀粉溶液,溶液变蓝
氧化性:Fe3+>I2
C
将体积大小相同的镁片和铝片用导线连接好,同时插入盛有浓NaOH溶液的烧杯中。镁片表面有大量气泡,铝片逐渐溶解
金属性Al比Mg强
D
将乙醇和浓硫酸的混合液加热,将生成的气体通入溴水中,溴水褪色
乙醇只发生了消去反应
A、A B、B C、C D、D -
6、利用硝酸工业的尾气(含、)获得的部分工艺流程如图:
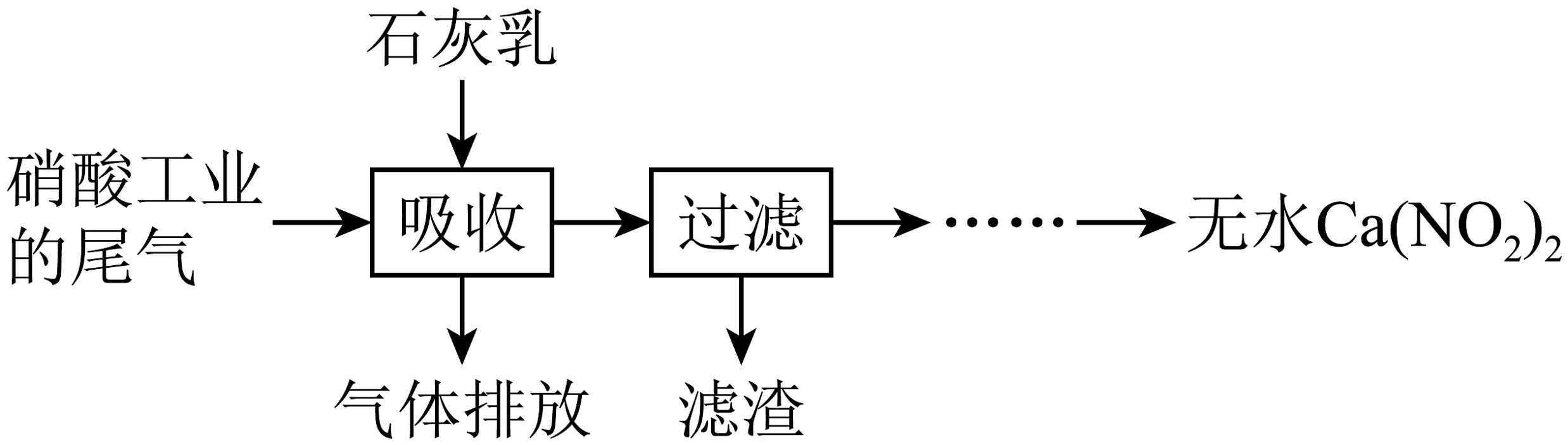
下列说法不正确的是
A、反应的 B、若尾气中产品中含量升高 C、为使尾气中被充分吸收,尾气与石灰乳采用气液逆流接触吸收 D、在酸性溶液中分解的离子方程式为 -
7、下列化学反应表示正确的是A、少量通入溶液中: B、向饱和食盐水中通入氨气和过量二氧化碳: C、用惰性电极电解饱和溶液: D、稀硫酸与稀氢氧化钾溶液发生反应:
-
8、氯气可用来制备将氢氧化铁氧化为高铁酸根离子的氧化剂,下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
 A、用装置甲制取Cl2 B、用装置乙除去Cl2中少量HCl C、用装置丙分离MnO2和MnCl2溶液 D、用装置丁蒸干MnCl2溶液制MnCl2·4H2O
A、用装置甲制取Cl2 B、用装置乙除去Cl2中少量HCl C、用装置丙分离MnO2和MnCl2溶液 D、用装置丁蒸干MnCl2溶液制MnCl2·4H2O -
9、下列比较关系正确的是A、第一电离能:N>O B、还原性:HBr>HI C、碱性:Al(OH)3>Mg(OH)2 D、离子半径:Na+>F-
-
10、工业上由、和可制备。下列说法中正确的是A、的电子式为 B、的空间结构为直线形 C、中元素的化合价为+4价 D、中含有非极性共价键
-
11、我国科学家已经实现了从CO2到淀粉]n的全合成,下列有关说法正确的是A、CO2为碱性氧化物 B、淀粉结构中含有 C、全合成属于化学变化 D、全合成过程中CO2作还原剂
-
12、高血脂能引起动脉粥样硬化、冠心病、胰腺炎等疾病,已成为现代人健康的杀手之一,如图是一种治疗高血脂的新药J的合成路线:

已知:①
 ;②
;② 。
。回答下列问题:
(1)、A是一种芳香烃,其名称为 , B→C的反应条件为 , C→D的反应类型为。(2)、写出C与E反应的化学方程式。(3)、已知有机物H分子式为C10H20O3 , 写出其结构简式。(4)、有机物D分子中最多有个原子共平面。(5)、化合物W的相对分子质量比E大14,W的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①属于芳香族化合物;②遇FeCl3溶液显紫色;③能发生银镜反应;④核磁共振氢谱有5组吸收峰,且峰面积比为2:2:2:1:1。
-
13、
Ⅰ.有机化合物A是一种重要的化工中间体,A~F在一定条件下的转化关系如图所示。

回答下列问题:
(1)A→B反应的试剂及条件为。
(2)C中官能团的名称为。
(3)A→D的过程中,可生成一种高分子副产物,该副产物的结构简式为。
(4)写出E在碱性条件下与新制氢氧化铜反应的化学方程式:。
(5)通常条件下,向F中加入酸性高锰酸钾溶液可转化为A,你认为这种方法是否正确(填“是”或“否”),请说明理由。
Ⅱ.聚碳酸酯(PC)是一种具有良好抗冲击性能和光学性能的工程塑料。以异山梨醇和碳酸二甲酯为原料可以制得聚碳酸酯。
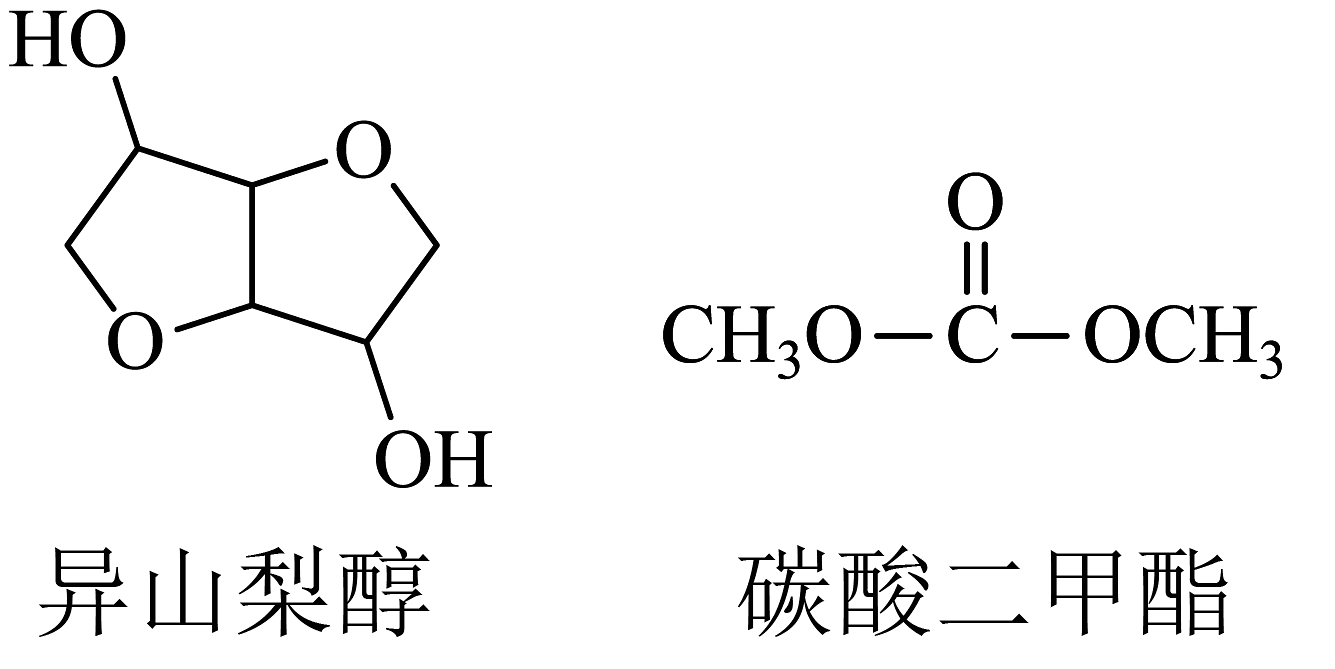
(6)在催化剂表面上,一种合成碳酸二甲酯的反应机理如图,请写出合成碳酸二甲酯的总反应方程式。
(7)异山梨醇和碳酸二甲酯合成聚碳酸酯的路线如下:
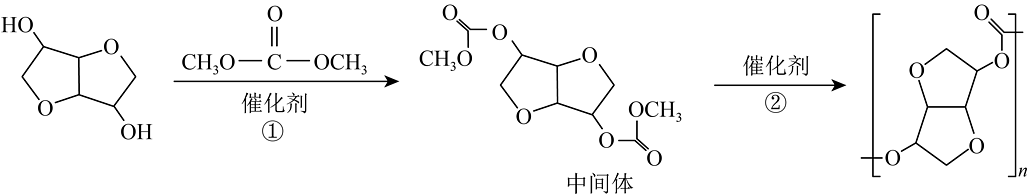 , 反应①中若1mol异山梨醇充分反应,得到的产物除1mol中间体外还有 , ②的反应类型为反应。
, 反应①中若1mol异山梨醇充分反应,得到的产物除1mol中间体外还有 , ②的反应类型为反应。 -
14、从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
 。 (1)、甲的分子式为 , 乙中含氧官能团的名称为。(2)、由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
。 (1)、甲的分子式为 , 乙中含氧官能团的名称为。(2)、由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
其中反应①的反应类型为 , 设计步骤①的目的是 , 反应②的化学方程式为。
-
15、回答下列问题:(1)、某烃A的蒸气密度是同条件下氢气密度的64倍,则A的分子式可能为 , 若A中含有6个甲基,且不可能是烯烃与氢气的加成产物,则A的名称是。(2)、已知1mol烃B中含42mol电子,且C、H两种元素的质量比为5∶1,则其分子式为 , 该烃分子中的一个氢原子被溴原子取代后,一共可形成种结构。(3)、0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol,若烃A与HBr加成后只得到一种产物,则A的结构简式为(任写一种)。(4)、工程塑料ABS树脂(结构简式如下),合成时用了三种单体(已知单体A中含有氰基,单体S中含有苯环)。写出三种单体的结构简式:A;B;S。其中B与足量溴的四氯化碳溶液反应后生成产物的结构简式为:。
 (5)、与
(5)、与 互为同分异构体,且一氯代物只有两种的芳香烃的结构简式为。 (6)、向苯酚钠溶液中通入少量的CO2 , 溶液将变浑浊,请写出反应的化学方程式。
互为同分异构体,且一氯代物只有两种的芳香烃的结构简式为。 (6)、向苯酚钠溶液中通入少量的CO2 , 溶液将变浑浊,请写出反应的化学方程式。 -
16、下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
现象
结论
A
向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡再加入0.5mL有机物Y,加热
未出现砖红色沉淀
Y中不含醛基
B
向碳酸钠中加入醋酸溶液,将产生的气体通入苯酚钠溶液中
溶液变浑浊
碳酸的酸性强于苯酚
C
卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液
产生白色沉淀
卤代烃Y中含有氯原子
D
向电石中滴加饱和食盐水,产生的气体通入酸性高锰酸钾溶液
酸性高锰酸钾溶液褪色
产生的气体中含有乙炔
A、A B、B C、C D、D -
17、离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。1—乙基—3—甲基咪唑四氟硼酸盐离子液体结构如图所示,下列相关叙述错误的是
 A、该离子液体中C杂化方式为sp2和sp3 B、阴离子呈正四面体形,存在共价键和配位键 C、阳离子中σ键数目是π键数目的10倍 D、该离子液体与水能够形成氢键
A、该离子液体中C杂化方式为sp2和sp3 B、阴离子呈正四面体形,存在共价键和配位键 C、阳离子中σ键数目是π键数目的10倍 D、该离子液体与水能够形成氢键 -
18、蓝印花布是以蓝草中提取的靛蓝为染料。靛蓝是一种古老的蓝色染料,染色过程中涉及反应:

下列有关有机物的性质说法正确的是
A、靛白和靛蓝分子中苯环上的一氯代物均为4种 B、靛蓝既能与盐酸反应,又能与氢氧化钠溶液反应 C、1mol靛蓝最多可以与发生加成反应 D、靛白能发生加成、取代、消去、氧化反应 -
19、下列关于有机物结构对性质影响的说法不合理的是A、乙醇分子中乙基是推电子基团,氧氢键极性比水中的弱,钠与乙醇反应比与水反应慢 B、醛基中氧的电负性大,碳氧双键中电子偏向氧原子,与HCN加成时H连在氧原子上 C、卤代烃分子中卤原子电负性大于碳原子,碳卤键极性强,易断裂,易发生取代反应 D、受推电子基团的影响,乙酸的酸性强于甲酸
-
20、用括号内的试剂和方法除去下列各种物质的少量杂质,不正确的是A、苯中含有甲苯(酸性高锰酸钾溶液、NaOH溶液,分液) B、乙酸乙酯中含有乙酸(饱和碳酸钠溶液,分液) C、苯中含有苯酚(浓溴水,过滤) D、溴乙烷中含有乙醇(水,分液)