相关试卷
-
1、实验室制取并收集氨气。下列装置能达到实验目的的是


A.制取
B.干燥


C.收集
D.吸收
A、A B、B C、C D、D -
2、人的生存离不开电解质。下列物质不属于电解质的是A、NaCl B、 C、 D、葡萄糖
-
3、磷酸铁是常用于生产电池的正极材料。属于A、酸 B、碱 C、盐 D、氧化物
-
4、俗名往往反映了物质的组成、性质和用途。下列对物质俗名的理解不正确的是A、双氧水:分子中含有2个氧原子 B、干冰:形态像冰,融化或气化后没有水生成 C、熟石灰:将生石灰加热后所得产物 D、天然气:自然存在的可燃性气体
-
5、自然界中存在多种元素的循环。下图表示的是自然界中的
 A、碳循环 B、氮循环 C、氧循环 D、硫循环
A、碳循环 B、氮循环 C、氧循环 D、硫循环 -
6、青蒿素是抗疟疾有效成分,曾经挽救成千上万人生命。因青蒿素的研究获得诺贝尔生理学(医学)奖的中国科学家是A、钱学森 B、侯德榜 C、屠呦呦 D、袁隆平
-
7、
侯氏制碱法是我国化学家侯德榜为世界制碱工业做出的突出贡献。
Ⅰ.某实验小组模拟制纯碱的工业流程及部分实验装置如图所示。已知氨气极易溶于水,在常温常压下,1体积水约可溶解700体积的氨。

(1)制备时,应先从口(填“a”或“b”)通入(填“”或“”)。
(2)写出由饱和食盐水制备小苏打的化学方程式。
Ⅱ. 加热法测定(假设只含杂质)纯度。
取样品按下图装置进行实验。

(3)C中碱石灰的作用是 , 若无C装置测得结果将(填“偏大”“偏小”“无影响”)。
(4)经测定B中增重 , 则的纯度为(写出计算过程,结果用百分数表示)。
-
8、
Ⅰ.有一种“地康法”制取氯气的反应原理如图所示:

(1)“地康法”制取氯气总反应的化学方程式为。
(2)若上述反应Ⅱ中,标况下,3.36L O2参与反应,则转移电子数约为。
Ⅱ. ClO2在常温下为黄色气体,熔点为−59.5℃,沸点为11℃,易溶于水,其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应:4ClO2 + 4OH− = 3+ ClO− + 2H2O。ClO2的制备方法有多种。请回答下列问题:
(3)实验室可用图示中装置制备、收集ClO2 (夹持装置略)。

①装置A中发生反应的化学方程式为。
②为了使装置B能收集到更多的ClO2 , 可采取的措施为(填一条)。
(4)ClO2的稳定性较差,易分解,常用H2O2溶液和NaOH溶液将其转化为NaClO2进行保存。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目。若加入过量NaOH溶液,可能导致的后果是。
-
9、
新型冠状病毒肺炎疫情在全球爆发,研究表明“84”消毒液可以有效地消灭病毒。
Ⅰ.“84”消毒液的配制
已知某“84”消毒液部分标签如下所示,回答下列问题:
净含量: 密度:
主要成分:20%(质量分数)
摩尔质量:
注意事项:密封保存,易吸收空气中的变质
(1)某同学参阅该“84”消毒液的配方,欲用固体配制的消毒液,需要用托盘天平称量固体的质量g。
(2)写出NaClO在水溶液中的电离方程式:。
(3)在配制该“84”消毒液的过程中,除烧杯、胶头滴管等仪器外,还必需的玻璃仪器有玻璃棒、。
(4)下列操作可能使配制的溶液浓度偏低的是 (填字母)。
A.移液时,未洗涤烧杯内壁和玻璃棒 B.溶解后未经冷却就移液
C.移液时,有少量液体溅出 D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
Ⅱ.“84”消毒液性能探究
同学们探究84消毒液在不同pH下使红纸褪色的情况,做了如下实验。
步骤1:将5mL市售84消毒液稀释100倍,测得稀释后溶液的;
步骤2:将稀释后溶液各20mL分别加入a、b、c三个洁净的烧杯中;
步骤3:用溶液将a、b、c三个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下。
烧杯
溶液的pH
现 象
a
10
10min后,红纸基本不褪色;4h后红纸褪色
b
7
10min后,红纸颜色变浅;4h后红纸褪色
c
4
10min后,红纸颜色比b烧杯中10min后的浅;4h后红纸褪色
已知溶液中、HClO、和的物质的量分数(α)随溶液pH变化的关系如图所示:

(5)由实验现象可获得结论:溶液的pH在4~10范围内,pH越大,红纸褪色(填“越快”或“越慢”)。
(6)结合图象进行分析,b、c两烧杯中实验现象出现差异的原因是。
(7)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用的浓硫酸配制物质的量浓度为的稀硫酸用于增强“84消毒液”的消毒能力,需要用量筒取mL上述浓硫酸进行配制。
-
10、回答下列问题。(1)、现有:①固体KOH ②稀硫酸 ③氨气 ④熔融NaCl ⑤蔗糖 ⑥铜;其中能导电的是(填序号,下同);属于电解质的是。(2)、标准状况下,质量为66 g的CO2的分子数约为个。(3)、19g某二价金属的氯化物ACl2中含有离子,ACl2的摩尔质量是。(4)、标准状况下,17g与标准状况下L含有相同数目的氢原子。(5)、若阿伏加德罗常数数值用NA表示,单位mol-1 , 则1个12C的质量为g。
-
11、如图所示是模拟制备氯水并检验Cl2性质的装置(夹持装置略去,挥发的HCl较少)。下列说法正确的是
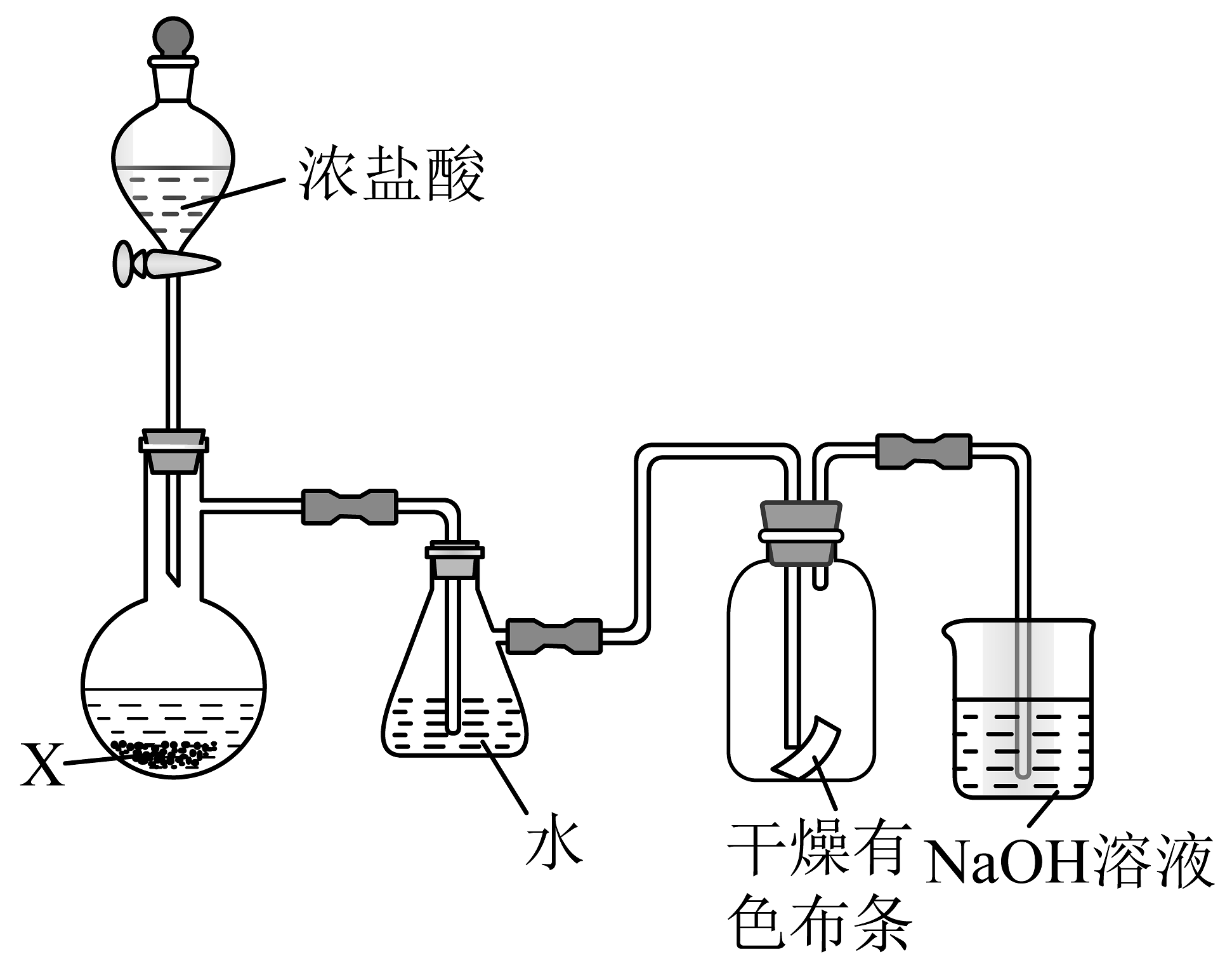 A、烧瓶中固体试剂X应是MnO2 B、水浴加热抽滤瓶能加快Cl2与水反应速率,增大氯水中HClO的浓度 C、干燥有色布条褪色,说明Cl2分子有漂白性 D、装有NaOH溶液的烧杯可吸收尾气,防止污染
A、烧瓶中固体试剂X应是MnO2 B、水浴加热抽滤瓶能加快Cl2与水反应速率,增大氯水中HClO的浓度 C、干燥有色布条褪色,说明Cl2分子有漂白性 D、装有NaOH溶液的烧杯可吸收尾气,防止污染 -
12、下列装置、操作和实验目的不正确的是
 A、图1装置可检验纯碱中是否含有钾元素 B、观察图2中澄清石灰水是否变浑浊可鉴别碳酸钠和碳酸氢钠 C、图3滴水生火可证明过氧化钠与水反应放热 D、图4装置若蘸有溴化钠溶液的棉球变成橙色,蘸有淀粉KI溶液的棉球变成蓝色,可验证氧化性:
A、图1装置可检验纯碱中是否含有钾元素 B、观察图2中澄清石灰水是否变浑浊可鉴别碳酸钠和碳酸氢钠 C、图3滴水生火可证明过氧化钠与水反应放热 D、图4装置若蘸有溴化钠溶液的棉球变成橙色,蘸有淀粉KI溶液的棉球变成蓝色,可验证氧化性: -
13、为除去括号内的杂质,所选用的试剂或方法不正确的是A、Na2CO3固体(NaHCO3),加热至不再产生气体 B、CO2气体(HCl),通入饱和NaHCO3溶液洗气 C、Na2O2粉末(Na2O),将混合物在氧气中加热 D、NaOH溶液(Na2CO3),滴加适量CaCl2溶液并过滤
-
14、下列有关反应的离子方程式正确的是A、碳酸钙和盐酸反应:+2H+=CO2↑+ H2O B、Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ C、氯气溶于水:Cl2+H2OH++Cl-+HClO D、氢氧化钡溶液与稀硫酸反应:
-
15、在给定条件下,下列选项所示的物质间转化均能实现的是A、 B、 C、 D、
-
16、下列关于物质性质的描述,不正确的是A、氢气在氯气中燃烧产生苍白色火焰,在瓶口出现白雾 B、氯气具有强氧化性,能将大多数金属氧化,生成金属氯化物 C、钠块投入水中,迅速熔成银白色小球 D、钠燃烧时发出黄色的火焰,生成氧化钠
-
17、下列变化需要加入氧化剂才能实现的是A、S2-→HS- B、Na2SO3→SO2 C、SO2→S D、H2S→S
-
18、下列溶液中,Cl-物质的量浓度最大的是A、200mL 0.5 mol·L-1NaCl 溶液 B、100mL 0.8mol·L-1 NaClO 溶液 C、800mL 0.3mol·L-1NaCl 溶液 D、1000mL 0.6 mol·L-1NaClO3 溶液
-
19、下列透明溶液中能大量共存的离子组是A、K+、Cu2+、、 B、H+、Na+、OH-、 C、K+、Na+、、OH- D、Na+、Ba2+、OH-、
-
20、下列有关钠及其化合物的性质与用途具有对应关系的是A、钠单质熔点较低,可用于冶炼金属钛 B、次氯酸钠具有强氧化性,可用作杀菌消毒 C、过氧化钠呈淡黄色,可用作呼吸面具供氧剂 D、碳酸氢钠受热易分解,可用于治疗胃酸过多