相关试卷
-
1、MnO2在电池、玻璃、有机合成等工业生产中应用广泛。利用粗MnO2(含有杂质MnO和MnCO3)制取纯MnO2的流程如图:

下列说法错误的是
A、酸浸过程中可以用浓盐酸代替稀硫酸 B、操作X的名称是过滤 C、氧化过程发生反应的离子方程式为:5Mn2++2ClO+4H2O=5MnO2↓+Cl2↑+8H+ D、Cl2与NaOH溶液加热反应得到的NaClO3可以循环使用 -
2、某兴趣小组为制备氯气并验证其性质,做了如下实验,实验装置如图所示(部分固定装置未画出)。下列说法不正确的是
 A、将装置A中换成 , 也能达到实验目的 B、装置B有除去及作安全瓶的作用 C、装置C中可以看到有色布条Ⅰ褪色,布条Ⅱ不褪色 D、F中发生的离子方程式为:Cl2+OH- =Cl- +ClO- +H2O
A、将装置A中换成 , 也能达到实验目的 B、装置B有除去及作安全瓶的作用 C、装置C中可以看到有色布条Ⅰ褪色,布条Ⅱ不褪色 D、F中发生的离子方程式为:Cl2+OH- =Cl- +ClO- +H2O -
3、下列操作、现象和结论均正确的是
选项
操作
现象
结论
A
向碳酸钠粉末滴几滴水,再插入温度计
碳酸钠结块变成晶体,温度升高
碳酸钠与水反应生成 , 同时放热
B
将通入淀粉-KI溶液
淀粉-KI溶液变蓝色
氧化性:
C
向待测液中加入盐酸酸化的溶液
有白色沉淀生成
待测液中含有Cl-
D
在空气中点燃氢气,将导管伸入盛有氯气的集气瓶
集气瓶中产生白烟
生成HCl
A、A B、B C、C D、D -
4、向Ba(OH)2溶液中滴入NaHSO4溶液,其导电能力随滴入溶液体积的变化关系如图所示,下列分析不正确的是
 A、NaHSO4是离子化合物 B、a至b对应反应的离子方程式为Ba2+ +H+ +OH-+SO= BaSO4↓+H2O C、b点溶液呈中性 D、c点溶液中存在大量的Na+、H+、SO
A、NaHSO4是离子化合物 B、a至b对应反应的离子方程式为Ba2+ +H+ +OH-+SO= BaSO4↓+H2O C、b点溶液呈中性 D、c点溶液中存在大量的Na+、H+、SO -
5、实验室用石灰石与稀盐酸制备的实验中,下列装置图能达到对应实验目的的是


A.制备
B.除去中混有的HCl气体


C.干燥
D.排空气法收集
A、A B、B C、C D、D -
6、下列离子方程式不正确的是A、氯化铁溶液与铁反应: B、用醋酸和淀粉KI溶液检验加碘盐中的+5I-+6H+=3I2+3H2O C、往FeBr2溶液中通入少量的氯气:2Fe2+ + Cl2 =2Fe3+ + 2Cl- D、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
-
7、下列各组离子在给定条件下一定能大量共存的是A、无色溶液:、、、 B、遇石蕊变蓝的溶液:、、 C、强碱性溶液:、、、 D、无色溶液:、、、
-
8、下图为四大基本反应类型与氧化还原反应的关系,下列反应属于标色区域“X”的是
 A、2KMnO4K2MnO4 + MnO2 + O2↑ B、NH4ClNH3 + HCl C、Cl2 + H2OHCl + HClO D、CuSO4 + Fe=Cu + FeSO4
A、2KMnO4K2MnO4 + MnO2 + O2↑ B、NH4ClNH3 + HCl C、Cl2 + H2OHCl + HClO D、CuSO4 + Fe=Cu + FeSO4 -
9、模型认知是简洁揭示化学本质的一种方法。如图为氯化钠固体溶于水的微观模型,下列说法正确的是
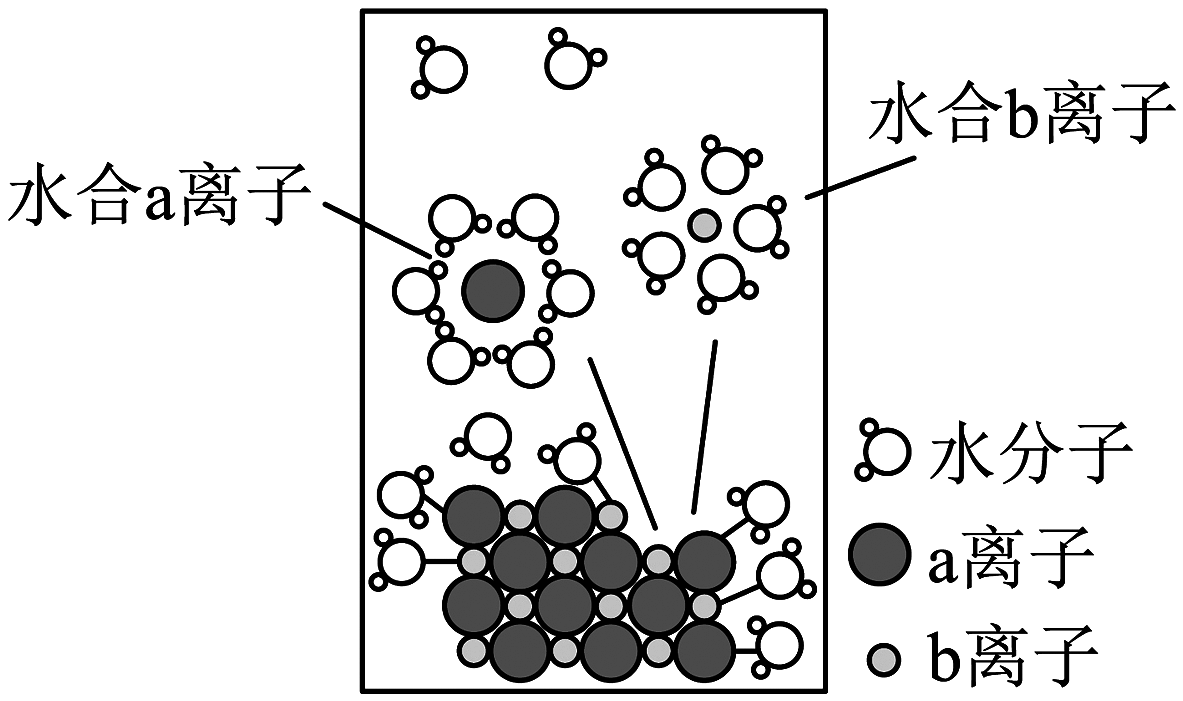 A、固体中存在自由移动的和 B、a离子为 C、该电离过程可以表示为 D、水合钠离子中中的O最靠近
A、固体中存在自由移动的和 B、a离子为 C、该电离过程可以表示为 D、水合钠离子中中的O最靠近 -
10、下列关于化合物、单质、混合物、电解质和非电解质的正确组合是
选项
化合物
单质
混合物
电解质
非电解质
A
烧碱
液态氧
冰水混合物
醋酸
二氧化硫
B
生石灰
白磷
胆矾
氧化铝
氯气
C
干冰
铁
氨水
碳酸钙
酒精
D
空气
氮气
小苏打
氯化铜
硫酸钡
A、A B、B C、C D、D -
11、消毒剂能有效灭杀流感病毒,保护人类健康。下列消毒剂的有效成分属于盐的是A、碘酊(碘的乙醇溶液) B、2.7%的双氧水 C、0.2%的高锰酸钾溶液 D、次氯酸消毒液
-
12、下列属于氧化还原反应的是A、CaO+CO2=CaCO3 B、MnO2+4HClMnCl2+Cl2↑+2H2O C、Cu(OH)2+2HCl=CuCl2+2H2O D、2Fe(OH)3Fe2O3+3H2O
-
13、多非利特(化合物VI)是新型抗心律失常药物,一种合成路线如下:
 (1)、I的分子式为 , 名称为。(2)、II中官能团名称是。(3)、根据III的结构特征,分析预测其可能的化学性质,完成下表。
(1)、I的分子式为 , 名称为。(2)、II中官能团名称是。(3)、根据III的结构特征,分析预测其可能的化学性质,完成下表。反应试剂、条件
反应形成的新结构
反应类型
-CH=CH2
(4)、IV的某同分异构体含有苯环和硝基,核磁共振氢谱有3组峰;且面积比为3:3:1,其同分异构体有 、、(写结构简式)。 (5)、反应④的另一产物为。(6)、关于上述合成路线的相关物质及转化,下列说法正确的有___________。A、IV中N原子的杂化方式相同 B、反应③有σ键的断裂与π键的形成 C、I可形成分子间氢键,沸点比II高 D、HBr中存在由s轨道和p轨道“头碰头”形成的σ键(7)、以
、、(写结构简式)。 (5)、反应④的另一产物为。(6)、关于上述合成路线的相关物质及转化,下列说法正确的有___________。A、IV中N原子的杂化方式相同 B、反应③有σ键的断裂与π键的形成 C、I可形成分子间氢键,沸点比II高 D、HBr中存在由s轨道和p轨道“头碰头”形成的σ键(7)、以 、
、 、
、 为有机原料,合成
为有机原料,合成 。基于你设计的合成路线,回答下列问题:
。基于你设计的合成路线,回答下列问题:a)最后一步反应中,有机反应物为(写结构简式)。
b)原子利用率为100%的化学反应方程式为(注明反应条件)。
-
14、乙酸乙酯是应用最广泛的脂肪酸酯之一。(1)、乙酸乙酯水解可用于制备化工原料。
①基态O原子价层电子排布式为。
②常温下,某CH3COONa溶液pH=9,则c(CH3COOH)+c(H+)=mol·L-1。
③18O标记的乙酸乙酯在NaOH溶液中发生水解的部分历程如下:
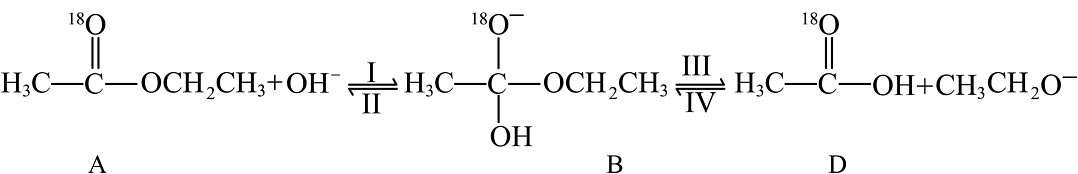
已知
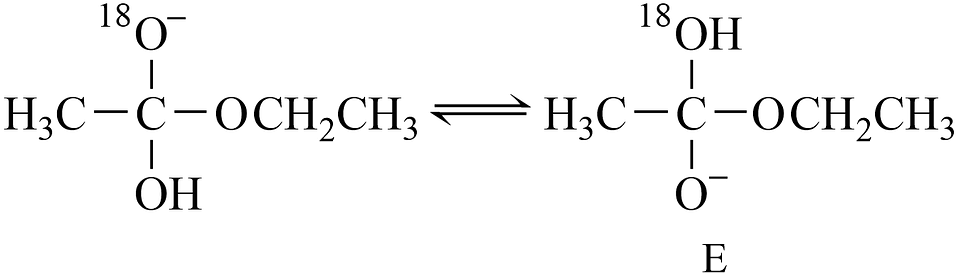 可快速平衡。
可快速平衡。能量变化如图:
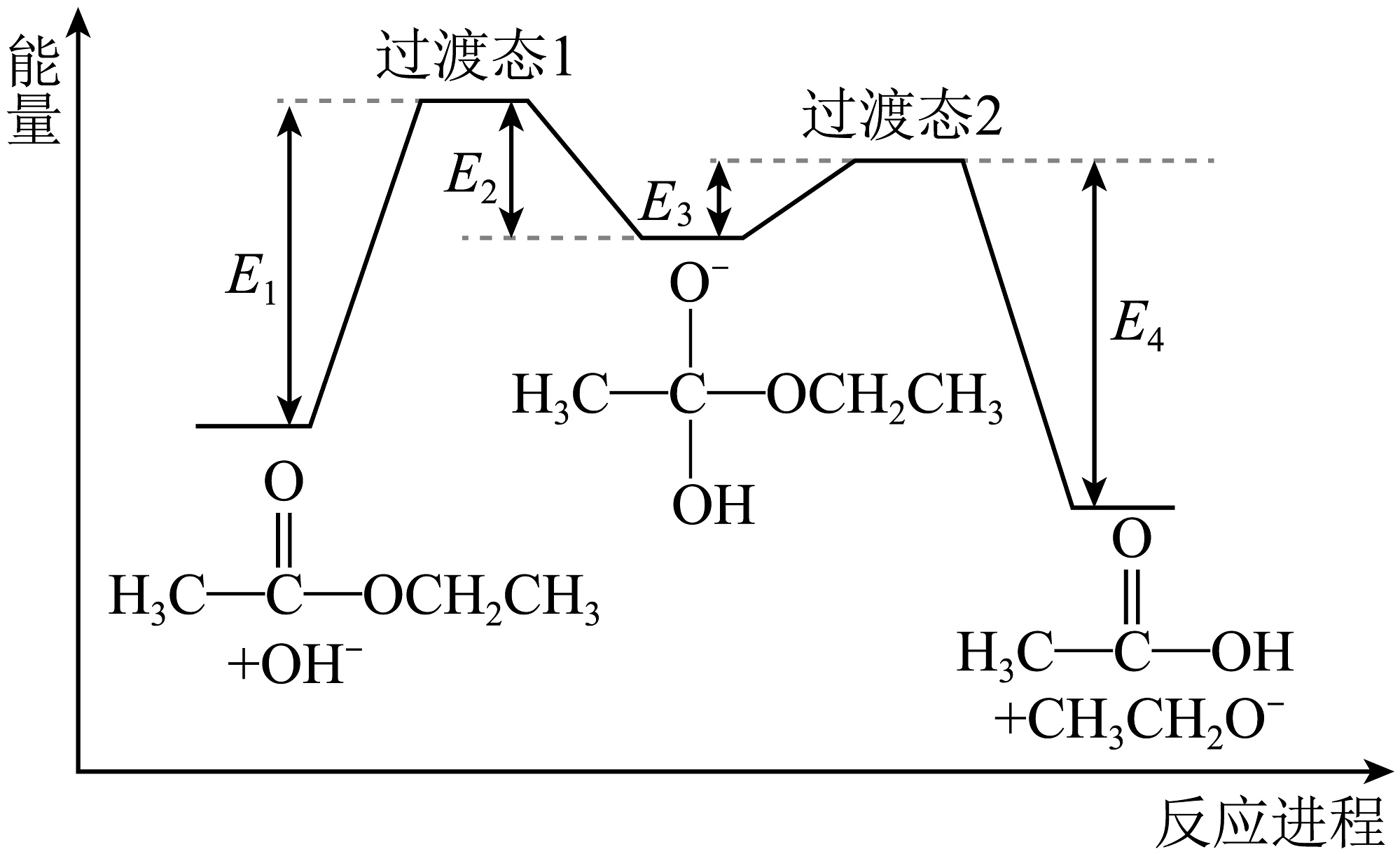
反应I、II、III、IV中,表示乙酸乙酯在NaOH溶液中水解的决速步是 , 总反应△H=(用含E1、E2、E3、E4的代数式表示),体系中含18O的微粒除A、B、D、E外,还有。
(2)、反应CH3COOH(l)+CH3CH2OH(l)CH3COOCH3CH3(l)+H2O(l)的∆H<0,∆S>0。①反应自发进行(选填“低温下”“高温下”“任意温度下”或“不能”)。
②T℃时,该反应平衡常数Kx==1,其中 , n(总)为平衡时乙醇、乙酸、乙酸乙酯和水的物质的量之和。1mol乙醇和1mol乙酸充分反应后,乙酸的转化率为(写出计算过程)。
(3)、制备乙酸乙酯的实验中,常用饱和碳酸钠溶液收集产物。CH3COOCH2CH3+H2O+Na2CO3CH3COONa+CH3CH2OH+NaHCO3 K=7.03×105 , 理论上用饱和碳酸钠溶液收集乙酸乙酯不合理。设计如下实验:
序号
操作
现象
i
取10mL饱和NaOH溶液(4.5mol·L-1)和5mL乙酸乙酯混合,加入2mL乙醇,常温下振荡5min
混合液变澄清、透明、均一
ii
取10mL饱和Na2CO3溶液(pH=12.5)和5mL乙酸乙酯混合,加入2mL乙醇并加热至90℃,振荡5min
混合液仍为乳浊液,静置后分层
根据实验,用饱和Na2CO3溶液收集乙酸乙酯是合理的,其原因有:
①饱和Na2CO3溶液极性较大,乙酸乙酯在其中的溶解度比在NaOH溶液中(填“大”或“小”)。
②从速率角度分析,。
-
15、电动汽车电池正极废料含铝箔和Li、Ni、Co、Mn等的氧化物。一种回收路线如下:
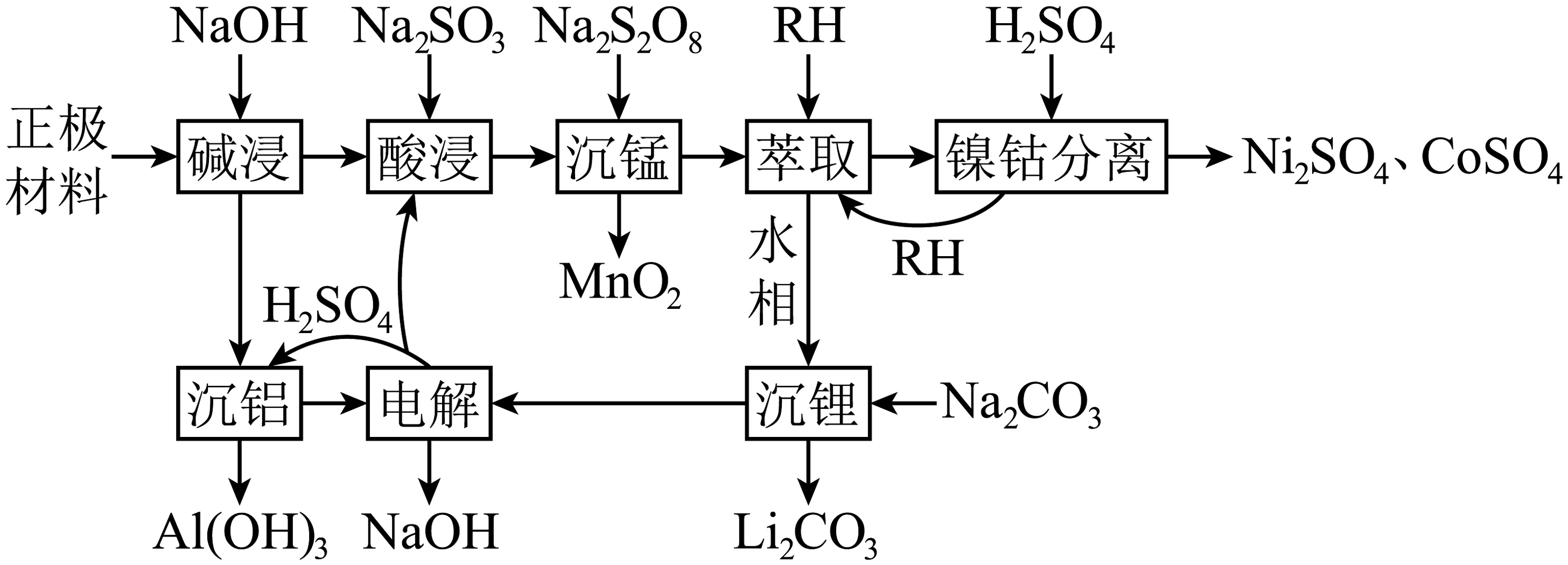
已知:I.萃取时反应:M2+(水相)+2RH(有机相)MR2(有机相)+2H+(水相),(K(M2+)为萃取反应的平衡常数,M2+代表Ni2+或Co2+)。
II.该工艺下,Ksp(Li2CO3)=2.5×10-2;饱和Na2CO3的浓度约为1.5mol·L-1。
(1)、Mn属于区元素。(2)、“碱浸”时,Al箔发生反应的离子方程式为。(3)、“酸浸”时,Co3O4被还原为Co2+ , 1molCo3O4需添加Na2SO3mol。(4)、“沉锰”时,Mn2+发生反应的离子方程式为。(5)、“镍钴分离”时,NiR2和CoR2的浓度相近,通过调控pH,可将Ni2+、Co2+依次从有机溶剂HR中分离出来,可知(填“>”“<”或“=”)(6)、该工艺中能循环利用的物质有(填化学式)。(7)、通过计算说明“沉锂”时Li+是否可以沉淀完全。(8)、正极材料的结构如图所示,粒子个数比Ni:Co:Mn= , 该材料化学式为。
-
16、铜氨纤维常用于高档丝织品,铜氨溶液可用于制作铜氨纤维。(1)、制备氨气:
实验室利用如图装置制备氨气,反应的化学方程式为。
 (2)、氨水浓度的测定:
(2)、氨水浓度的测定:将制得的氨气溶于水,取20.00mL该氨水,加入指示剂,用1.000mol·L-1盐酸滴定至终点,消耗盐酸22.00mL。
①该过程中需用到的仪器有(填仪器名称)。

②该氨水的浓度为mol·L-1。
(3)、配制铜氨溶液:向4mL0.1mol·L-1CuSO4溶液中逐滴加入上述氨水,先出现蓝色沉淀,随后沉淀溶解,溶液变为深蓝色。反应的离子方程式:I.;II.Cu(OH)2+4NH3[Cu(NH3)4]2++2OH-
(4)、探究铜氨离子形成的原因:①查阅资料 Cu(OH)2(s)Cu2+(aq)+2OH-(aq)Ksp=4.8×10-20
Cu2+(aq)+4NH3(aq)[Cu(NH3)4]2+(aq)K=7.24×1012
②提出猜想 根据查阅的资料判断反应II难以进行。通过计算说明理由。
③验证猜想 设计如下方案,进行实验。
步骤
现象
i.向4mL0.1mol·L-1CuSO4溶液中加入足量1mol·L-1溶液
生成蓝色沉淀
ii.再向i中悬浊液滴加配制的氨水,振荡
④实验小结猜想成立。
⑤教师指导Cu(OH)2+4NH3+2NH[Cu(NH3)4]2++2NH3·H2O K=1.13×103
⑥继续探究
步骤
现象
iii.向ii中继续滴加溶液
蓝色沉淀溶解,溶液变为深蓝色
⑦分析讨论结合方程式II,从平衡移动的角度解释步骤iii的现象。
-
17、T℃时,真空密闭容器中加入足量R,发生反应R(s)2S(g)+Q(g),S的分压随时间的变化曲线如图所示。下列说法不正确的是
 A、相对于曲线I,曲线II可能使用了催化剂 B、T℃时,该反应的分压平衡常数Kp=500(kPa)3 C、Q的体积分数不变,不能说明反应达到平衡状态 D、T℃时,M点压缩容器体积,平衡逆向移动,新平衡时c(S)比原平衡大
A、相对于曲线I,曲线II可能使用了催化剂 B、T℃时,该反应的分压平衡常数Kp=500(kPa)3 C、Q的体积分数不变,不能说明反应达到平衡状态 D、T℃时,M点压缩容器体积,平衡逆向移动,新平衡时c(S)比原平衡大 -
18、锌离子全电池加入弱极性FcD后,利用FcD/FcD+间的转化,可同时除去溶解氧和非活性锌,防止锌电极被溶解氧腐蚀。下列说法不正确的是
 A、理论上该电池需要不断补充FcD B、电子从锌电极经导线移向NaV3O8·1.5H2O电极 C、加入聚乙二醇是为了增大FcD在水中的溶解度 D、理论上每消耗32g溶解氧,可除去非活性锌130g
A、理论上该电池需要不断补充FcD B、电子从锌电极经导线移向NaV3O8·1.5H2O电极 C、加入聚乙二醇是为了增大FcD在水中的溶解度 D、理论上每消耗32g溶解氧,可除去非活性锌130g -
19、(WV4)2Z(YX4)2是重要的水处理剂,Z元素为+2价。V、W、X、Y、Z是原子序数递增的5种元素,前四周期均有分布,X和Y同族。W的基态原子价层p轨道半充满,Z元素的一种合金用量最大、用途最广。则A、电负性:W>X B、氢化物稳定性:X>W C、WV3和YX3的空间构型相同 D、Z的第四电离能远大于第三电离能
-
20、按下图装置,将浓H2SO4加入浓Na2S2O3溶液中,产生气泡和沉淀。下列预期现象及相应推理均合理的是
 A、烧瓶壁发热,说明反应S2O(aq)+2H+(aq)=S(s)+H2O(l)+SO2(g)放热 B、湿润的蓝色石蕊试纸变红,说明SO2水溶液显酸性 C、溴水润湿的滤纸褪色,说明SO2水溶液有漂白性 D、BaCl2溶液产生沉淀,说明生成BaSO3
A、烧瓶壁发热,说明反应S2O(aq)+2H+(aq)=S(s)+H2O(l)+SO2(g)放热 B、湿润的蓝色石蕊试纸变红,说明SO2水溶液显酸性 C、溴水润湿的滤纸褪色,说明SO2水溶液有漂白性 D、BaCl2溶液产生沉淀,说明生成BaSO3