相关试卷
-
1、回答下列问题(1)、在25℃、101kPa下,1g甲醇()燃烧生成和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为(2)、 ; , (填“>”、“<”或“=”),原因是(3)、已知拆开1molH-H键、1molN-H键、键分别需要的能量是436kJ、391kJ、946kJ,则与反应生成的热化学方程式为(4)、白磷与氧可发生如下反应:已知断裂下列化学键需要吸收的能量分别为如下:
化学键
P-P
P-O
P=O
O-O
O=O
键能(kJ/mol)
a
b
c
d
e
根据图示的分子结构和有关数据估算该反应的(用代数式表示)
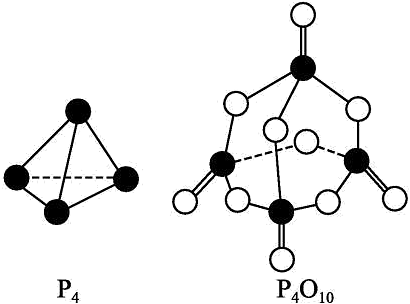 (5)、肼可作为火箭发动机的燃料,与氧化剂反应生成和水蒸气。
(5)、肼可作为火箭发动机的燃料,与氧化剂反应生成和水蒸气。已知:①
②
写出肼和反应的热化学方程式
(6)、将0.3mol的气态高能燃料乙硼烷()在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为 -
2、银锌纽扣电池是一种常见的化学电源,以Zn和Ag2O为电极,氢氧化钾溶液为电解质溶液,其电池反应为: , 装置示意图如下。
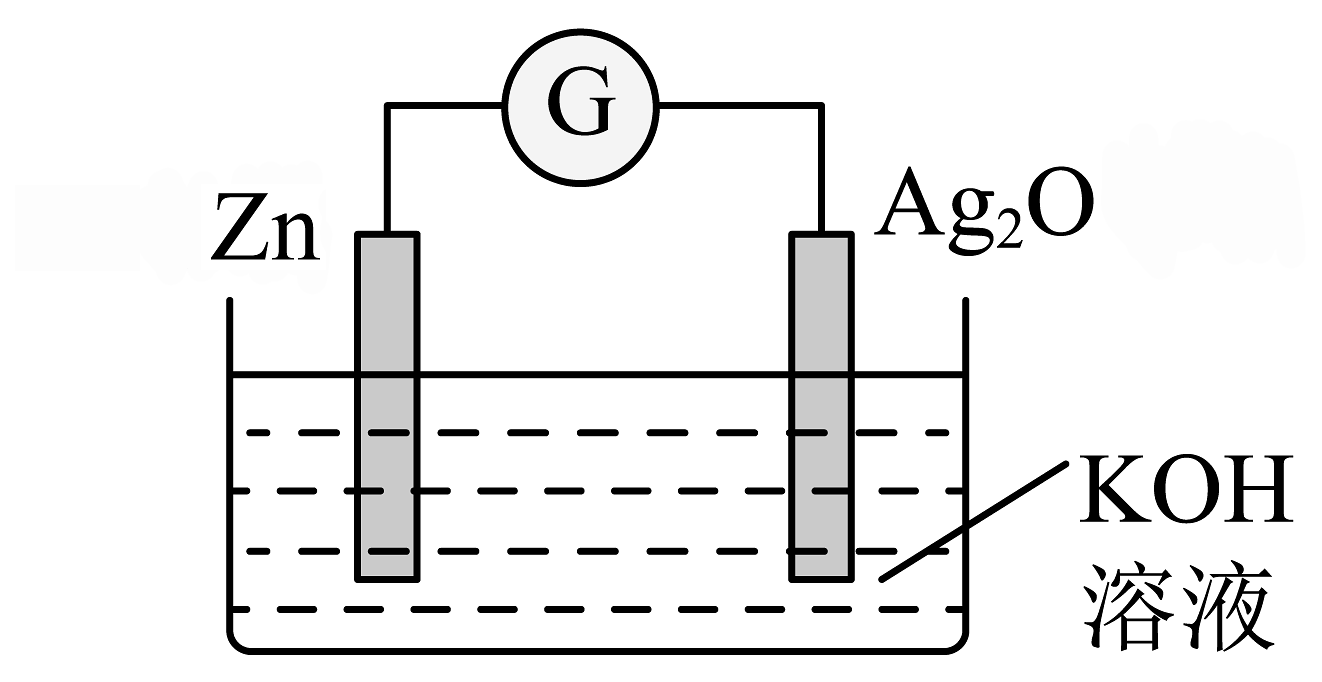
下列说法不正确的是
A、电池工作时化学能主要转化为电能 B、Zn电极是该电池的负极 C、Ag2O电极发生还原反应 D、电池工作时,电子从Zn经氢氧化钾溶液流向Ag2O -
3、与一定量浓硝酸反应,全部被消耗后,收集到标准状况下和的混合气体 , 则和的物质的量之比为A、 B、 C、 D、
-
4、短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的核内质子数为8,Y原子最外层只有1个电子,Z原子最外层电子数是其电子层数的2倍。下列叙述错误的是A、Z的非金属性比X的弱 B、X、Y可形成含有共价键的离子化合物 C、W的简单气态氢化物的热稳定性比Z的弱 D、原子半径的大小顺序:
-
5、在实验室中测定稀盐酸与氢氧化钠溶液反应的焓变,下列有关说法错误的是A、测定时使用温度计的次数为3次 B、测量终止温度时,应当记录混合溶液的最高温度 C、为了使酸碱充分反应,应当缓慢分次倒入溶液并搅拌 D、若用同浓度同体积的醋酸代替盐酸,测得的变大
-
6、下列说法正确的是A、和互为同素异形体 B、和互为同系物 C、H、D、T互为同位素 D、
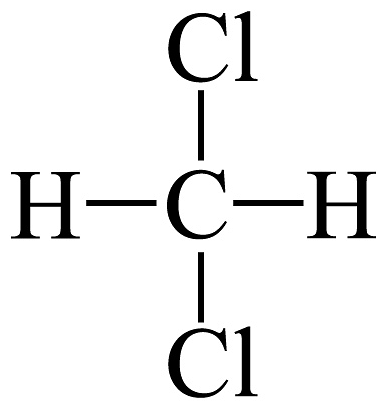 和
和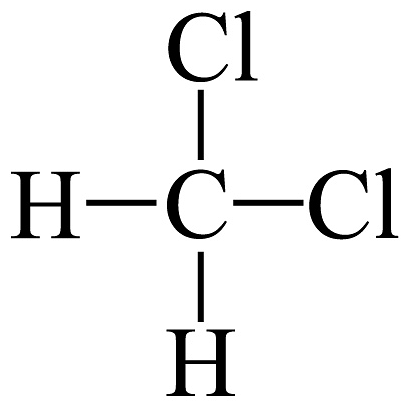 互为同分异构体
互为同分异构体
-
7、已知碳、一氧化碳、晶体硅的燃烧热分别是、、 , 则工业冶炼晶体硅的反应为 。则下列判断错误的是A、 B、 C、 D、
-
8、某兴趣小组发现铜锈的主要成分碱式碳酸铜受热时能发生反应:。下列说法正确的是A、碱式碳酸铜属于碱 B、属于酸性氧化物 C、属于电解质 D、干冰属于混合物
-
9、下列有关化学用语表示正确的是A、H2O的电子式:
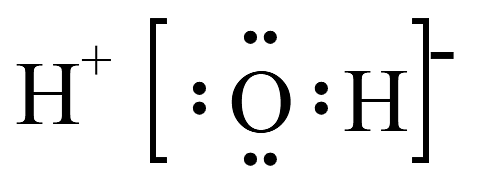 B、NaHCO3在水中的电离方程式:
C、HCl的结构式:H=Cl
D、Cl-的结构示意图:
B、NaHCO3在水中的电离方程式:
C、HCl的结构式:H=Cl
D、Cl-的结构示意图: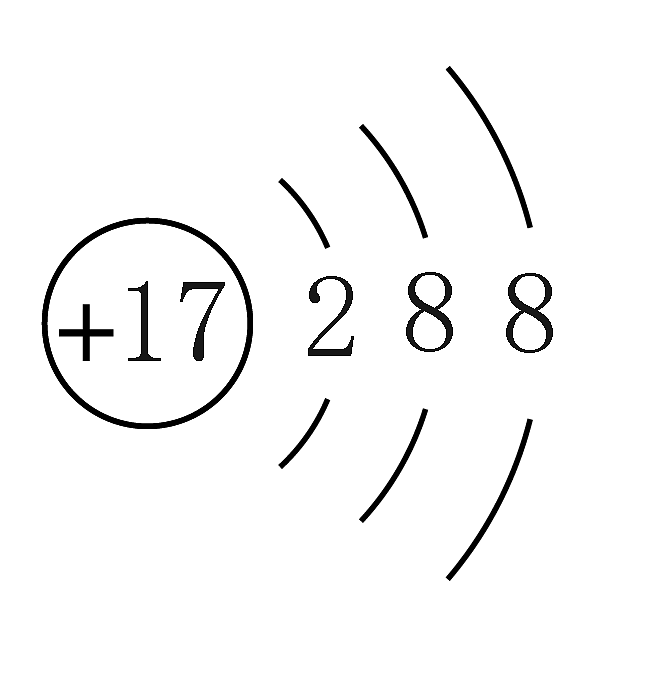
-
10、用表示阿伏加德罗常数的值。下列说法正确的是A、晶体中含共价键数目为 B、中含有的离子总数为 C、足量的与完全反应时,转移的电子数为 D、标准状况下,与足量充分反应后,所得氨分子的数目为
-
11、下列反应既是离子反应,又是氧化还原反应的是A、和稀硫酸反应 B、在中燃烧 C、溶于稀盐酸 D、过氧化钠投入水中
-
12、唐代诗人刘禹锡《浪淘沙》诗“日照澄洲江雾开,淘金女伴满江限。美人首饰侯王印,尽是沙中浪底来。”描述了古代淘金的场景。下列说法错误的是A、雾是一种常见的气溶胶 B、雾中分散质的粒径比钠离子小 C、阳光透过雾会产生丁达尔效应 D、金从“沙中浪底来”不涉及化学变化
-
13、以V2O5为原料制备氧钒(IV)碱式碳酸铵(NH4)5[(VO)6(CO3)4(OH)9]•10H2O
过程:V2O5VOCl2溶液氧钒(IV)碱式碳酸铵粗产品
已知VO2+能被O2氧化,回答下列问题:
(1)、步骤I的反应装置如图(夹持及加热装置略去,下同)
①仪器b的名称为 , 仪器c除冷凝回流外,另一作用为。
②步骤I生成VOCl2的同时,还生成一种无色无污染的气体,该反应的化学方程式为。
(2)、步骤II可在如图装置中进行。
①接口的连接顺序为a→。
②实验开始时,先关闭K2 , 打开K1 , 当时(写实验现象),再关闭K1 , 打开K2 , 充分反应,静置,得到固体。
(3)、测定产品纯度称取mg样品用稀硫酸溶解后,加入过量的0.02mol•L-1KMnO4溶液,充分反应后加入过量的NaNO2溶液,再加适量尿素除去NaNO2 , 用cmol•L-1(NH4)2Fe(SO4)2标准溶液滴定达终点时,消耗体积为VmL。(已知:VO+Fe2++2H+=VO2++Fe3++H2O)
①样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为。
②下列情况会导致产品纯度偏大的是(填标号)。
A.未加尿素,直接进行滴定
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
-
14、有机物M是屈洛昔芬药物的一种中间体,合成M的一种路线如图所示:

已知:ROH+SOCl2RCl+SO2↑+HCl↑。
请回答下列问题:
(1)、A的名称是 , I中含氧官能团的名称是。(2)、A→B的反应类型是。(3)、D与新制Cu(OH)2悬浊液反应的化学方程式为。(4)、H的结构简式为。(5)、K的核磁共振氢谱吸收峰面积比为。(6)、同时符合下列条件的J的同分异构体R共有种(不考虑立体异构)。①能与氯化铁溶液发生显色反应
②能发生银镜反应
③R中不含甲基
④含有
 结构,且每个苯环上均只含一种含氧官能团(7)、根据上述信息,设计以苯、3-羟基丙酸为原料制备
结构,且每个苯环上均只含一种含氧官能团(7)、根据上述信息,设计以苯、3-羟基丙酸为原料制备 的合成路线:(其他无机试剂任选)。
的合成路线:(其他无机试剂任选)。 -
15、固体电解质LATP的化学式为Li1.4Al0.4Ti1.6(PO4)3 , 某研究人员以钛铁矿精粉(主要成分为FeTiO3 , 含少量Al2O3、SiO2)为原料合成LATP的工艺流程如图所示。

请回答下列问题:
(1)、“粉碎”的目的是 , 为了达到这一目的,还可以采用的措施有(答一条即可)。(2)、“碱浸”的目的是除去(填化学式)。(3)、“碱浸”时加入适当过量的NaOH溶液,“酸浸”时加入适当过量的稀硫酸,且NaOH溶液和稀硫酸均不宜过量太多,其主要原因是。(4)、“沉钛”时生成Ti3(PO4)4的化学方程式为。(5)、本实验洗涤Ti3(PO4)4时采用如图所示装置,该装置为抽滤装置,其原理是用抽气泵使吸滤瓶中的压强降低,达到快速固液分离的目的。其中“安全瓶”的作用是。 (6)、常温下,Ti3(PO4)4的Ksp=a,当溶液中c(Ti4+)≤1.0×10-5 mol·L-1时可认为Ti4+沉淀完全,则“沉钛”时,溶液中c(PO)最低为mol·L-1.
(6)、常温下,Ti3(PO4)4的Ksp=a,当溶液中c(Ti4+)≤1.0×10-5 mol·L-1时可认为Ti4+沉淀完全,则“沉钛”时,溶液中c(PO)最低为mol·L-1. -
16、铜金合金可作为转化为碳氢化合物的催化剂,如图是一种铜金合金的晶胞结构图。下列说法正确的是
 A、该晶胞的体积为 B、Au和Cu原子数之比为3∶1 C、与Au最邻近的Cu原子数为12 D、Au和Cu之间的最短距离为
A、该晶胞的体积为 B、Au和Cu原子数之比为3∶1 C、与Au最邻近的Cu原子数为12 D、Au和Cu之间的最短距离为 -
17、是一元弱酸,难溶盐的悬浊液中,不发生水解。实验发现,时,、的关系如图所示:

下列说法错误的是
A、表示的关系 B、 C、 D、 -
18、下列实验现象与实验操作不匹配的是
实验操作
实验现象
A
已知 , 为黄绿色,将盛有溶液的试管加热
溶液变为黄绿色
B
将绕成螺旋状的铜丝伸入到盛有浓硝酸的试管中
铜丝溶解,溶液变为蓝色,生成红棕色气体
C
向盛有溶液的试管里逐滴滴加氨水至过量
先产生蓝色沉淀,后沉淀溶解,得到深蓝色透明溶液
D
用玻璃棒摩擦装有过饱和醋酸钠溶液的试管内壁
有晶体析出
A、A B、B C、C D、D -
19、东南大学化学化工学院张袁健教授探究Fe—N—C和Co—N—C分别催化H2O2分解的反应机理,部分反应历程如图所示(MS表示吸附在催化剂表面物种;TS表示过渡态):

下列说法错误的是
A、催化效果:催化剂Co—N—C高于催化剂Fe—N—C B、Fe—N—C催化:MS1(s)=MS2(s) ΔH=-0.22 eV C、催化剂Fe—N—C比催化剂Co—N—C的产物更容易脱附 D、Co—N—C和Fe—N—C催化H2O2分解均为吸热反应 -
20、浓差电池指利用两极电解质溶液中浓度不同引起的电势差放电。实验室利用浓差电池实现电解丙烯腈()合成己二腈[],装置如图所示(实验前,隔膜两侧溶液均为200 mL,铜电极质量均为100 g)。

下列说法正确的是
A、Cu(1)极为负极,其电极反应为 B、隔膜为阴离子交换膜,C(2)极为阴极 C、上述装置理论上可制备0.6 mol己二腈 D、当电解停止时,Cu(1)极与Cu(2)极质量相差51.2 g