相关试卷
-
1、室温下用0.1molL﹣1Na2SO3溶液吸收SO2的一种脱硫工艺流程如图所示。已知H2SO3电离平衡常数分别为Ka1=1.0×10﹣2 , Ka2=1.0×10﹣7 , H2CO3电离平衡常数分别为Ka1=4.0×10﹣7、Ka2=5.0×10﹣11 , Ksp(CaCO3)=3×10﹣9 , Ksp(CaSO3)=3×10﹣7 , 忽略通入SO2所引起的溶液体积变化和H2O挥发。

下列说法正确的是
A、0.1molL﹣1Na2SO3溶液中:c(OH﹣)=c(H+)+c()+c(H2SO3) B、NaHSO3溶液中:c()<c(H2SO3) C、“沉淀”分离后的滤液中:c(Ca2+)c()<Ksp(CaSO3) D、“沉淀”时发生主要反应的离子方程式:CaCO3+=CaSO3+ -
2、下列说法不正确的是A、pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大 B、将NaCl溶液从常温加热至80℃,溶液的pH变小 C、NaHA溶液呈酸性,说明H2A为弱酸,且HA﹣的电离程度大于水解 D、室温下,100mLpH=10.0的Na2CO3溶液中水电离出OH﹣的物质的量为1.0×10﹣5mol
-
3、用钌(Ru)基催化剂催化CO2(g)和H2(g)的反应示意图如图,当反应生成46g液态HCOOH时放出31.2kJ的热量。下列说法正确的是
 A、反应历程中存在极性键、非极性键的断裂与形成 B、图示中物质Ⅰ、Ⅱ、Ⅲ均为该反应的催化剂 C、使用催化剂可以降低反应的活化能,从而改变反应的焓变 D、由题意知:HCOOH(l)=CO2(g)+H2(g) ΔH=+31.2kJmol﹣1
A、反应历程中存在极性键、非极性键的断裂与形成 B、图示中物质Ⅰ、Ⅱ、Ⅲ均为该反应的催化剂 C、使用催化剂可以降低反应的活化能,从而改变反应的焓变 D、由题意知:HCOOH(l)=CO2(g)+H2(g) ΔH=+31.2kJmol﹣1 -
4、下列说法正确的是A、已知:H-H键、H-N键和N≡N键的键焓ΔH分别为436kJ·mol﹣1、391kJ·mol﹣1和946kJ·mol﹣1 , 则N2(g)+3H2(g)=2NH3(g) ΔH=﹣92kJ·mol﹣1 B、已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=﹣802.3kJ/mol,则甲烷的燃烧热为802.3kJ/mol C、已知:4P(红磷,s)=P4(白磷,s) ΔH>0,则相同条件下,白磷比红磷稳定 D、已知:H+(aq)+OH﹣(aq)=H2O(l) ΔH=﹣57.3kJmol﹣1 , 则H2SO4和Ba(OH)2反应:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=﹣114.6kJmol﹣1
-
5、化学中常用图象直观地描述化学反应的进程或结果。下列图象描述正确的是
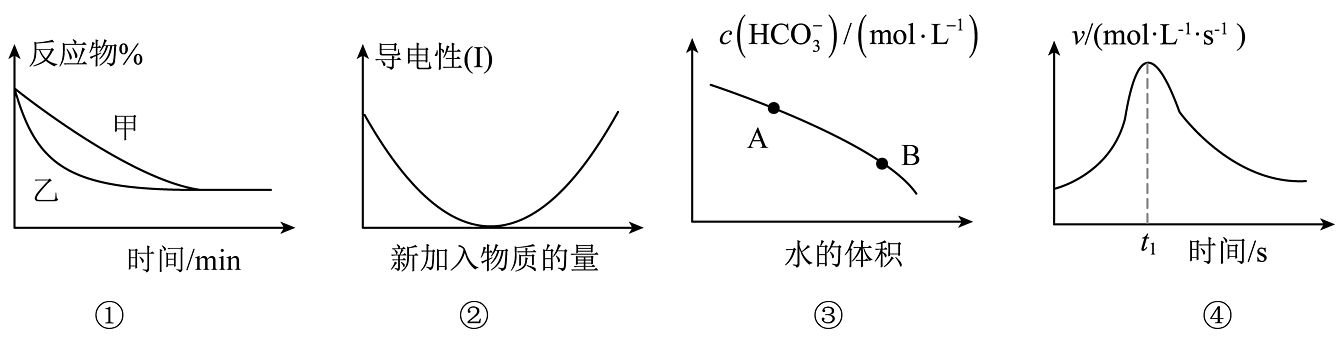 A、图①表示压强对可逆反应2A(g)+2B(g)3C(g)+D(s)的影响,乙的压强大 B、图②可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 C、图③是在0.1mol⋅L﹣1的Na2CO3溶液中加水稀释,随着加入水的体积的增大,溶液中c()的变化曲线,Na2CO3的水解程度:A点小于B点 D、图④是铁条与盐酸反应的反应速率随反应时间变化的曲线,t1时刻溶液的温度最高
A、图①表示压强对可逆反应2A(g)+2B(g)3C(g)+D(s)的影响,乙的压强大 B、图②可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 C、图③是在0.1mol⋅L﹣1的Na2CO3溶液中加水稀释,随着加入水的体积的增大,溶液中c()的变化曲线,Na2CO3的水解程度:A点小于B点 D、图④是铁条与盐酸反应的反应速率随反应时间变化的曲线,t1时刻溶液的温度最高 -
6、下列说法中正确的是A、在100℃时,pH约为6的纯水呈酸性 B、将1mL 1×10-6 mol/L 盐酸稀释到1000 mL,所得溶液的pH为9 C、c(H+) < c(OH-)的溶液一定显碱性 D、强电解质溶液的导电能力一定比弱电解质溶液的强
-
7、下列说法正确的是A、纸层析法点样时应用玻璃棒蘸取试样,在滤纸条的原点处轻轻点样,晾干后再点,重复3—5次 B、吸滤瓶内液面高度将达到支管口时,应拔掉吸滤瓶上的橡皮管,并从吸滤瓶支管口倒出溶液 C、制备摩尔盐实验中,将(NH4)2SO4饱和溶液与FeSO4饱和溶液混合后,在蒸发皿中蒸发至大量晶体析出,然后冷却、抽滤 D、用一定浓度氢氧化钠溶液滴定未知浓度醋酸溶液,若碱滴加过量,不需重做实验
-
8、化学与生活密切相关,下列做法与化学反应速率控制无关的是A、使用含氟牙膏防龋齿 B、洗衣服时使用加酶洗衣粉 C、夏天将牛奶放在冰箱保存 D、在月饼包装内放置抗氧化剂
-
9、离子方程式的能代表的物质是
① ② ③ ④ ⑤
A、①③ B、①④⑤ C、①②④ D、①⑤ -
10、某化学兴趣小组要完成中和反应反应热的测定实验。(1)、实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、温度计、玻璃搅拌器、0.5 mol·L-1盐酸、0.55 mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是。(2)、实验中能否用环形铜丝搅拌器代替玻璃搅拌器(填“能”或“否”),其原因是。(3)、他们记录的实验数据如下,请计算完成下表。
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1 , 各物质的密度均为1 g·cm-3。
实验用品
溶液温度
生成1 mol H2O放出的热量
t1
t2
a
50 mL 0.55 mol·L-1 NaOH溶液
50 mL 0.5 mol·L-1
HCl溶液
20 ℃
23.3 ℃
(保留一位小数)
b
50 mL 0.55 mol·L-1 NaOH溶液
50 mL 0.5 mol·L-1 HCl溶液
20 ℃
23.5 ℃
(4)、若用氢氧化钾代替氢氧化钠,对测定结果(填“有”或“无”,下同)影响;若用醋酸代替盐酸做实验,对测定结果影响。 -
11、某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号
实验温度/K
有关物质
溶液颜色褪至无色所需时间/s
酸性KMnO4溶液
H2C2O4溶液
H2O
V/mL
c/mol·L-1
V/mL
c/mol·L-1
V/mL
A
293
2
0.02
4
0.1
0
t1
B
T1
2
0.02
3
0.1
V1
8
C
313
2
0.02
V2
0.1
1
t2
(1)、通过实验A、B,可探究出(填外部因素)的改变对化学反应速率的影响,其中V1=、T1=;通过实验(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=。(2)、若t1<8,则由此实验可以得出的结论是。(3)、该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+) 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是 , 相应的粒子最可能是(填粒子符号)。
-
12、有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。(1)、在101kP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题
①该反应反应物总能量生成物总能量(填“大于”,“小于”或“等于”)
②氢气的燃烧热为。
③该反应的热化学方程式为。
④若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463 kJ·mol-1 , O=O键能为498 kJ·mol-1 , 计算H-H键能为kJ·mol-1
(2)、氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=kJ·mol-1
-
13、汽车尾气系统中,有毒气体CO和NO在三元催化剂作用下生成无毒气体,某课外化学兴趣小组用如下装置模拟该转化过程。
 (1)、a装置中试剂为浓硫酸,其作用为(选填编号,下同);c装置作用为。
(1)、a装置中试剂为浓硫酸,其作用为(选填编号,下同);c装置作用为。①干燥 ②观察流速 ③混合气体 ④ 安全瓶
(2)、以上装置图中b装置的硬质玻璃管中发生的反应为。(3)、氢化钠(NaH)在野外被用作生氢剂,其原理NaH + H2O = NaOH + H2↑,该反应中氧化剂是 , 被氧化与被还原元素的物质的量之比为。 -
14、已知下列反应的平衡常数: , ; , ;则反应的平衡常数是A、 B、 C、 D、
-
15、关于平衡常数K,下列说法中正确的是A、K值越大,反应越容易进行 B、对任一给定的可逆反应,温度升高,K值增大 C、对同一可逆反应,K值越大,反应物的转化率越高 D、加入催化剂或增大反应物浓度,K值将增大
-
16、下列只含共价键的化合物是A、HClO4 B、NaCl C、KOH D、MgCl2
-
17、电镀废液中可通过下列反应转化成铬黄(PbCrO4):(aq)+2Pb2+(aq)+H2O(l)⇌2PbCrO4(s)+2H+(aq) ΔH<0。该反应达平衡后,改变条件,下列说法正确的是A、移走部分PbCrO4固体,转化率升高 B、加入少量K2Cr2O7固体后,溶液中c(H+)不变 C、加入少量NaOH固体,自然沉降后,溶液颜色变浅 D、升高温度,该反应的平衡常数K增大
-
18、已知A、B、C、D四种物质都是气体,现在5L的密闭容器中进行反应:4A+5B
 4C+6D,30s后C的物质的量增加了0.30mol。则下列有关叙述正确的是( ) A、反应开始至30s,v(A)=0.010mol·L-1·s-1 B、30s时容器中D的物质的量至少为0.45mol C、30s时容器中A、B、C、D的物质的量之比一定是4∶5∶4∶6 D、反应开始至30s,容器中A的物质的量增加了0.30mol
4C+6D,30s后C的物质的量增加了0.30mol。则下列有关叙述正确的是( ) A、反应开始至30s,v(A)=0.010mol·L-1·s-1 B、30s时容器中D的物质的量至少为0.45mol C、30s时容器中A、B、C、D的物质的量之比一定是4∶5∶4∶6 D、反应开始至30s,容器中A的物质的量增加了0.30mol -
19、低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g)2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是A、其他条件不变,使用高效催化剂,会缩短反应时间且废气中氮氧化物的转化率增大 B、其他条件不变,加入足量的NH3 , 再次平衡后氮氧化物的转化率增大,氮气的体积分数减小 C、其他条件不变,升高温度会提高反应物的转化率且使该反应的平衡常数增大 D、其他条件不变,缩小容器的体积会使平衡正向移动,再次平衡后氨气的浓度变小
-
20、已知:H2S在与不足量的O2反应时,生成S和H2O。根据以下三个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH2
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH3
判断ΔH1、ΔH2、ΔH3三者大小关系正确的是
A、ΔH3>ΔH2>ΔH1 B、ΔH1>ΔH3>ΔH2 C、ΔH1>ΔH2>ΔH3 D、ΔH2>ΔH1>ΔH3