相关试卷
-
1、硝酸铁可作催化剂、氧化剂等。(1)、的制备:往浓硝酸中加入铁屑,微热充分反应,反应中元素(填符号)被还原。用(填化学式)溶液吸收废气,通入空气可制取。(2)、溶液配制:固体先加入冷的稀酸溶解再加水稀释,原因是。(3)、用溶液溶解银粉并进行原理探究
实验1:将溶液加入到银粉中,银粉迅速溶解,5分钟后有少量固体残留,且无明显继续溶解现象。
原理探究:小组同学设计以下实验研究溶银的可能微粒:
序号
操作
现象
2
取实验1中上层清液于试管中,加入2滴溶液
产生蓝色沉淀
3
取溶液 , 加入银粉中,充分振荡10分钟
银粉不溶解
结论:银粉溶解的原因为(写离子反应方程式)。
(4)、银未完全溶解的原因探究①提出假设 小组同学提出以下假设:
假设1 溶液浓度下降,反应速率减慢;假设2 该反应是可逆反应,处于平衡状态。
②验证假设 通过测定的变化来验证,设计对比实验如下:
序号
实现操作
4
重复实验1,5分钟后过滤混合物,滤液稀释至 , 取稀释液加入指示剂,用溶液滴定,消耗溶液体积为
5
重复实验1,5分钟后继续放置更长时间,测定结果同实验4
i.实验中用到图甲中的仪器有(填标号)。

ii.计算实验中银粉的溶解程度:。
③实验结论 假设2成立。完成下列问题:
i.在图乙中画出实验1中平衡建立的曲线(含标注,忽略溶液体积变化)。

ii.根据平衡移动原理,往实验1混合物中加入 , 剩余的银可完全溶解。
(5)、比作为溶银试剂更环保的原因是。 -
2、通过电解含锰废水可回收和产品,其工作原理如图,下列说法不正确的是
 A、惰性电极a连接电源的负极 B、膜X类型为阳离子交换膜 C、室发生的电极反应: D、当电路中通过电子,从溶液中回收锰元素的质量为
A、惰性电极a连接电源的负极 B、膜X类型为阳离子交换膜 C、室发生的电极反应: D、当电路中通过电子,从溶液中回收锰元素的质量为 -
3、X在复合催化剂下可发生反应如下所示,反应历程如图所示,其它条件相同时,下列说法不正确的是

 A、步骤为决速步 B、升高反应温度,增大 C、改良催化剂N可改变 D、 , 没有催化剂M,该比较结果也不影响
A、步骤为决速步 B、升高反应温度,增大 C、改良催化剂N可改变 D、 , 没有催化剂M,该比较结果也不影响 -
4、下列陈述与陈述均正确,且具有因果关系的是
选项
陈述
陈述
A
酸性:
羧基在水溶液中能电离出
B
用除去废水中的
具有较强的还原性
C
铁板上的锌块在潮湿空气中更容易被腐蚀
容易失电子
D
苯和稀溴水混合、振荡、静置,水层几乎无色
和苯都是非极性分子
A、A B、B C、C D、D -
5、某学习小组利用下图装置制备84消毒液。下列说法正确的是
 A、湿润的蓝色石蕊试纸褪色,说明有漂白性 B、中溶液出现浑浊,说明降低了的溶解度 C、若无装置 , 制取的84消毒液中的纯度下降 D、该装置条件下,若用代替也可制取84消毒液
A、湿润的蓝色石蕊试纸褪色,说明有漂白性 B、中溶液出现浑浊,说明降低了的溶解度 C、若无装置 , 制取的84消毒液中的纯度下降 D、该装置条件下,若用代替也可制取84消毒液 -
6、部分元素的化合价及物质类别用下图表示,图中表示含铝或铜元素的物质,下列推断合理的是
 A、工业上可通过电解b和d制备a B、a与e反应可转化为d C、水溶液中,b与a反应可转化为d D、加入过量氨水,可由b、d分别制取c、e
A、工业上可通过电解b和d制备a B、a与e反应可转化为d C、水溶液中,b与a反应可转化为d D、加入过量氨水,可由b、d分别制取c、e -
7、一种有机除草剂的分子结构式如图所示,已知X、Y、Z、W、E为原子序数依次增大的短周期元素,Z和E同主族,Z与W同周期,则错误的是
 A、元素电负性: B、简单氢化物沸点: C、第一电离能: D、的模型和空间结构均为平面三角形
A、元素电负性: B、简单氢化物沸点: C、第一电离能: D、的模型和空间结构均为平面三角形 -
8、分离乙酸乙酯、乙酸和乙醇混合物的流程如下,操作X为
 A、冷却结晶 B、蒸发结晶 C、萃取分液 D、加热蒸馏
A、冷却结晶 B、蒸发结晶 C、萃取分液 D、加热蒸馏 -
9、设为阿伏加德罗常数的值。下列说法正确的是A、与充分反应后的分子数目为 B、标准状况下,的中含有的σ键数目为 C、溶液中含氮微粒的总数目为 D、完全水解生成的胶粒数为
-
10、大环化合物在催化等领域具有良好的应用前景。关于下图所示大环化合物的说法不正确的是
 A、苯环上的一氯代物共有2种 B、能发生还原反应 C、能使酸性溶液褪色 D、能与氨基酸中的羧基反应
A、苯环上的一氯代物共有2种 B、能发生还原反应 C、能使酸性溶液褪色 D、能与氨基酸中的羧基反应 -
11、Li-MnO2纽扣电池的总反应式为Li+MnO2=LiMnO2 , 装置如图所示,下列该电池说法不正确的是
 A、阳离子移向MnO2电极 B、放电时,热能转化为电能 C、不能选用水溶液作电解质溶液 D、正极反应为:MnO2+e-+Li+= LiMnO2
A、阳离子移向MnO2电极 B、放电时,热能转化为电能 C、不能选用水溶液作电解质溶液 D、正极反应为:MnO2+e-+Li+= LiMnO2 -
12、关于的实验装置或操作不能达到实验目的的是
目的
制备
干燥
装置或操作


选项
A
B
目的
验证的性质
尾气吸收
装置或操作


选项
C
D
A、A B、B C、C D、D -
13、化学处处呈现美。下列说法不正确的是A、甲烷呈正四面体结构,碳原子为杂化 B、封装管遇热变色,平衡正移 C、舞台上闪烁多彩光束,光透过气溶胶产生丁达尔效应 D、钠燃烧发出美丽黄光,碱金属元素的焰色试验均为黄色
-
14、劳动成就梦想,技能点亮人生。下列劳动项目与所述的化学知识没有关联的是
选项
劳动项目
化学知识
A
建筑:用混凝土浇灌桥墩
硅酸盐水泥显碱性
B
科研:用杯酚分离和
超分子有分子识别的特性
C
家务:用小苏打做面点膨松剂
分解产生
D
环卫:用“84”消毒液对环境消毒
“84”消毒液具有强氧化性
A、A B、B C、C D、D -
15、舌尖上的美味,源于大自然的馈赠。下列说法不正确的是A、用甘蔗生产蔗糖,蔗糖易溶于水 B、用卤水点豆腐,卤水中含电解质 C、用大豆制酱油,大豆含的蛋白质可水解 D、压榨花生制花生油,油脂属于天然高分子化合物
-
16、硬核技术助嫦娥六号“翻然落广寒”。下列说法不正确的是A、制作“石头版”五星红旗的玄武岩纤维属于无机纤维 B、对采集到的月壤,可利用光谱仪鉴定其中所含的元素 C、“胖五”火箭推进器使用的燃料液氢属于共价化合物 D、“挖土锹”使用了异形铝合金,铝合金的硬度比铝单质大
-
17、每一种生肖都有其独特的文化内涵。下列与生肖有关的文物中,主要材质为金属材料的是
A.铜马(明)
B.玉兔(唐)


C.瓷猪(宋)
D.陶狗(汉)

 A、A B、B C、C D、D
A、A B、B C、C D、D -
18、含氮化合物是化工、能源、环保等领域的研究热点。(1)、工业上常用NH3和CO2合成尿素[CO(NH2)2],利用该反应可以在一定程度上减缓温室效应。该反应可分两步进行,其能量变化和反应历程如图所示
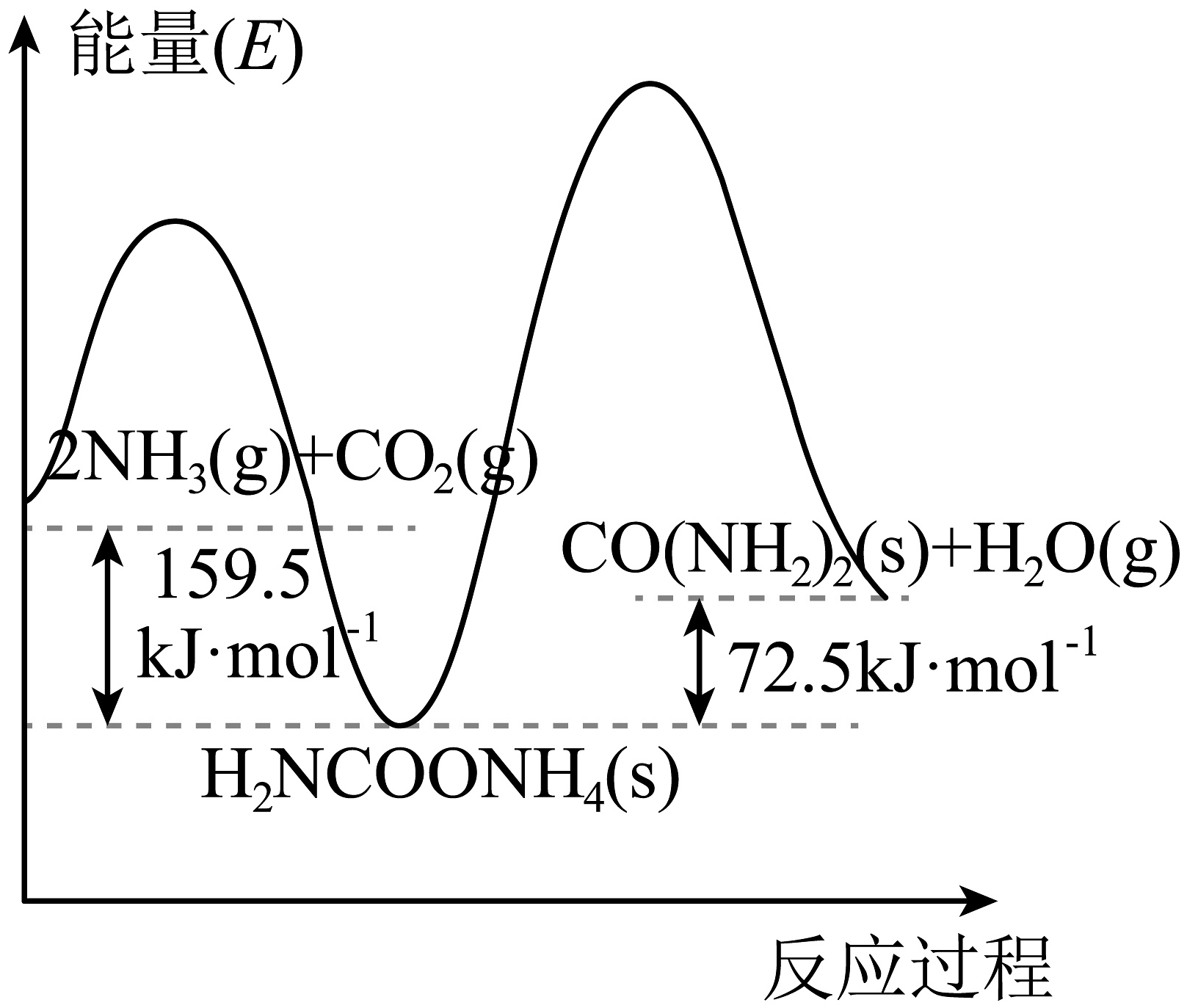
①以NH3、CO2为原料生产尿素[CO(NH2)2]的热化学方程式为;
②合成尿素总反应自发进行的条件是(填“高温”或“低温”)。
(2)、一定温度下,将NH3和CO2按2:1的物质的量之比充入一容积恒为10L的密闭容器中发生总反应。15min时达到平衡,各物质的浓度变化曲线如图所示。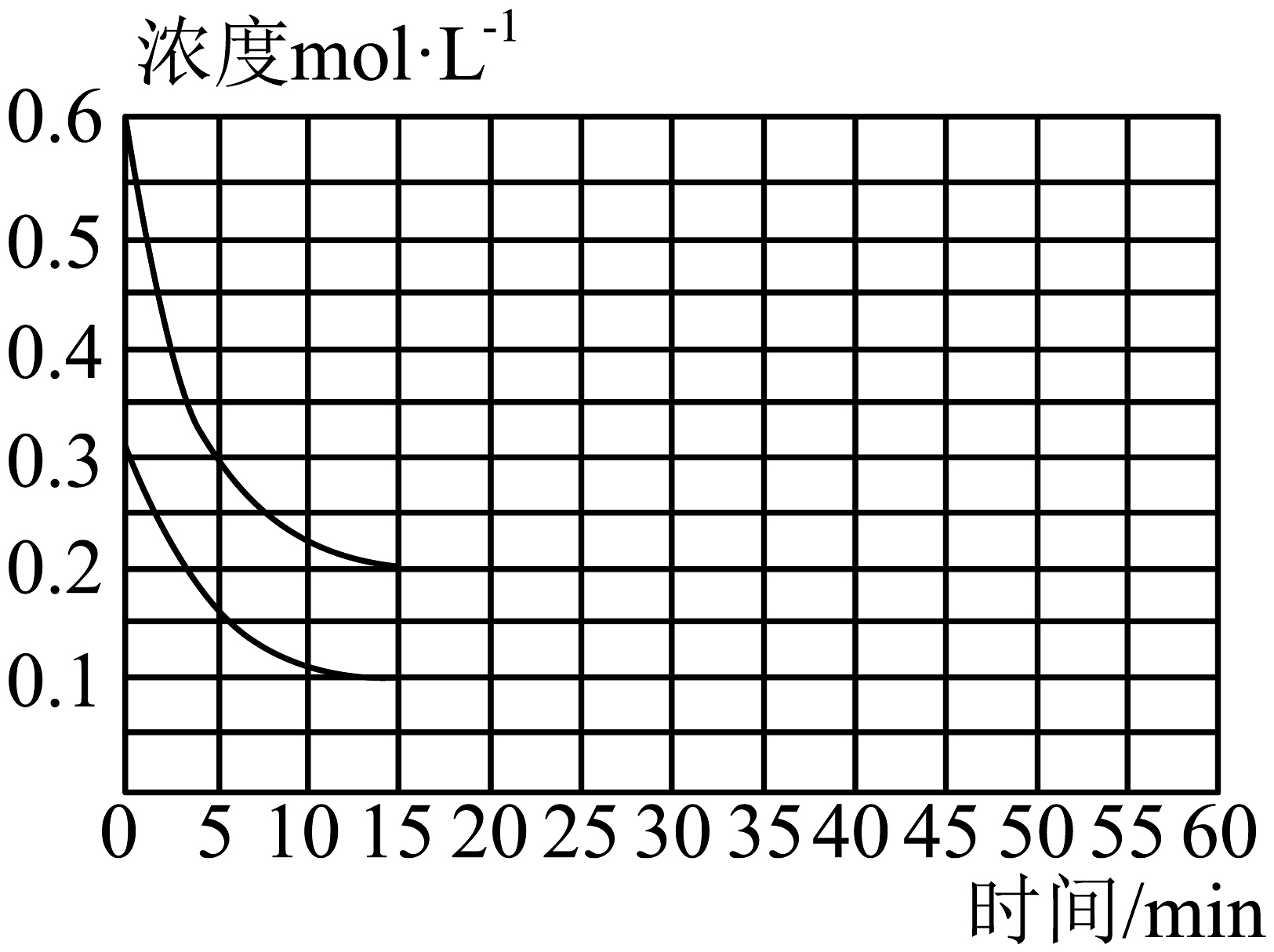
①上述条件下,从反应开始至15min时,CO(NH2)2的平均生成速率为gmin﹣1。
②下列叙述中能说明该反应达到平衡状态的是(填选项字母)。
A.体系压强不再变化
B.NH3和CO2的浓度之比为2:1
C.气体平均摩尔质量不再变化
D.NH3的消耗速率和CO2的消耗速率之比为2:1
③25min时再向容器中充入2mol的NH3、1molCO2和2molH2O,则此时平衡(填“正向移动”或“逆向移动”),再次平衡时总反应的平衡常数为。
(3)、汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。中国科学家在以H2为还原剂清除NO的研究方面取得了显著成果,其化学方程式为2NO(g)+2H2(g)⇌N2(g)+2H2O(g) ΔH<0。当固定比例的NO(g)和H2(g)的混合气体,以相同流速分别通过填充有两种催化剂的反应器,测得NO的转化率与温度的关系如图所示。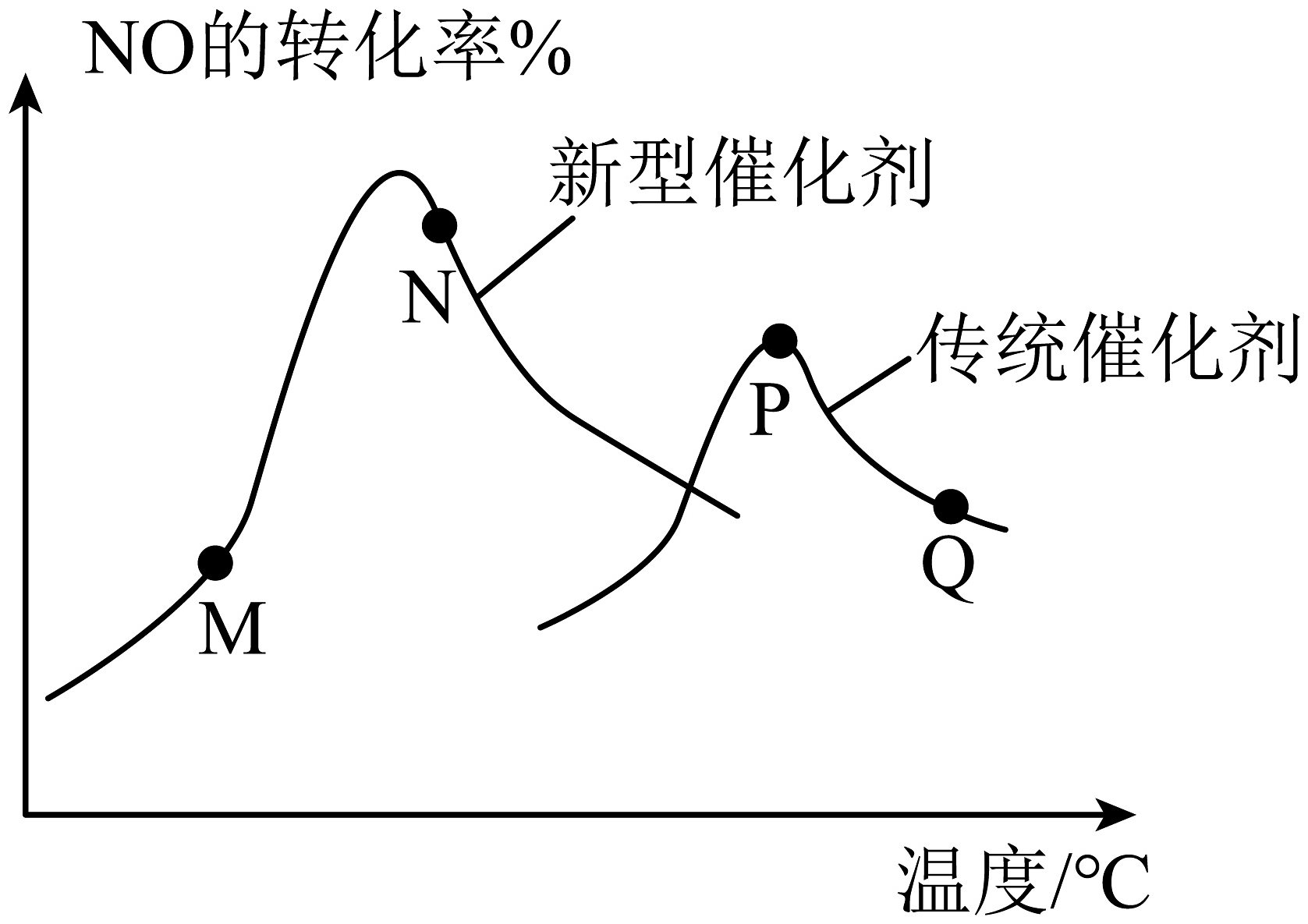
①新型催化剂优于传统催化剂的理由为。
②M、N、P、Q四点中一定未达到平衡状态的是(填字母)。
-
19、NA是阿伏加德罗常数的值,下列说法正确的是A、电解精炼铜时在阳极减少32g,转移电子的个数为NA B、25℃时,1L pH=13的Ba(OH)2溶液中含有的OH﹣数目为0.1NA C、氢氧燃料电池工作时,标准状况下正极消耗11.2L气体,电路中转移电子数为NA D、0.1mol/L的Na2CO3溶液中H2CO3、、的粒子总数为0.1NA
-
20、下列与实验相关的叙述正确的是A、用湿润的pH试纸测定硫酸溶液的pH B、酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 C、配制FeCl3溶液时,将FeCl3固体溶解在浓盐酸中,然后再用水稀释到所需的浓度 D、中和热测定实验中,将NaOH溶液分几次缓慢加入盐酸溶液中