相关试卷
-
1、有关Na2O2性质实验如下:
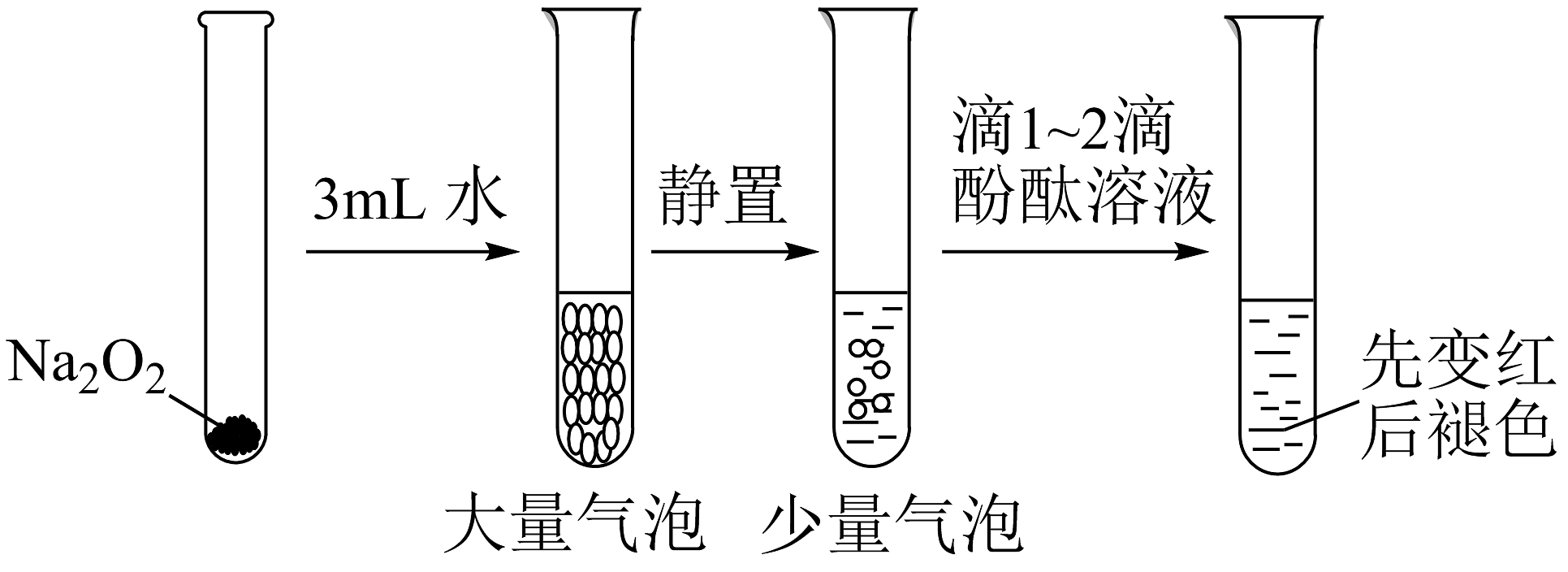
已知:①Na2O2与水反应经历了Na2O2+2H2O =2NaOH+H2O2;
②酚酞褪色原因与溶液的强碱性或强氧化性有关。
根据上述实验可以得出的结论是
A、双氧水能使酚酞褪色 B、浓氢氧化钠能使酚酞褪色 C、双氧水和浓氢氧化钠都能使酚酞褪色 D、可利用二氧化锰和水来完善实验方案 -
2、化学小组研究金属的电化学腐蚀,实验如下:
序号
实验Ⅰ
实验Ⅱ
实验


现象
铁钉周边出现_________色
锌片周边未见明显变化
铁钉周边出现蓝色
铜片周边略显红色
下列说法不正确的是
A、实验Ⅰ中铁钉周边出现红色 B、实验I中负极的电极反应式: C、实验Ⅱ中正极的电极反应式: D、对比实验I、Ⅱ可知,生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀 -
3、利用超分子可分离和 , 将、混合物加入一种空腔大小适配的“杯酚”中进行分离的流程如图。下列说法正确的是
 A、一个分子中含有90个键 B、“杯酚”与形成氢键 C、一个晶胞中含有8个分子 D、该分离过程利用的是超分子的自组装特征
A、一个分子中含有90个键 B、“杯酚”与形成氢键 C、一个晶胞中含有8个分子 D、该分离过程利用的是超分子的自组装特征 -
4、化学与生活、社会发展息息相关,下列化学知识解读不正确的是
选项
(劳动项目)
化学知识解读
A.
疫情期间常使用“84”消毒液进行消毒
“84”消毒液具有强氧化性
B.
焙制面包时使用碳酸氢钠
碳酸氢钠受热易分解
C.
用盐酸刻蚀鸡蛋壳制作艺术品
发生氧化还原反应
D.
使用明矾净水
胶体具有吸附性
A、A B、B C、C D、D -
5、在密闭容器中进行反应:X(g)+3Y(g)═2Z(g),有关下列图像的说法错误的是
 A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应速率变化图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH<0
A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应速率变化图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH<0 -
6、、、分别表示化学平衡常数、电离常数和水的离子积常数。下列说法正确的是A、达平衡后,改变某一条件时不变,的平衡转化率可能增大、减小或不变 B、在、条件下,在密闭容器中进行合成氨的反应,使用催化剂后增大 C、室温下 , 说明的酸性比的强 D、时,均为4的盐酸和醋酸溶液中不相等
-
7、在我国空间站的太空课堂中,航天员向水球内注入蓝色颜料后,将一颗泡腾片(由碳酸氢钠和有机酸组成的混合物)放进了水球内。水球“沸腾”了!无数气泡在其中产生,逐渐将水球充满,如图所示。下列说法正确的是
 A、泡腾片溶于水只发生物理变化 B、气泡的主要成分是酸性氧化物 C、泡腾片中的碳酸氢钠属于碱类 D、泡腾片溶于水发生分解反应
A、泡腾片溶于水只发生物理变化 B、气泡的主要成分是酸性氧化物 C、泡腾片中的碳酸氢钠属于碱类 D、泡腾片溶于水发生分解反应 -
8、叔丁基氯 与碱溶 液经两步反应 得到叔丁基醇,反应 (CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示:

下列说法正确的是
A、该反应为吸热反应 B、(CH3)3C+比(CH3)3 CCl 稳定 C、第一步反应一定比第二步反应快 D、增大碱的浓度和升高温度均可加快反应速率 -
9、某反应由两步反应A→B→C构成,其反应能量曲线如图所示,下列叙述正确的是
 A、两步反应均为吸热反应 B、三种物质中B最稳定 C、A与C的能量差为 D、A→B的反应不一定需要加热
A、两步反应均为吸热反应 B、三种物质中B最稳定 C、A与C的能量差为 D、A→B的反应不一定需要加热 -
10、滴定法是用于测定溶液中微粒浓度的重要方法。某实验小组利用滴定法测定碘酒中碘的含量。(1)、配制稀碘液:移取10.00mL碘酒,准确配制100mL稀碘液。需要的玻璃仪器有:烧杯、玻璃棒、(从下列图中选择,填选项) 。
A.
 B.
B.  C.
C.  D.
D.  (2)、测定碘含量:每次取25.00mL稀碘液于锥形瓶中,滴加几滴淀粉溶液,加入适量稀后,用浓度为0.1000标准溶液滴定,实验数据如下表所示。
(2)、测定碘含量:每次取25.00mL稀碘液于锥形瓶中,滴加几滴淀粉溶液,加入适量稀后,用浓度为0.1000标准溶液滴定,实验数据如下表所示。序号
溶液的用量/mL
稀碘液的用量/mL
1
21.32
25.00
2
20.02
25.00
3
19.98
25.00
已知:
①第1次实验溶液的用量明显多于后两次,原因可能是
A.盛装标准溶液的滴定管用蒸馏水洗净后,未润洗
B.滴入半滴标准溶液,溶液变色,即判定达滴定终点
C.滴定达终点时发现滴定管尖嘴内有气泡产生
D.滴定终点读取滴定管刻度时,俯视标准液液面
②该碘酒中碘的含量为。(已知)
(3)、借鉴(2)的方法,用图所示的流程测定海带中的碘含量。
①加入发生的离子反应方程式是。
②预测达到滴定终点的实验现象为 , 在实验时却发现溶液变色片刻后,恢复滴定前的颜色。继续滴加 , 溶液变色片刻后再一次恢复原色。
(4)、探究异常现象产生的原因。该学习小组通过设计对照实验,发现空气中的氧气并不能较快地氧化待测液中的。
提出猜想:过量的将生成的重新氧化成碘单质。
验证猜想:将2mL待测液、2滴0.1溶液、2滴淀粉溶液和混合,用溶液滴定,若待测液变为无色后又反复变色,则证明猜想不成立。
提出疑问:什么物质反复氧化碘离子。
寻找证据:按图中的流程,用量改为少量,氧化后的待测液静置半小时,利用氧化还原电势传感器测定滴定过程中电势的变化,待溶液变色后停止滴定,溶液恢复原色后继续滴加至溶液变色,循环往复,得到图所示的曲线。

已知:
ⅰ氧化性物质的电势值高于还原性物质:
ⅱ一定条件下,氧化性物质的浓度越高,电势越高,还原性物质浓度越高,电势越低。
a-b段电势升高的原因是(填化学式)被氧化。由a-b段电势变化的斜率小于b-c段可推测溶液反复变色的原因是。
优化流程:将用氧化后的待测液 , 再进行滴定,到达滴定终点时待测液变色后不会恢复原色。
-
11、利用双极膜电解含有的溶液,使转化成碳燃料,实现了还原流动。电解池如下图所示,双极膜中水电离的和在电场作用下可以向两极迁移。下列说法不正确的是
 A、银网电极与电源负极相连 B、双极膜b侧应该用质子交换膜 C、阴极电极反应为: D、双极膜中有0.1mol 电离,则阳极附近理论上产生0.05mol
A、银网电极与电源负极相连 B、双极膜b侧应该用质子交换膜 C、阴极电极反应为: D、双极膜中有0.1mol 电离,则阳极附近理论上产生0.05mol -
12、价类二维图和实验是学习元素及其化合物的重要方法。下列说法不正确的是
 A、a→f→g→h的每一步转化均需要加入氧化剂 B、通过上图实验装置可制备e,并较长时间保持白色沉淀不变色 C、d可与足量的HI溶液发生复分解反应得到g D、c→a可通过在一定条件下加入CO、Al等还原剂实现
A、a→f→g→h的每一步转化均需要加入氧化剂 B、通过上图实验装置可制备e,并较长时间保持白色沉淀不变色 C、d可与足量的HI溶液发生复分解反应得到g D、c→a可通过在一定条件下加入CO、Al等还原剂实现 -
13、将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是
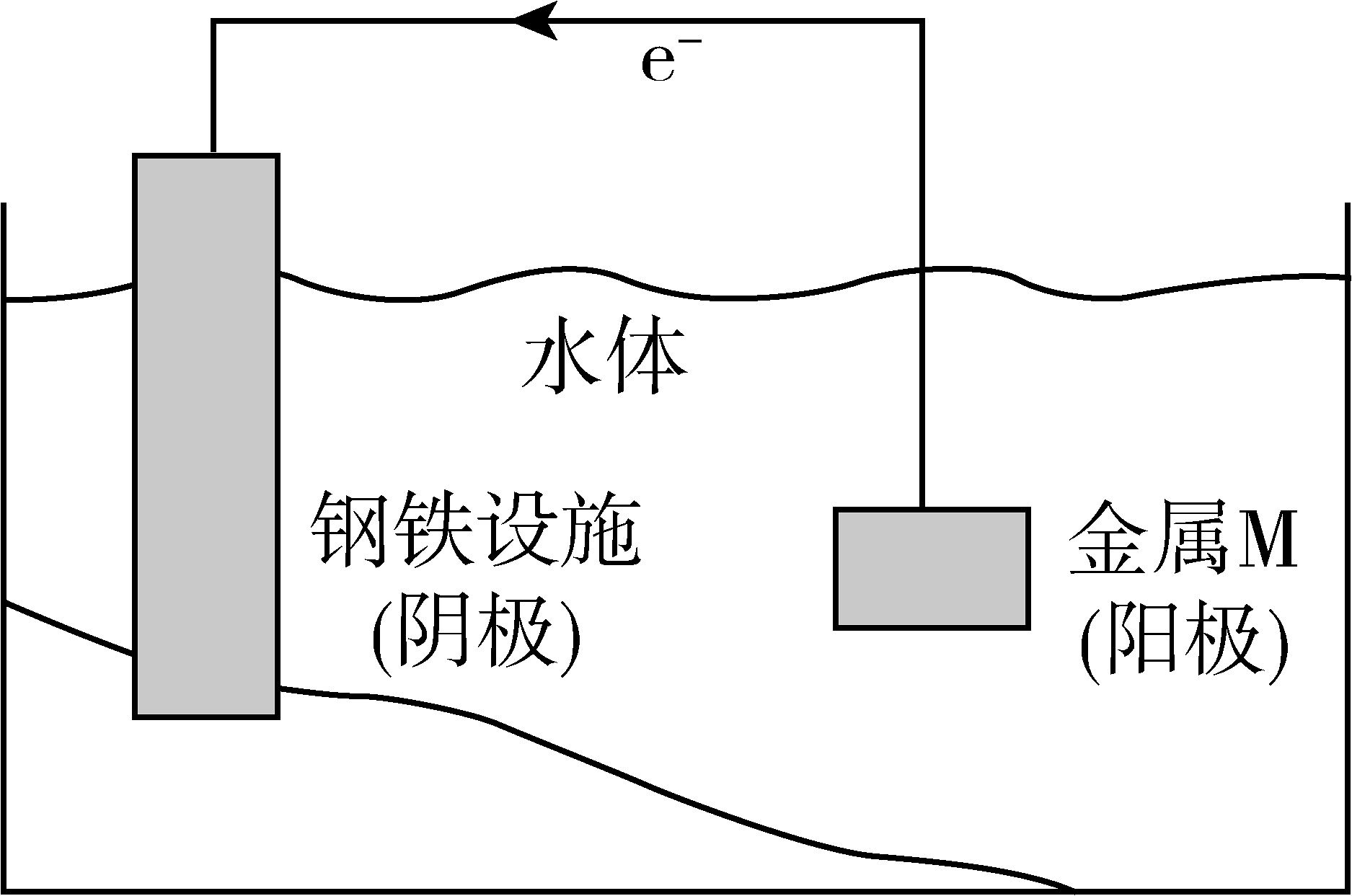 A、阴极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施表面因积累大量电子而被保护 D、钢铁设施在河水中的腐蚀速率比在海水中的快
A、阴极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施表面因积累大量电子而被保护 D、钢铁设施在河水中的腐蚀速率比在海水中的快 -
14、向过氧化钠与水反应后的溶液中滴加2滴酚酞试液,溶液先变红后褪色。为了探究其原因,进行下图三个实验。实验①取反应后溶液加入二氧化锰后迅速产生大量气体,使带火星的木条复燃;实验②溶液变红,且不褪色:实验③通入氧气,溶液红色不褪去。下列说法不正确的是
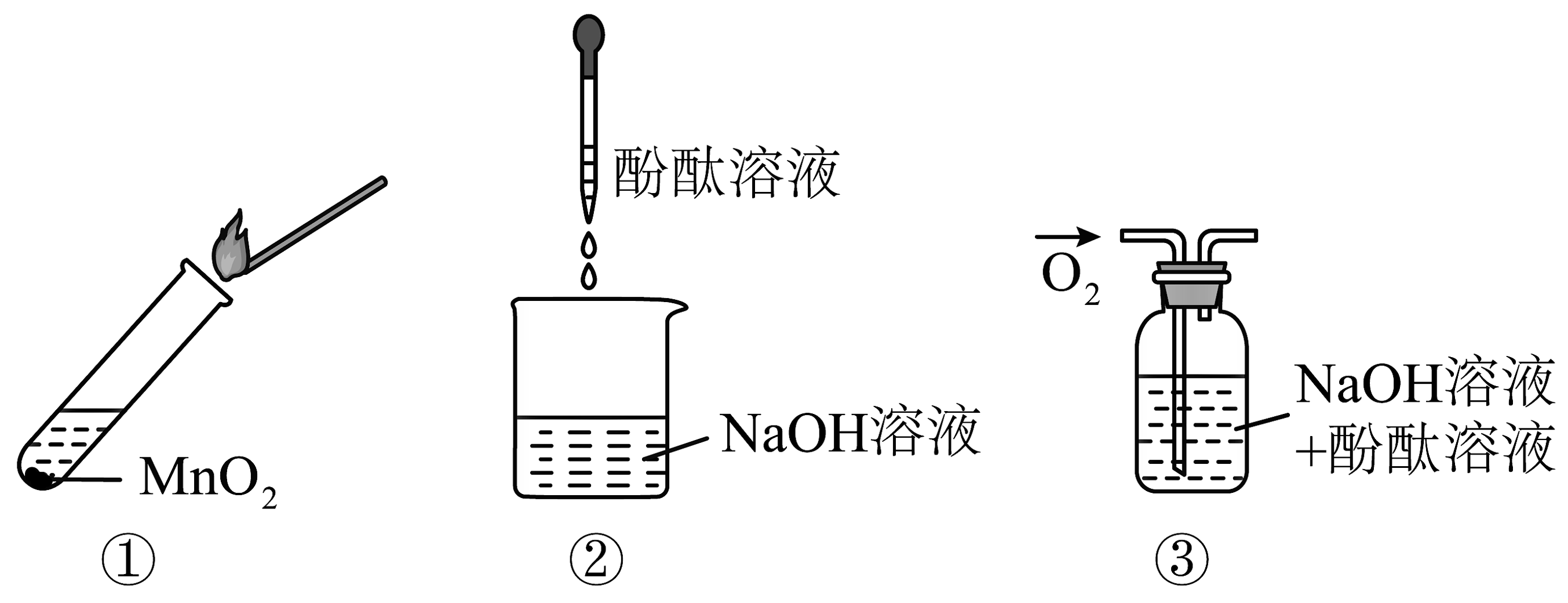 A、实验①中发生的反应是氧化还原反应 B、实验①证明过氧化钠与水反应需要作催化剂 C、实验②③证明使酚酞褪色的不是氢氧化钠和氧气 D、由上述实验可知:过氧化钠与水混合有这个反应发生
A、实验①中发生的反应是氧化还原反应 B、实验①证明过氧化钠与水反应需要作催化剂 C、实验②③证明使酚酞褪色的不是氢氧化钠和氧气 D、由上述实验可知:过氧化钠与水混合有这个反应发生 -
15、针对如图所示的乙醇分子结构,下列说法不正确的是
 A、与乙酸、浓硫酸共热时,②键断裂 B、与钠反应时,①键断裂 C、与浓硫酸共热至170℃时,②、④键断裂 D、在Ag催化下与O2反应时,①、③键断裂
A、与乙酸、浓硫酸共热时,②键断裂 B、与钠反应时,①键断裂 C、与浓硫酸共热至170℃时,②、④键断裂 D、在Ag催化下与O2反应时,①、③键断裂 -
16、下列反应中,只做氧化剂的是A、 B、 C、 D、
-
17、下列物质的应用中,与氧化还原反应无关的是A、用和制取盐酸 B、用生石灰()作干燥剂 C、用铝粉和作管道疏通剂 D、用漂白棉、麻、纸张
-
18、某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如表:
编号
电极材料
电解质溶液
电流表指针偏转方向
1
Mg、Al
稀盐酸
偏向Al
2
Al、Cu
稀盐酸
偏向Cu
3
Al、石墨
稀硝酸
偏向石墨
4
Mg、Al
NaOH溶液
偏向Mg
根据表中记录的实验现象,回答下列问题。
(1)、实验1、2中Al电极的作用是否相同?。(2)、实验3中铝为极,石墨电极反应式为。(3)、实验4中铝为负极,写出铝电极的电极反应式:。 -
19、以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1<0
Ⅱ.CO(g)+2H2(g)=CH3OH(g) ΔH2<0
Ⅲ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3>0
向恒压、密闭容器中通入1molCO2和3molH2发生上述反应,平衡时CH3OH、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是
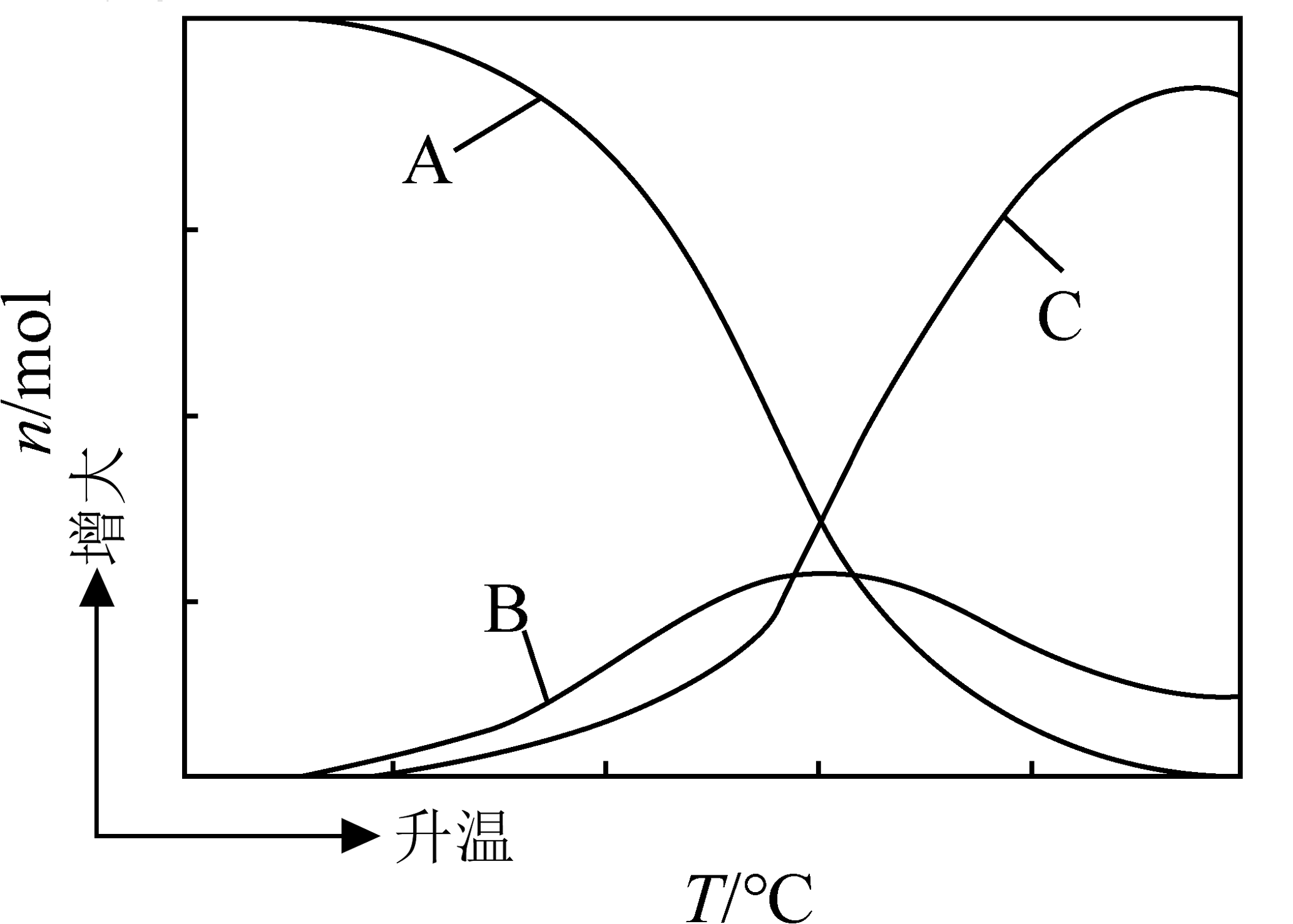 A、反应Ⅰ平衡常数可表示为K= B、图中曲线B表示CO的物质的量随温度的变化 C、某时刻CH3OH(g)为amol,CO为bmol,此时H2O(g)为(a+b)mol D、为提高CH3OH的平衡产率,需要选择低温、低压的反应条件
A、反应Ⅰ平衡常数可表示为K= B、图中曲线B表示CO的物质的量随温度的变化 C、某时刻CH3OH(g)为amol,CO为bmol,此时H2O(g)为(a+b)mol D、为提高CH3OH的平衡产率,需要选择低温、低压的反应条件 -
20、向100 mL NaOH溶液中通入一定量的CO2气体,经充分反应后,再向所获得的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断不正确的是
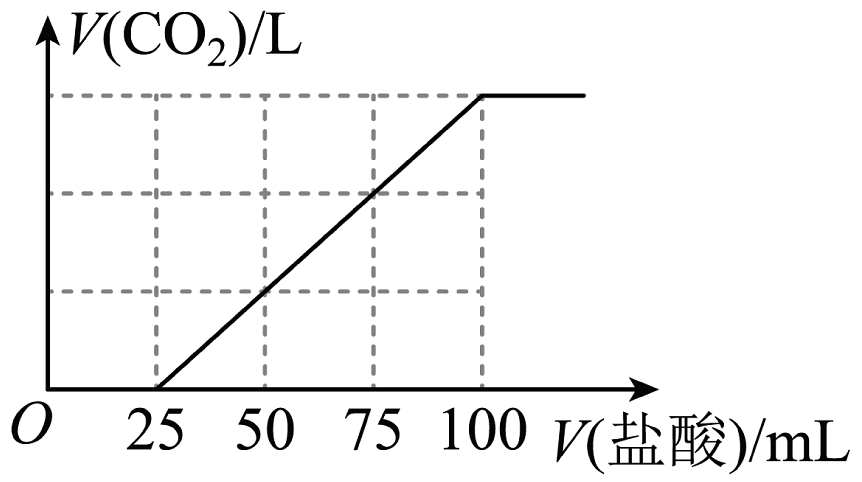 A、原NaOH溶液的物质的量浓度为0.1 mol/L B、通入CO2在标准状况下的体积为224 mL C、V(盐酸)=0~25 mL的范围内发生的离子反应为:+ H+= D、所得溶液的溶质成分为Na2CO3和NaHCO3
A、原NaOH溶液的物质的量浓度为0.1 mol/L B、通入CO2在标准状况下的体积为224 mL C、V(盐酸)=0~25 mL的范围内发生的离子反应为:+ H+= D、所得溶液的溶质成分为Na2CO3和NaHCO3