相关试卷
-
1、化学实验操作是进行科学实验的基础。下列操作符合规范的是


A.碱式滴定管排气泡
B.检查装置气密性


C.过滤
D.溶液的转移
A、A B、B C、C D、D -
2、在一定条件下,和F2可发生如下反应:+F2+2OH-=+2F-+H2O,从而可知在中 ,元素R的化合价、n的值分别是A、+4价 2 B、+5价 1 C、+6价 0 D、+3价 3
-
3、下列关于电解质的叙述正确的是A、溶于水得到的溶液能导电的化合物都是电解质 B、溶液在电流作用下电离成与 C、硫酸溶液的导电性一定比醋酸溶液导电性强 D、氧化镁虽然不溶于水,但是熔融状态下能发生电离,所以氧化镁是电解质
-
4、晶体的一种立方晶胞如图。已知:与O最小间距大于与O最小间距,x、y为整数,两个“○”之间的最短距离为b。下列说法错误的是
 A、x=1,y=3 B、周围最近的O原子数目为12 C、图中体心位置“”一定代表 D、晶体的密度为
A、x=1,y=3 B、周围最近的O原子数目为12 C、图中体心位置“”一定代表 D、晶体的密度为 -
5、一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是。
②a、b、c三点中,C的体积分数最大的是。
③各阶段的平衡常数如下表所示:
t2~t3
t4~t5
t5~t6
K1
K2
K3
K1、K2、K3之间的大小关系为(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g)2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。

(1)△H (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为。
(3)图中M点的平衡常数Kp =MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
-
6、合成氨是人类科学技术发史上的一项重大突破,目前工业上用氢气和氨气直接合成氨。(1)、固氮一直是科学家致力研究的要课题,有关热力学数据如下:
反应
大气固氮
工业固氮
温度/℃
25
2000
25
350
400
450
平衡常数K
0.1
1847
0.504
0.152
常温下,大气固氮的倾向工业固氮(填“大于”或“小于”)。
(2)、与反应的能量变化如图所示,则与反应制备的热化学方程式为:。 (3)、时,在2L的恒容密闭容器中加入和模拟一定条件下工业固氮: , 体系中随时间的变化如图所示;
(3)、时,在2L的恒容密闭容器中加入和模拟一定条件下工业固氮: , 体系中随时间的变化如图所示;
①前2分钟内的平均反应速率。
②有关工业固氮的说法正确的是(选填序号)。
A.使用化剂可提高反应物的转化率
B.循环使用可提高的产率
C.温度控制在左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③时,该反应的平衡常数为。
④该反应达到平衡状态后,再次往容器中加入和 , 达到新的平衡状态时容器中物质的量1.6mol(填“大于”、“小于”或“等于”)。
(4)、研究表明某些过渡金属催化剂可以加快氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:)与催化剂的对应关系如表所示。催化剂
Fe
Pd
Ru
Rh
Pt
Ni
初始速率
0.5
1.8
7.9
4.0
2.2
3.0
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是(填化学式)。
-
7、美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
 (1)、此流程的第Ⅰ步反应为 ,
(1)、此流程的第Ⅰ步反应为 ,①已知键能为断开1mol化学键所需的能量,一些相关化学键的键能如下表:
化学键
键能
436
465
a
1076
则。
②一定条件下的平衡转化率与温度、压强的关系如图所示,则(填“<”、“>”或“=”)。
 (2)、此流程的第Ⅱ步反应为: , 该反应的平衡常数随温度的变化如下所示:
(2)、此流程的第Ⅱ步反应为: , 该反应的平衡常数随温度的变化如下所示:温度/℃
400
500
830
1000
平衡常数K
10
9
1
0.6
从上表可以推断:此反应是(填“吸”“放”)热反应。
(3)、在一个绝热固定容积的密闭容器中,判断此流程的第Ⅱ步反应达到平衡的标志是(填序号)。①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
⑥
(4)、此流程的第Ⅱ步反应在830℃时,某时刻反应混合物中的物质的量浓度分别为 , 则此时反应朝(填“正反应方向”或“逆反应方向”)进行;若的初始浓度均为 , 求该反应达到平衡时CO的转化率。(写出计算过程)。 -
8、
某校化学活动小组做了如下探究实验:
实验一:测定相同体积的1mol/L的硫酸分别与足量锌粒和锌粉反应的速率,设计如图装置:

(1)写出此反应的离子方程式。
(2)根据此实验探究,可以得出的结论是:其他条件不变时,。
实验二:利用溶液和酸性溶液之间的反应,探究外界条件改变对化学反应速率的影响。实验如下表:
序号
温度/K
溶液颜色褪至无色时所需时间/s
V/mL
V/mL
A
293
2
5
3
B
293
3
5
8
C
313
2
3
(3)表中;通过实验可探究的改变对反应速率的影响。
(4)利用实验B中数据计算,用的浓度变化表示的反应速率为。
(5)实验中发现:在开始一段时间内,反应速率较小,溶液褪色不明显;但不久后突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是的影响。若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母)。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
-
9、工业上取SCl2的反应之一为S2Cl2(g)+Cl2(g) 2SCl2(g),一定压强下,向10L密闭容器中充入和1mol S2Cl2和1mol Cl2发生上述反应,SCl2和 Cl2的消耗速率与温度的关系如图所示,下列说法正确的是
 A、该反应的△H>0 B、A点对应的状态为化学平衡状态 C、使用高效催化剂能提高S2Cl2的平衡产率 D、若300℃达平衡时,S2Cl2的转化率为α,则300℃时,该反应的化学平衡常数K=
A、该反应的△H>0 B、A点对应的状态为化学平衡状态 C、使用高效催化剂能提高S2Cl2的平衡产率 D、若300℃达平衡时,S2Cl2的转化率为α,则300℃时,该反应的化学平衡常数K= -
10、乙烯气相直接水合反应制备乙醇:。乙烯的平衡转化率和温度、压强的变化关系如下图[起始时, , 容器体积为]。下列说法错误的是
 A、乙烯气相直接水合反应的 B、图中a点对应的平衡常数 C、图中压强的大小关系为: D、达到平衡状态所需要的时间:
A、乙烯气相直接水合反应的 B、图中a点对应的平衡常数 C、图中压强的大小关系为: D、达到平衡状态所需要的时间: -
11、一定条件下存在反应: 。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
 A、的体积分数:Ⅱ>Ⅲ B、容器Ⅱ、Ⅲ中正反应速率相同 C、容器Ⅰ、Ⅲ中平衡常数相同 D、容器Ⅰ和容器Ⅱ中的体积分数相同
A、的体积分数:Ⅱ>Ⅲ B、容器Ⅱ、Ⅲ中正反应速率相同 C、容器Ⅰ、Ⅲ中平衡常数相同 D、容器Ⅰ和容器Ⅱ中的体积分数相同 -
12、下列平衡移动方向和现象判断正确的是A、 , 加水,平衡逆向移动,溶液黄色变浅 B、 , 加入Fe粉,平衡正向移动,溶液颜色加深 C、 , 压缩容器体积,平衡不移动,气体颜色无变化 D、 , 升温,溶液由蓝色变为黄色
-
13、下列叙述与图对应的是
 A、对于达到平衡状态的反应: , 图①表示在时刻充入了一定量的 , 平衡逆向移动 B、由图②可知,满足反应: C、图③表示的反应方程式为 D、若 , 对于反应 , 图④y轴可以表示Y的百分含量
A、对于达到平衡状态的反应: , 图①表示在时刻充入了一定量的 , 平衡逆向移动 B、由图②可知,满足反应: C、图③表示的反应方程式为 D、若 , 对于反应 , 图④y轴可以表示Y的百分含量 -
14、在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可测定中和反应反应热。下列关于该实验的说法正确的是
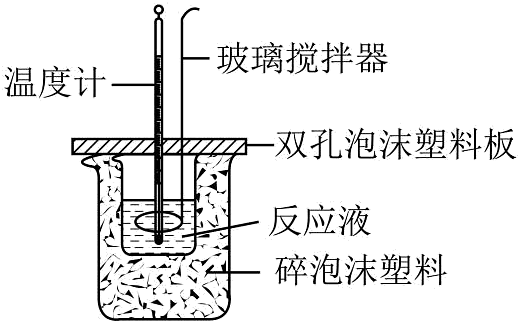 A、由可知,0.5mol稀溶液与稀溶液完全反应,放出热量为57.3kJ B、如果没有玻璃搅拌器,酸碱混合后可用温度计轻轻搅拌 C、完成一次测定实验,温度计需要使用2次,分别用于测混合液的初始温度和反应最高温度 D、烧杯间的碎泡沫塑料的作用是固定烧杯的位置
A、由可知,0.5mol稀溶液与稀溶液完全反应,放出热量为57.3kJ B、如果没有玻璃搅拌器,酸碱混合后可用温度计轻轻搅拌 C、完成一次测定实验,温度计需要使用2次,分别用于测混合液的初始温度和反应最高温度 D、烧杯间的碎泡沫塑料的作用是固定烧杯的位置 -
15、根据下列热化学方程式分析,C(s)的燃烧热△H等于
C(s) + H2O(l) = CO(g) + H2(g) △H1=175.3kJ·mol-1
2CO(g) + O2(g) = 2CO2(g)△H2= —566.0 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H3= —571.6 kJ·mol-1
A、△H1+△H2—△H3 B、2△H1+△H2+△H3 C、△H1+△H2/2 +△H3 D、△H1+△H2/2 +△H3/2 -
16、已知: , 该反应分①、②两步进行,其能量曲线如图所示,下列有关说法正确的是
 A、 B、反应①的活化能比反应②的大,所以总反应的反应速率取决于第①步反应 C、整个反应过程共有3个基元反应 D、增大压强可以提高反应物的活化分子百分数,从而加快反应速率
A、 B、反应①的活化能比反应②的大,所以总反应的反应速率取决于第①步反应 C、整个反应过程共有3个基元反应 D、增大压强可以提高反应物的活化分子百分数,从而加快反应速率 -
17、下列反应一定属于非自发进行的是A、N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol B、CaCO3(s)=CaO(s)+CO2(g) △H=+1921.8kJ/mol C、C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H=-2804kJ/mol D、2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
-
18、我国化学家研究的一种新型光催化剂(碳纳米点/氮化碳)可以利用太阳光高效实现分解水,其原理如图所示。下列说法正确的是
 A、总反应为H2O2=H2+O2 B、水分解过程中,H2O2作催化剂 C、若反应Ⅱ是放热反应,则反应Ⅰ可能是吸热反应也可能是放热反应 D、反应Ⅰ和反应Ⅱ均存在O-H键的断裂
A、总反应为H2O2=H2+O2 B、水分解过程中,H2O2作催化剂 C、若反应Ⅱ是放热反应,则反应Ⅰ可能是吸热反应也可能是放热反应 D、反应Ⅰ和反应Ⅱ均存在O-H键的断裂 -
19、在下列条件下,一定能大量共存的离子组是A、能使酚酞呈红色的溶液:、、、 B、澄清透明溶液:、、、 C、溶液中:、、、 D、与单质反应生成氢气溶液:、、、
-
20、某兴趣小组探究高锰酸钾和氨水的反应,实验如下:
序号
试剂
实验现象
①
2mL溶液+1mL氨水+0.5mL蒸馏水
溶液完全褪色所需时间:③<②<①。
实验均产生棕褐色固体(经检验为),都伴有少量气泡产生(经检验为)。
②
2mL溶液+1mL氨水+0.5mL稀硫酸
③
2mL溶液+1mL氨水+0.5mL溶液
④
2mL溶液+1mL溶液+0.5mL蒸馏水
无明显变化
注:实验中。下列说法不正确的是
A、实验①中发生了反应 B、溶液完全褪色所需时间②<①的主要原因:增大,的氧化性增强 C、对比实验③④可得出,还原性: D、在实验④的试剂中,逐滴加入浓溶液,可观察到溶液褪色