相关试卷
-
1、常温下,溶液中含碳微粒的物质的量百分数与pH的关系如图所示。人体血浆中最重要的缓冲体系是碳酸氢盐,正常人的血液的pH在7.35~7.45,血浆中pH与含碳微粒的关系为:。下列说法正确的是
 A、曲线b表示随溶液pH变化的曲线 B、人体中的血浆和常温下溶液中的均为 C、当血浆中增大时,pH一定增大 D、当血浆的pH=7.2时,则发生酸中毒,此时是的10倍
A、曲线b表示随溶液pH变化的曲线 B、人体中的血浆和常温下溶液中的均为 C、当血浆中增大时,pH一定增大 D、当血浆的pH=7.2时,则发生酸中毒,此时是的10倍 -
2、中科院福建物构所YaobingWang团队首次构建了一种可逆水性Zn—CO2电池,实现了CO2和HCOOH之间的高效可逆转换,其反应原理如图所示:

已知双极膜可将水解离为H+和OH- , 并实现其定向通过。下列说法中错误的是
A、当外电路通过2mol电子时,双极膜中解离水的物质的量为2mol B、CO2转化为HCOOH过程中,多孔Pd电极的电势高于Zn电极的电势 C、充电时,多孔Pd电极的反应式为HCOOH-2e-=CO2+2H+ D、充电过程中,Zn电极需要与外接电源正极相连接 -
3、在容积恒为的密闭容器中通入一定量 , 发生反应 。假设温度不变,体系中各组分浓度随时间(t)的变化如下表。下列说法错误的是
0
20
40
60
80
0.100
0.062
0.048
0.040
0.040
0
0.076
0.104
0.120
0.120
A、0~40s,的平均反应速率为 B、80s时,再充入、各 , 平衡逆向移动 C、升高温度,反应的化学平衡常数增大 D、若压缩容器,达到新平衡后,混合气颜色比原平衡时深 -
4、已知:298 K时,Ksp[Mn(OH)2]>Ksp[Cu(OH)2]。Mn(OH)2和Cu(OH)2在水中的沉淀溶解平衡曲线如图所示(X2+表示Mn2+或Cu2+)。下列说法正确的是
 A、a表示Mn(OH)2在水中的沉淀溶解平衡曲线 B、Ksp[Cu(OH)2]=10-21 C、N点为Mn(OH)2的不饱和溶液 D、向P点溶液中加入NaOH,溶液组成由P点向M点移动
A、a表示Mn(OH)2在水中的沉淀溶解平衡曲线 B、Ksp[Cu(OH)2]=10-21 C、N点为Mn(OH)2的不饱和溶液 D、向P点溶液中加入NaOH,溶液组成由P点向M点移动 -
5、化学用语是学习化学最好的工具(题中所给数据均正确),下列叙述不正确的是A、向二元弱酸H3PO3溶液中滴入足量烧碱溶液:H3PO3+2OH-=2H2O+HPO B、Al2S3只能在干态下制备的原因:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑ C、CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1 D、工业废水中的Pb2+用FeS去除:Pb2++S2-=PbS↓
-
6、下列事实不能用勒夏特列原理解释的是A、对于反应体系 , 给平衡体系增大压强可使颜色变深 B、在溶液中存在如下平衡, , 若向溶液中滴入滴浓硫酸,溶液颜色橙色加深 C、氯水中存在的平衡: , 当加入适当的后,溶液颜色变浅 D、对于反应 , 平衡体系升高温度颜色变深
-
7、设NA为阿伏加德罗常数的值,下列有关叙述正确的是A、25℃,pH=12的NaOH溶液中含有OH-的数目约为0.01NA B、常温下,1LpH=9的CH3COONa溶液中,发生电离的水分子数为1×10-5NA C、在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA D、向1L0.1mol/LCH3COOH溶液中通氨气至中性,NH数目为0.1NA
-
8、可逆反应进行过程中,当其他条件不变时,Z的体积分数与温度、压强的关系如图所示。下列叙述正确的是
 A、达到平衡后,增加Y的量,平衡正向移动 B、达到平衡后,升高温度,平衡正向移动 C、 , 且 D、达到平衡后,加入催化剂,平衡正向移动
A、达到平衡后,增加Y的量,平衡正向移动 B、达到平衡后,升高温度,平衡正向移动 C、 , 且 D、达到平衡后,加入催化剂,平衡正向移动 -
9、下列事实能说明亚硫酸的酸性强于次氯酸的是A、用pH试纸分别测定等浓度亚硫酸溶液和次氯酸溶液的pH B、同温下,等浓度的亚硫酸氢钠和次氯酸钠溶液,次氯酸钠溶液的碱性强 C、用亚硫酸溶液和次氯酸溶液进行导电性实验,次氯酸溶液的导电能力弱 D、将二氧化硫气体通入次氯酸钙溶液中,溶液变浑浊
-
10、对下列图像的解释正确的是


A.向一定体积的氢氧化钡溶液中逐滴加入稀硫酸,混合液导电能力随时间变化的曲线
B.该反应类型属于图中阴影部分


C.光照过程中氯水的随时间变化的曲线(已知:氢离子浓度越大,越小)
D.氯化钠溶液能够导电的示意图
A、A B、B C、C D、D -
11、利用下列装置进行相关实验,能达到实验目的的是
A
B
C
D




比较的热稳定性
除中的杂质
观察钾的焰色试验
沉淀的过滤
A、A B、B C、C D、D -
12、下列有关钠及其化合物的说法正确的是A、电解饱和食盐水可制取金属钠 B、钠着火时使用泡沫灭火器灭火 C、钠燃烧生成氧化钠 D、焰色式验,火焰呈黄色,说明含有钠元素
-
13、2023年9月23日第19届亚运会在杭州盛大开幕!开幕式上主火炬首次使用废碳再生的绿色燃料甲醇 , 从物质类别来看,关于甲醇说法正确的是A、属于有机物 B、属于碱 C、属于氧化物 D、属于混合物
-
14、下列实验操作不合理的是A、
 切割金属钠
B、
切割金属钠
B、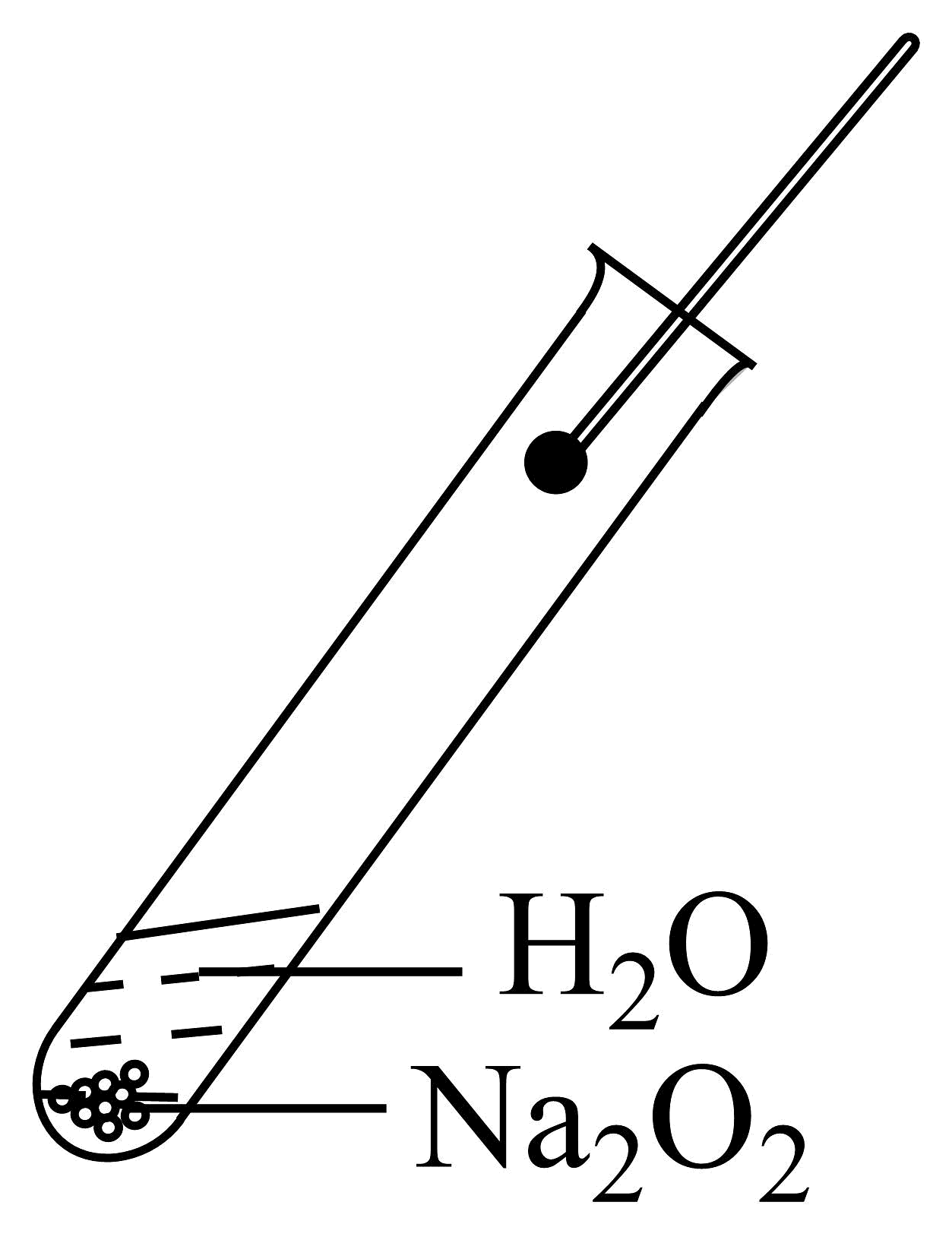 过氧化钠与水反应
C、
过氧化钠与水反应
C、 铜丝在氯气中燃烧
D、
铜丝在氯气中燃烧
D、 收集
收集
-
15、实验室欲配制的溶液.下列操作及误差分析正确的是A、用托盘天平称取固体 B、定容时俯视容量瓶刻度线,所得溶液浓度偏高 C、加水时不慎超过了刻度线,用胶头滴管直接吸出多余液体 D、使用容量瓶时,容量瓶内残留有少量水分,所得溶液浓度偏低
-
16、有机物G的合成流程图如图:


已知:
 (1)、化合物D中官能团的名称 , A生成B的反应类型为。(2)、B与C反应生成D的化学方程式为。(3)、G的核磁共振氢谱共有组吸收峰。(4)、某烃的分子式为 , 能使溴水和酸性溶液褪色,分子结构中所有的碳原子在一个平面上,该有机物的名称(系统命名法);该烃与A(填“是”或“不是”)同系物。(5)、流程中物质B的同分异构体有种(不考虑顺反异构)。
(1)、化合物D中官能团的名称 , A生成B的反应类型为。(2)、B与C反应生成D的化学方程式为。(3)、G的核磁共振氢谱共有组吸收峰。(4)、某烃的分子式为 , 能使溴水和酸性溶液褪色,分子结构中所有的碳原子在一个平面上,该有机物的名称(系统命名法);该烃与A(填“是”或“不是”)同系物。(5)、流程中物质B的同分异构体有种(不考虑顺反异构)。 -
17、科学家预测21世纪中叶将进入“氢能经济”时代,许多化合物或合金都是具有广阔应用前景的储氢材料。(1)、基态Li原子核外电子有种不同的运动状态,占据最高能级电子的电子云轮廓图形状为。(2)、咔唑(
 )的沸点比芴(
)的沸点比芴( )高的主要原因是。 (3)、(氨硼烷,熔点104℃)与(写出一种烃类分子)互为等电子体,中B的杂化轨道类型为。(4)、一种储氢合金的晶胞结构如图所示。在晶胞中Cu原子处于面心,Au原子处于顶点位置。该晶体中,存在的化学键为。实现储氢功能时,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如图),若所有四面体空隙都填满,该晶体储氢后的化学式为。已知该晶胞的晶胞参数为anm,阿伏加德罗常数值为 , 则密度ρ为(用和a的代数式表示)
)高的主要原因是。 (3)、(氨硼烷,熔点104℃)与(写出一种烃类分子)互为等电子体,中B的杂化轨道类型为。(4)、一种储氢合金的晶胞结构如图所示。在晶胞中Cu原子处于面心,Au原子处于顶点位置。该晶体中,存在的化学键为。实现储氢功能时,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如图),若所有四面体空隙都填满,该晶体储氢后的化学式为。已知该晶胞的晶胞参数为anm,阿伏加德罗常数值为 , 则密度ρ为(用和a的代数式表示)
-
18、
实验小组制备 , 并探究其性质。
Ⅰ.制备

(1)仪器a的名称是;气体b是空气的组成成分,其化学式为。
(2)为检验B中制得 , 甲进行以下实验:
序号
试管
操作
现象
①
2mLB中溶液
加2mL0.1mol/LKI溶液,滴加几滴淀粉溶液
不变蓝
②
2mLB中溶液
滴加几滴溶液至pH=5,加2mL0.1mol/LKI溶液,滴加几滴淀粉溶液
变蓝
③
2mL
滴加几滴溶液至pH=5,加2mL0.1mol/LKI溶液,滴加几滴淀粉溶液
不变蓝
乙认为上述3组实验无法证明B中一定含 , 理由是B溶液中可能还有(填离子符号)干扰。
Ⅱ.探究的性质
装置
操作
现象

取10mL1mol/L溶液于试剂瓶中,加入几滴溶液酸化,再加入10mL1mol/L溶液,迅速塞上橡胶塞,缓缓通入足量
ⅰ.溶液迅速变为棕色
ⅱ.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色
ⅲ.最终形成棕褐色溶液
资料:ⅰ.在溶液中呈棕色。
ⅱ.在溶液中不稳定,易分解产生NO和气体。
(3)溶液迅速变为棕色的原因是;现象ⅱ中无色气泡变为浅红棕色的化学方程式是。
(4)最终棕褐色溶液的成分是 , 测得装置中混合溶液体积为20mL,设计如下实验测定其组成。
资料:①充分反应后,全部转化为。
②为无色离子。

加掩蔽剂KF的目的是(掩蔽的颜色除外)。由上述数据可知中x=(用含、的代数式表示)。
-
19、常温下,用的NaOH溶液滴定20.00mL等浓度的某酸HX,滴定曲线如图所示。下列说法正确的是
 A、HX为强酸 B、c点溶液中: C、需用甲基橙作指示剂 D、d点溶液中:
A、HX为强酸 B、c点溶液中: C、需用甲基橙作指示剂 D、d点溶液中: -
20、以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如图。下列说法正确的是
 A、在阳极放电,发生氧化反应 B、装置中的离子交换膜为阴离子交换膜 C、在阴极发生的电极反应为:2H2O+2e-=2OH-+H2↑ D、当电路中有0.4mol电子转移时,标况下产生气体的总体积为4.48L
A、在阳极放电,发生氧化反应 B、装置中的离子交换膜为阴离子交换膜 C、在阴极发生的电极反应为:2H2O+2e-=2OH-+H2↑ D、当电路中有0.4mol电子转移时,标况下产生气体的总体积为4.48L