相关试卷
-
1、已知:
 。
。参照上述合成路线,以丙醛和
 为原料,设计制备
为原料,设计制备 的合成路线。
的合成路线。 -
2、已知:醛在一定条件下可以两分子间反应
 , 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香。由枯茗醛(
, 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香。由枯茗醛( )合成兔耳草醛的路线如下:
)合成兔耳草醛的路线如下: (1)、枯茗醛的核磁共振氢谱有组峰;A→B的反应类型是。(2)、B中含有的官能团是(写结构式);检验B中含氧官能团的试剂是。(3)、写出C→兔耳草醛的化学方程式:。
(1)、枯茗醛的核磁共振氢谱有组峰;A→B的反应类型是。(2)、B中含有的官能团是(写结构式);检验B中含氧官能团的试剂是。(3)、写出C→兔耳草醛的化学方程式:。 -
3、苹果醋是由苹果发酵而成的酸性饮品,具有解毒、降脂、减肥和止泻等功效。苹果酸(A)是这种饮料中的主要酸性物质。已知:在下列有关苹果酸(A)的转化关系中,B能使溴的四氯化碳溶液褪色。回答下列问题:
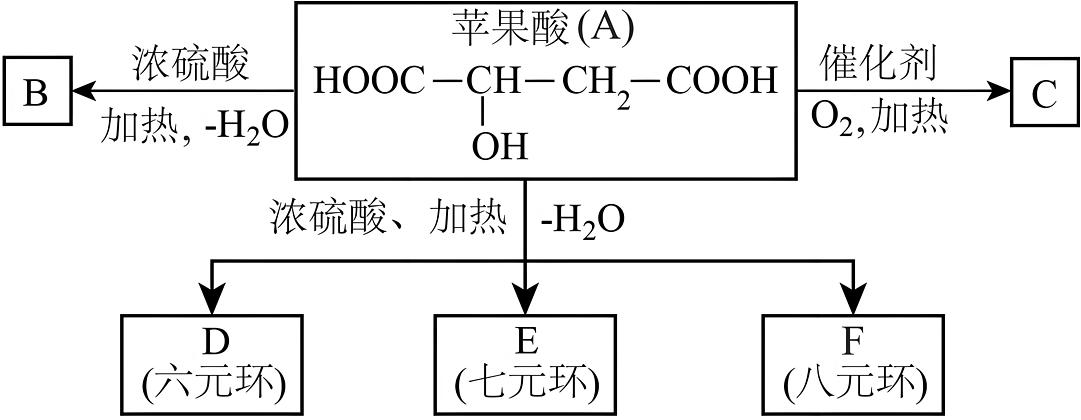 (1)、苹果酸分子中所含官能团的名称是。(2)、苹果酸不能发生的反应有(填序号)。
(1)、苹果酸分子中所含官能团的名称是。(2)、苹果酸不能发生的反应有(填序号)。①加成反应 ②酯化反应 ③加聚反应 ④氧化反应 ⑤消去反应 ⑥取代反应
(3)、B的结构简式:;C的结构简式:;F的分子式:。(4)、写出A→D的化学方程式:。 -
4、1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O,F的结构简式为
 。该烃A在不同条件下能发生如下所示的一系列变化:
。该烃A在不同条件下能发生如下所示的一系列变化:
(1)A的化学式 , A的结构简式。
(2)上述反应中,①是反应,⑦是反应(填反应类型)。
(3)写出下列物质的结构简式:
C , D , E , H。
(4)写出D→F反应的化学方程式:。
-
5、1,4-环己二醇可通过下图所示路线合成(某些反应的反应物和反应条件未标出):
 (1)、A的结构简式是。(2)、写出反应④、⑦的化学方程式。
(1)、A的结构简式是。(2)、写出反应④、⑦的化学方程式。反应④:。
反应⑦:。
(3)、属于取代反应的是 , 属于加成反应的是。(填序号)(4)、环己烷的二氯取代产物有种。 -
6、我国自主研发对二甲苯的绿色合成路线如下图所示,有关说法不正确的是
 A、过程①发生了加成反应 B、过程②有C-H键、C-O键、C-C键的断裂和形成 C、该反应的副产物可能有间二甲苯 D、M的结构简式为
A、过程①发生了加成反应 B、过程②有C-H键、C-O键、C-C键的断裂和形成 C、该反应的副产物可能有间二甲苯 D、M的结构简式为
-
7、化合物(如图)是一种重要的材料中间体,下列有关化合物的说法中正确的是
 A、分子中含有三种官能团 B、可与乙醇、乙酸反应 C、所有碳原子一定处于同一平面 D、可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
A、分子中含有三种官能团 B、可与乙醇、乙酸反应 C、所有碳原子一定处于同一平面 D、可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 -
8、格氏试剂(RMgX)与醛、酮反应是制备醇的重要途径。Z的一种制备方法如下:

下列说法不正确的是
A、中碳负离子的杂化轨道类型为 B、Y分子与Z分子中均含有手性碳原子 C、Z易溶于水是因为Z分子与水分子之间能形成氢键 D、以、和水为原料也可制得Z -
9、某二元醇的键线式为
 , 下列关于该有机物的说法不正确的是 A、系统命名:5-甲基-2,5-庚二醇 B、该有机物可通过催化氧化得到含有酮羰基官能团的物质 C、1mol该有机物能与足量金属反应产生22.4L D、该有机物通过消去反应能得到6种不同结构的二烯烃(不包括立体异构)
, 下列关于该有机物的说法不正确的是 A、系统命名:5-甲基-2,5-庚二醇 B、该有机物可通过催化氧化得到含有酮羰基官能团的物质 C、1mol该有机物能与足量金属反应产生22.4L D、该有机物通过消去反应能得到6种不同结构的二烯烃(不包括立体异构) -
10、对下列装置或操作描述正确的是
A
B
C
D




用于实验室制乙烯
用于实验室制乙炔并检验乙炔
探究乙醇的还原性
A为醋酸,B为碳酸钙,C为苯酚钠溶液,则可验证酸性:醋酸>碳酸>苯酚
A、A B、B C、C D、D -
11、下列卤代烃在KOH醇溶液中加热不发生消去反应的是
①
 ②
② ③(CH3)3CCH2Cl④CHCl2-CHBr2⑤
③(CH3)3CCH2Cl④CHCl2-CHBr2⑤ ⑥CH3ClA、①③⑥ B、②③⑤ C、全部 D、②④
⑥CH3ClA、①③⑥ B、②③⑤ C、全部 D、②④ -
12、工业上可由乙苯生产苯乙烯:
 , 下列说法正确的是 A、可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯 B、乙苯的一氯代物共有3种 C、该反应的反应类型为消去反应 D、苯乙烯分子内共平面的碳原子数最多为7个
, 下列说法正确的是 A、可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯 B、乙苯的一氯代物共有3种 C、该反应的反应类型为消去反应 D、苯乙烯分子内共平面的碳原子数最多为7个 -
13、某烃的一种同分异构体在核磁共振氢谱中出现一组峰,该烃的分子式可以是A、C3H8 B、C4H10 C、C5H12 D、C6H14
-
14、下列有机物的系统命名正确的是A、 2-乙基-1-丁烯 B、 1,4-二甲基丁烷 C、 2-二氯丙烷 D、 2-甲基-3-丙醇
-
15、下列化学用语表示正确的是A、乙炔的空间填充模型:
 B、羟基的电子式:
B、羟基的电子式: C、乙醇的分子式:C2H5OH
D、聚丙烯的结构简式:
C、乙醇的分子式:C2H5OH
D、聚丙烯的结构简式:
-
16、下列各组有机化合物与所含官能团对应正确的是A、甲醇(羧基) B、苯(碳碳双键) C、乙酸(醛基) D、丁烯(碳碳双键)
-
17、化学与科技、社会、生产、生活等关系密切,下列有关说法不正确的是A、冬天汽车所用的防冻液主要成分为乙二醇 B、病毒可用75%乙醇、次氯酸钠溶液、过氧乙酸()进行消毒,其消毒原理相同 C、被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 D、35%-40%的甲醛溶液俗称为福尔马林,用于浸泡生物标本
-
18、化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3 , 进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:

回答下列问题:
(1)、从A~E中选择合适的仪器制备NaHCO3 , 正确的连接顺序是(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或。A.
 B.
B. C.
C. D.
D. E.
E. (2)、B中使用雾化装置的优点是。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
(2)、B中使用雾化装置的优点是。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14 g,则固体NaHCO3的质量为g。
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。

-
19、某校化学实验兴趣小组为了验证在实验室制备的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置。

已知:易溶于 , 而HCl不溶于。
请回答下列问题:
(1)、装置A中发生反应的离子方程式为。(2)、装置B中盛放的试剂为 , 作用是。(3)、装置D和E中出现的不同现象说明。(4)、装置F的作用是。(5)、写出装置G中发生的主要反应的离子方程式:。(6)、乙同学认为甲同学的实验有缺陷,不能确保最终通入溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在与之间(填装置字母序号),装置中应放入。A.湿润的淀粉-KI试纸 B.浓硫酸 C.湿润的红色布条 D.饱和食盐水
-
20、
离子反应广泛用于化学研究、工业生产、物质检验、环境保护等方面
I.通过海水晒盐可得粗盐,粗盐除外,还含有以及泥沙等杂质,如图是制备精盐的实验方案,各步操作流程如图:
 (1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是________。(填序号)
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是________。(填序号)A.搅拌防止液体飞溅 B.引流 C.搅拌加速溶解
(2)在第④步操作的目的是除去粗盐中的________。(3)要证明饱和溶液中含 , 可采用的方法是________。Ⅱ.实验室中有一瓶无色透明未知溶液,可能大量存在中的几种,请填写下列空白:
(4)不做任何实验就可以肯定原溶液中不存在的离子是________。(5)取少量原溶液,加入过量的稀盐酸,有白色沉淀生成,再加入过量的稀硝酸,沉淀不消失。说明原溶液中存在的离子是________。(6)取(5)中的滤液,加入过量的稀氨水,出现白色沉淀,说明原溶液中存在的离子是________有关离子方程式为________。(7)原溶液可能大量存在的阴离子是下列的_______。A. Cl- B. C. D. OH-