相关试卷
-
1、催化还原NO是重要的烟气脱硝技术,反应过程与能量关系如图1所示。研究发现,在以为主的催化剂上可能发生的反应过程如图2所示。下列说法正确的是
 A、催化还原NO为吸热反应 B、过程Ⅱ中NO为氧化剂 C、过程I中断裂离子键 D、图2脱硝的总反应为:
A、催化还原NO为吸热反应 B、过程Ⅱ中NO为氧化剂 C、过程I中断裂离子键 D、图2脱硝的总反应为: -
2、下列有关电化学实验装置的说法正确的是( )
 A、用装置甲组装铜锌原电池 B、用图乙所示装置可实现反应:Cu+2H2OCu(OH)2+H2↑ C、用图丙装置可制得消毒剂NaClO同时减少Cl2的逸出 D、用图丁装置可验证铁钉发生了析氢腐蚀
A、用装置甲组装铜锌原电池 B、用图乙所示装置可实现反应:Cu+2H2OCu(OH)2+H2↑ C、用图丙装置可制得消毒剂NaClO同时减少Cl2的逸出 D、用图丁装置可验证铁钉发生了析氢腐蚀 -
3、已知:的的。一定温度下,下列溶液中的离子浓度关系式正确的是A、溶液中: B、溶液中: C、的溶液中: D、相同的①、②KOH、③KClO三种溶液中的:②>③>①
-
4、室温下,根据下列实验过程及现象,能验证相应实验结论的是
选项
实验过程及现象
实验结论
A
用试纸分别测定浓度均为溶液和溶液 , 溶液大
结合能力:
B
向溶液中滴加几滴溴水,振荡,产生淡黄色沉淀
还原性:
C
向2mL浓度均为的和混合溶液中滴加少量溶液,振荡,产生白色沉淀
溶度积常数:
D
用溶液分别中和等体积的溶液和溶液,消耗的NaOH溶液多
酸性:
A、A B、B C、C D、D -
5、下列说法正确的是A、向溶液中加入少量NaOH固体,溶液pH减小 B、时,的溶液中,由水电离出的 C、在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源正极相连 D、标准状况下,将和置于密闭容器中充分反应生成 , 放热15.2kJ,则其热化学方程式为:
-
6、下列反应的方程式或工业生产流程正确的是A、亚硫酸的电离方程式: B、钢铁吸氧腐蚀负极的电极反应式: C、由铝土矿冶炼铝:铝土矿 D、由重晶石制可溶性钡盐:重晶石(
-
7、时,在含有大量的饱和溶液中存在着平衡 , 加入KI溶液,下列说法正确的是A、溶液中和浓度都增大 B、溶度积常数减小 C、沉淀溶解平衡逆向移动 D、溶液中浓度不变
-
8、电催化氮气制备铵盐和硝酸盐的原理如图所示。下列说法正确的是
 A、a极反应式为: B、电解一段时间,两电极区的pH均减小 C、电解过程中从b极通过质子交换膜转移至a极 D、相同时间内,a、b两极消耗的物质的量之比为5:3
A、a极反应式为: B、电解一段时间,两电极区的pH均减小 C、电解过程中从b极通过质子交换膜转移至a极 D、相同时间内,a、b两极消耗的物质的量之比为5:3 -
9、下列说法不正确的是A、铵态氮肥与草木灰不宜混合施用 B、加热蒸干溶液可以得到固体 C、实验室中盛放溶液的试剂瓶不能用磨口玻璃塞 D、配制溶液时,将固体溶解在硫酸中,再用水稀释到所需的浓度
-
10、室温下,下列各组离子在指定溶液中一定能大量共存的是A、能使甲基橙变红的溶液中:、 B、的溶液中: C、滴入酚酞变红色的溶液: D、水电离出的的溶液:
-
11、下列事实可证明是弱碱的是A、氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B、铵盐受热易分解,放出氨气 C、室温下,氨水溶液的pH为10 D、室温下,氨水可以使酚酞试液变红
-
12、下列物质的分类组合全部正确的是
选项
强电解质
弱电解质
非电解质
A
NaCl
B
HCl
C
Cu
D
NaOH
A、A B、B C、C D、D -
13、
NO的治理是当前生态环境保护中的重要课题之一。
I.电化学技术
(1)利用固体氧化物电解池可将NO直接转化为N2.电解时,如图所示电化学还原器中,阴极发生的电极反应式为。
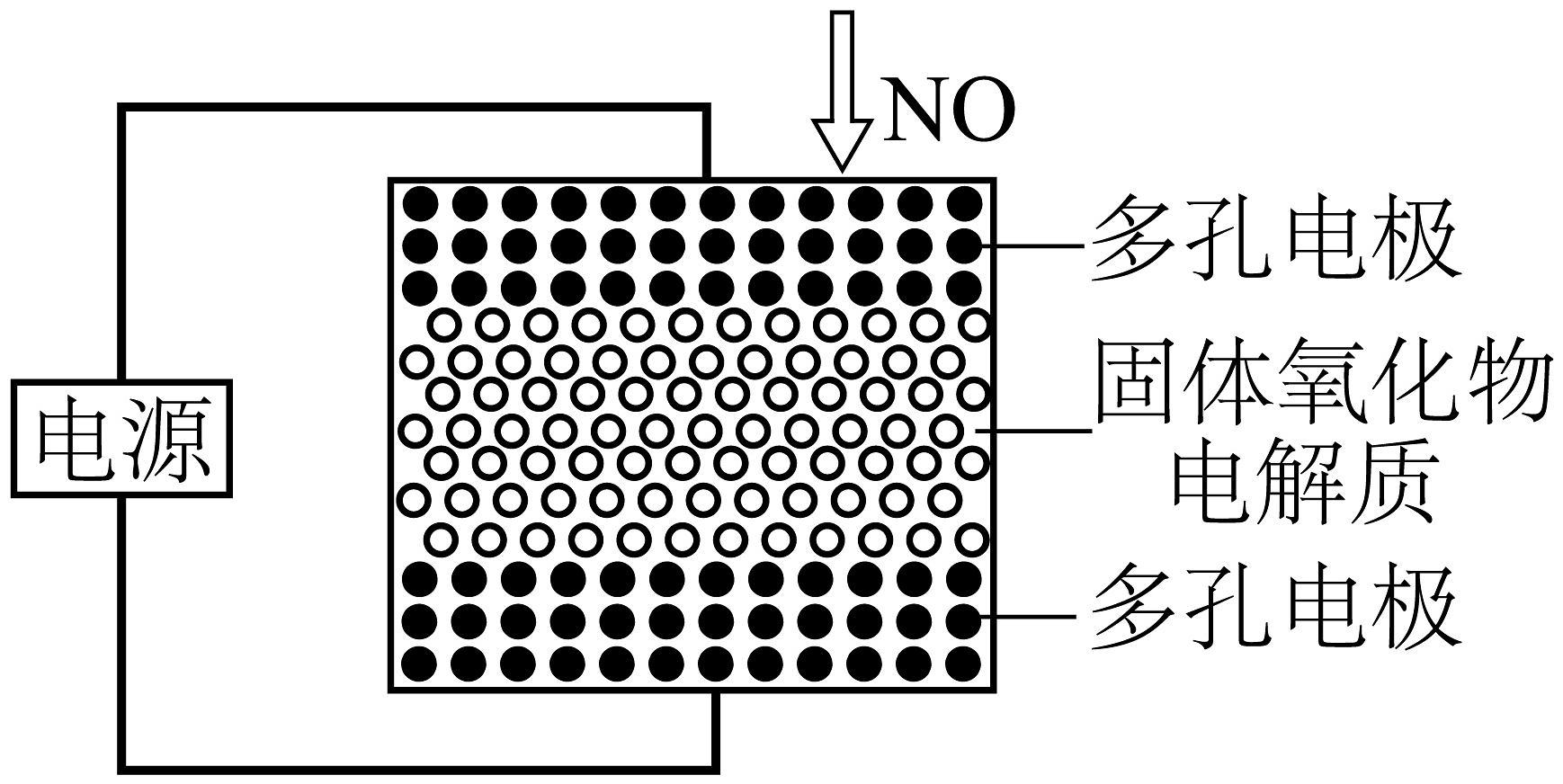
Ⅱ.NH3-SCR技术
(2)Cu基催化剂是NH3-SCR技术脱除NO中性能较为优异的新型催化剂,但烟气中的SO2会造成Cu基催化剂的催化性能下降。加入CeO2(基态Ce原子核外电子排布式为[Xe]4f15d16s2)可抑制SO2对Cu基催化剂的影响,其作用机理如图所示(含Ce化合物的比例系数均未标定)。

①从整个反应机理来看,总反应中起还原作用的物质是(填化学式)。
②在上述反应机理图中,CemOn的化学式为。
(3)将3%NO、6%NH3、21%O2和70%N2的混合气体(N2为平衡气)以一定流速通过装有Cu基催化剂的反应器,NO去除率随反应温度的变化曲线如图所示。

①在150~300℃范围内,随着温度的升高,NO去除率先迅速上升后缓慢上升的主要原因是。
②燃煤烟气中伴有一定浓度的HCl气体,它会造成NO去除率下降,其原因可能是。
-
14、水合肼(N2H4·H2O)易溶于水,有强还原性,一般被氧化为N2 , 处理碱性银氨{[Ag(NH3)2]}溶液获得超细银粉的工艺流程如下:
 (1)、合成水合肼:如图所示,将NaOH溶液与NaClO、CO(NH2)2溶液中的一种配成混合溶液,加入到三颈烧瓶中,40℃下通过滴液漏斗缓慢滴加另一种溶液,反应一段时间后,再迅速升温至110℃继续反应。
(1)、合成水合肼:如图所示,将NaOH溶液与NaClO、CO(NH2)2溶液中的一种配成混合溶液,加入到三颈烧瓶中,40℃下通过滴液漏斗缓慢滴加另一种溶液,反应一段时间后,再迅速升温至110℃继续反应。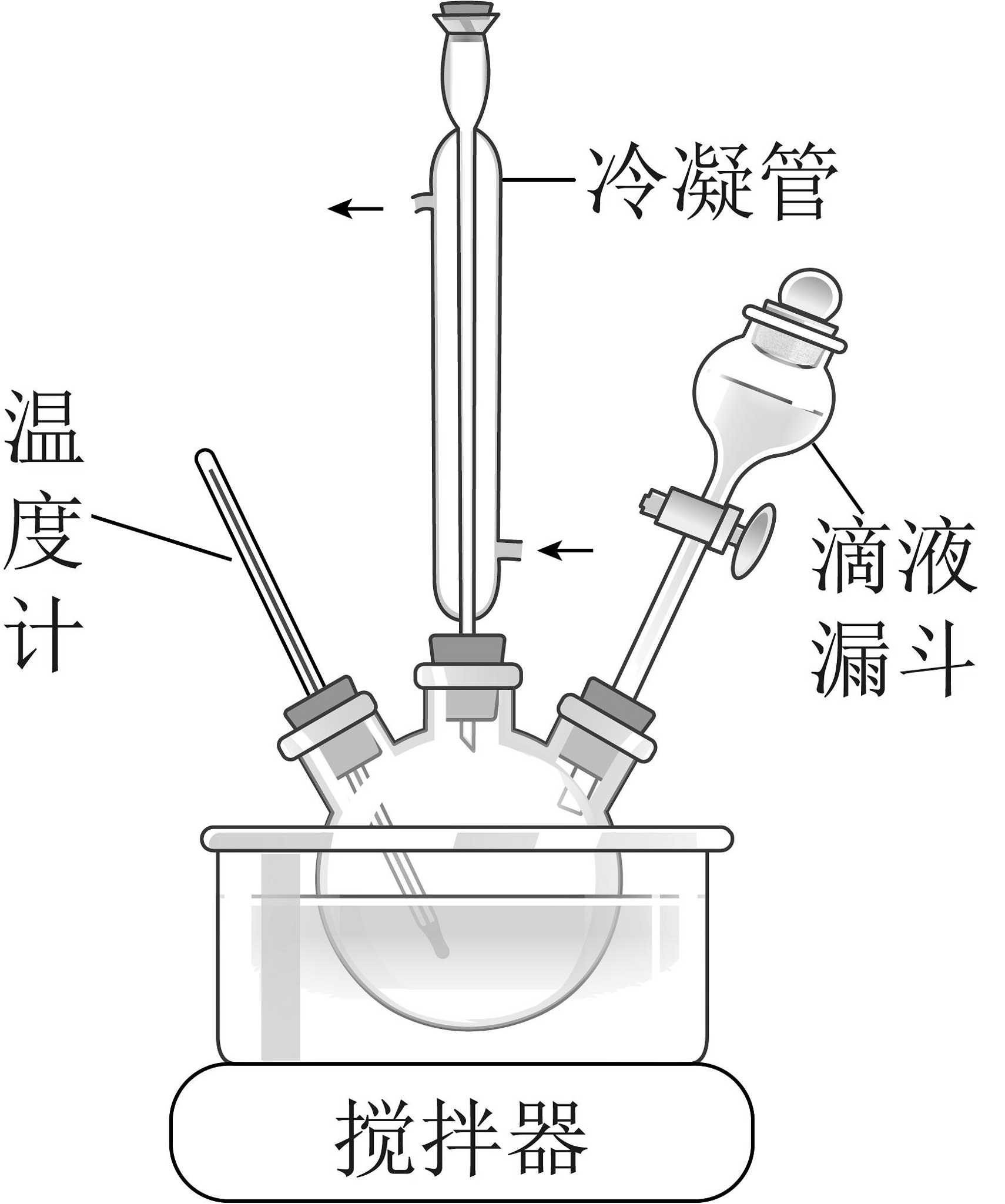
①滴液漏斗中的溶液是。
②反应I制备水合肼的化学方程式为。
(2)、实验室中配制一定体积的银氨溶液的方法为(须使用的试剂:2%的稀氨水、2%的硝酸银溶液)。(3)、制备超细银粉:在水合肼溶液中逐滴加入新制的银氨溶液,控制20℃充分反应,可制得超细银粉。水合肼直接与AgNO3溶液反应也能生成Ag,用银氨溶液代替AgNO3溶液的原因是。(4)、通过如下步骤测定超细银粉样品中Ag的质量分数(杂质不参与反应)。①称取超细银粉样品2.500g,加适量稀硝酸充分溶解、过滤、洗涤,将滤液和洗涤滤液合并定容到250mL容量瓶中。
②准确量取25.00mL溶液置于锥形瓶中,酸化后滴入几滴NH4Fe(SO4)2溶液作指示剂,再用0.1000mol/LNH4SCN标准溶液滴定。滴定终点的实验现象为。
③重复②的操作3次,所用NH4SCN标准溶液的平均体积为23.00mL。
已知:Ag++SCN-=AgSCN↓(白色),则样品中银的质量分数为(写出计算过程)。
-
15、化合物G是合成氢化橙酮衍生物的中间体,其人工合成路线如下:
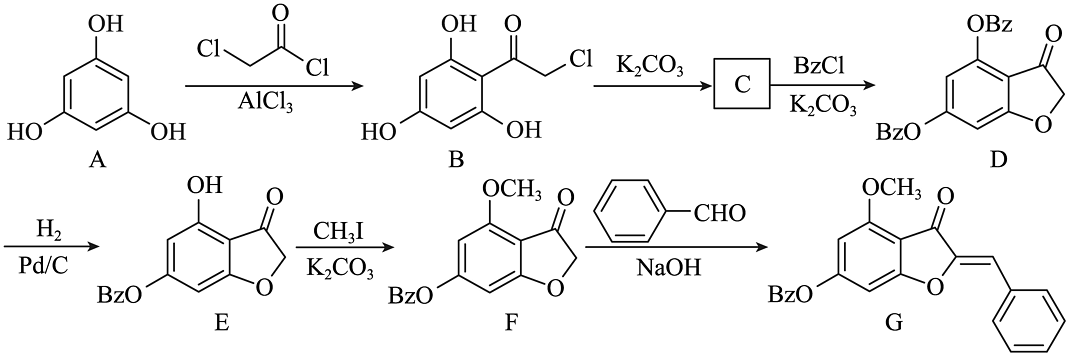
注:-Bz为苯甲酰基,结构式为
 (1)、B中含氧官能团的名称为。(2)、E→F的反应类型为。(3)、C的结构简式为。(4)、D的一种同分异构体同时满足下列条件,该同分异构体的结构简式为。
(1)、B中含氧官能团的名称为。(2)、E→F的反应类型为。(3)、C的结构简式为。(4)、D的一种同分异构体同时满足下列条件,该同分异构体的结构简式为。①分子中不同化学环境的氢原子数目比为2:2:2:1.
②碱性条件下水解,酸化后得2种产物,其中一种产物分子只含一种含氧官能团,另一种产物含有2种含氧官能团且能与FeCl3发生显色反应。
(5)、写出以 、
、 、CH3I为原料制备
、CH3I为原料制备 的合成路线流程图(无机试剂任用,合成路线示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线示例见本题题干)。 -
16、我国学者分别使用Fe2O3和Fe3O4作催化剂对燃煤烟气脱硝脱硫进行了研究。(1)、催化剂制备。在60~100℃条件下,向足量NaOH溶液中通入N2一段时间,再加入适量新制FeSO4溶液,充分反应后得到混合物X;向混合物X中加入NaNO3溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得Fe3O4催化剂。
①通入N2的目的是。
②混合物X与NaNO3反应生成Fe3O4和NH3 , 该反应的化学方程式为。
(2)、催化剂性能研究。如图1所示,当其他条件一定时,分别在无催化剂、Fe2O3作催化剂、Fe3O4作催化剂的条件下,测定H2O2浓度对模拟烟气(含一定比例的NO、SO2、O2、N2)中NO和SO2脱除率的影响,NO脱除率与H2O2浓度的关系如图2所示。
已知•OH能将NO、SO2氧化。•OH产生机理如下。
反应Ⅰ:Fe3++H2O2=Fe2++•OOH+H+(慢反应)
反应Ⅱ:Fe2++H2O2=Fe3++•OH+OH-(快反应)
①与Fe2O3作催化剂相比,相同条件下Fe3O4作催化剂时NO脱除率更高,其原因是。
②NO部分被氧化成NO2。NO2被NaOH溶液吸收生成两种含氧酸钠盐,该反应的离子方程式为。
③实验表明•OH氧化SO2的速率比氧化NO速率慢。但在无催化剂、Fe2O3作催化剂、Fe3O4作催化剂的条件下,测得SO2脱除率几乎均为100%的原因是。
-
17、和联合重整能减少温室气体的排放。重整时发生如下反应:
反应I:
反应Ⅱ:
其他条件相同,投料比为时,和的平衡转化率与温度变化关系如图所示,下列说法不正确的是
 A、其他条件不变,投料比为 , 则平衡时转化率一定高于 B、一定条件下,使用高效催化剂可以提高单位时间内氢气的产量 C、始终低于1.0,是因为发生了反应Ⅱ D、其他条件不变, , 升高温度更有利于反应Ⅱ进行
A、其他条件不变,投料比为 , 则平衡时转化率一定高于 B、一定条件下,使用高效催化剂可以提高单位时间内氢气的产量 C、始终低于1.0,是因为发生了反应Ⅱ D、其他条件不变, , 升高温度更有利于反应Ⅱ进行 -
18、室温下,Ka1(H2C2O4)=5.4×10-2 , Ka2(H2C2O4)=5.4×10-5 , Ksp(CaC2O4)=2.4×10-9.某小组进行如下实验:
实验I:向20mL0.1mol/LNaHC2O4溶液中滴加0.1mol/LNaOH溶液。
实验II:向20mL0.1mol/LNaHC2O4溶液中滴加0.1mol/LCaCl2溶液。
若溶液混合后体积变化忽略不计,下列说法正确的是
A、实验I可选用甲基橙作指示剂,指示反应终点 B、实验I中V(NaOH)=10mL时,存在c(C2O)<c(HC2O) C、实验II中发生反应+Ca2+=CaC2O4↓+H+ D、实验II中V(CaCl2)=80mL时,溶液中c(C2O)=4.0×10-8mol/L -
19、常温下,根据下列实验操作和现象得出的解释或结论正确的是
选项
实验操作和现象
解释或结论
A
将少量铜粉加入稀硫酸中,无明显现象,再加入Fe(NO3)3溶液,铜粉溶解
Fe3+将铜粉氧化
B
用蒸馏水溶解CuCl2固体,并继续加水稀释,溶液由绿色逐渐变为蓝色
[CuCl4]2-+4H2O[Cu(H2O)4]2++4Cl-正向移动
C
用pH计分别测NaClO溶液和CH3COONa溶液的pH,前者pH大于后者
酸性:CH3COOH>HClO
D
取2mL某卤代烃样品于试管中,加入5mL20%KOH溶液并加热,冷却后滴加AgNO3溶液,产生白色沉淀
该卤代烃中含有氯元素
A、A B、B C、C D、D -
20、一种用于污水净化和海水淡化的微生物电池如图所示。下列说法正确的是
 A、a电极作原电池的正极 B、处理后的含硝酸根废水pH降低 C、左室发生反应的电极反应为C6H12O6-24e-+6H2O=6CO2↑+24H+ D、电池工作时,中间室的Cl-移向右室,Na+移向左室,实现海水淡化
A、a电极作原电池的正极 B、处理后的含硝酸根废水pH降低 C、左室发生反应的电极反应为C6H12O6-24e-+6H2O=6CO2↑+24H+ D、电池工作时,中间室的Cl-移向右室,Na+移向左室,实现海水淡化