相关试卷
-
1、现有下列10种物质:①钠 ②冰醋酸 ③氨气 ④浓盐酸 ⑤NaOH溶液 ⑥KClO3固体 ⑦熔融的 ⑧固体 ⑨高锰酸钾粉末 ⑩氢氧化铁胶体。回答下列问题:(1)、上述物质中能导电的电解质有(填序号,下同);属于非电解质的有。(2)、⑧与⑤在溶液中反应的离子方程式为。(3)、④和⑨混合发生反应,该反应的方程式为:
其中氧化剂与还原剂的个数比为 , 盐酸表现的性质为。
(4)、写出制备⑩的化学方程式。(5)、写出用⑤制备84消毒液的离子方程式。 -
2、水垢的主要成分是 , 某同学为测定水垢中的质量分数,称取了水垢,设计如图所示装置进行实验。下列说法错误的是
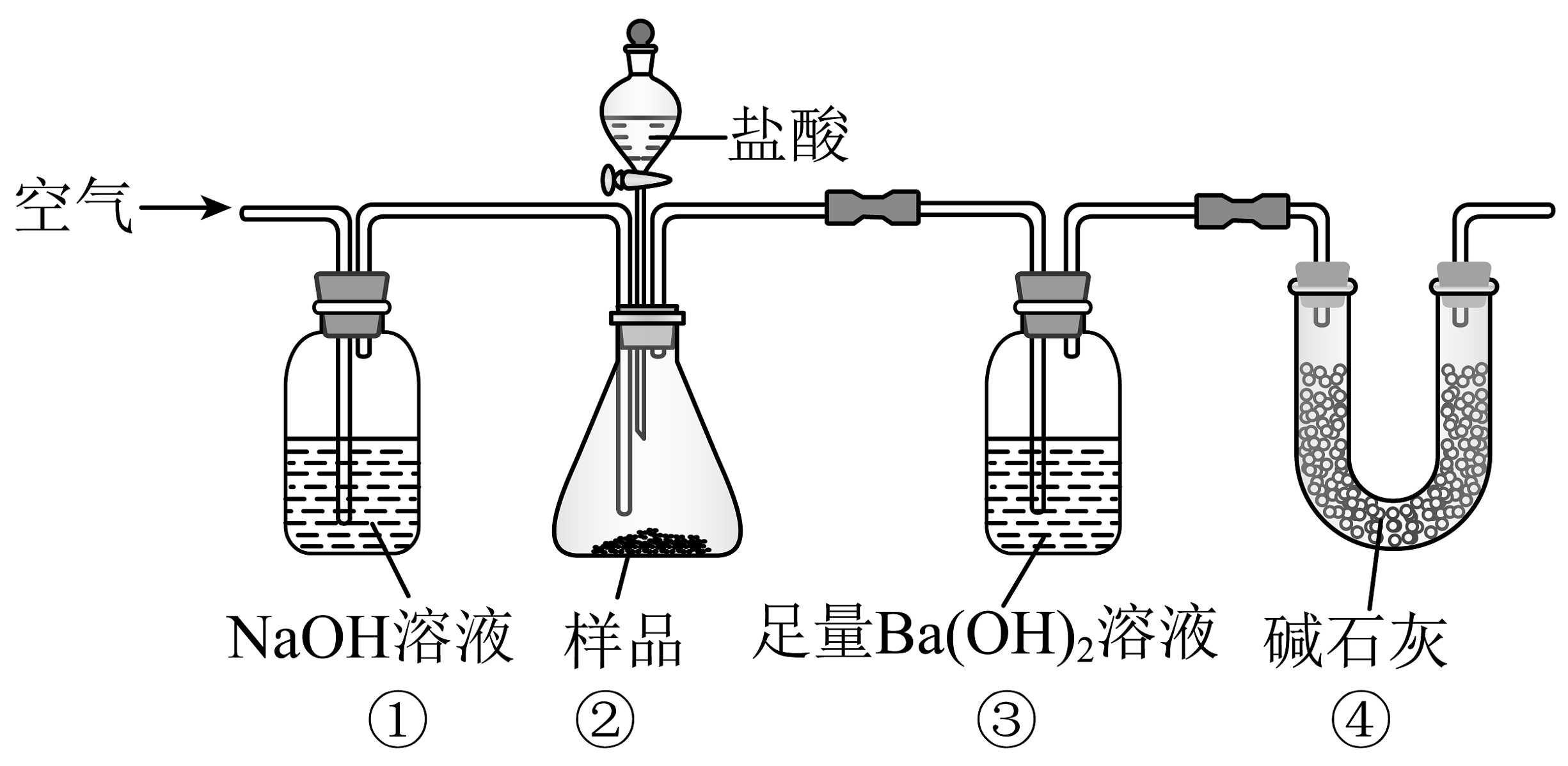 A、装置③中反应的离子方程式为 B、装置④能防止空气中的进入装置③中 C、反应完全后如果不继续通入空气,则会使测量结果偏高 D、称量装置③中产生沉淀的质量即可计算出水垢中的质量分数
A、装置③中反应的离子方程式为 B、装置④能防止空气中的进入装置③中 C、反应完全后如果不继续通入空气,则会使测量结果偏高 D、称量装置③中产生沉淀的质量即可计算出水垢中的质量分数 -
3、做实验时不小心粘了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸盐(含)的稀溶液洗涤马上可以复原,其离子方程式为: , 关于此反应的叙述不正确的是A、1mol参加反应转移电子物质的量是5 mol B、该反应的氧化剂是 C、该反应右边方框内的产物是H2O D、配平该反应式后,H+的系数是16
-
4、元素铬(Cr)的几种化合物存在下列转化关系,下列判断正确的是
固体
A、是碱性氧化物 B、反应②应在高温下进行 C、反应②③是氧化还原反应 D、反应②的离子方程式为 -
5、用表示阿伏加德罗常数的值,下列说法正确的是A、含有的分子数为 B、溶液中的个数为 C、标准状况下,中含有氢原子的个数为 D、和(不考虑N2O4)的混合物中含的氧原子数为
-
6、设表示阿伏加德罗常数的值,下列说法正确的是A、与足量的盐酸反应,转移的电子数为 B、晶体中含有个 C、等质量的和含有的原子数不同 D、个分子中含有原子
-
7、氯化钠对于地球上的生命非常重要,同时也是一种化工原料,可以制备一系列物质。下列说法正确的是
 A、能用氢氧化钙溶液鉴别和两种溶液 B、在中燃烧产生苍白色火焰,瓶口处有白烟生成 C、侯德榜制碱法第一步反应的离子方程式为: D、固体加水电离过程可以表示为
A、能用氢氧化钙溶液鉴别和两种溶液 B、在中燃烧产生苍白色火焰,瓶口处有白烟生成 C、侯德榜制碱法第一步反应的离子方程式为: D、固体加水电离过程可以表示为 -
8、下列离子方程式书写正确的是A、溶于水: B、溶于稀盐酸: C、与冷石灰乳反应: D、溶液与少量硫酸混合:
-
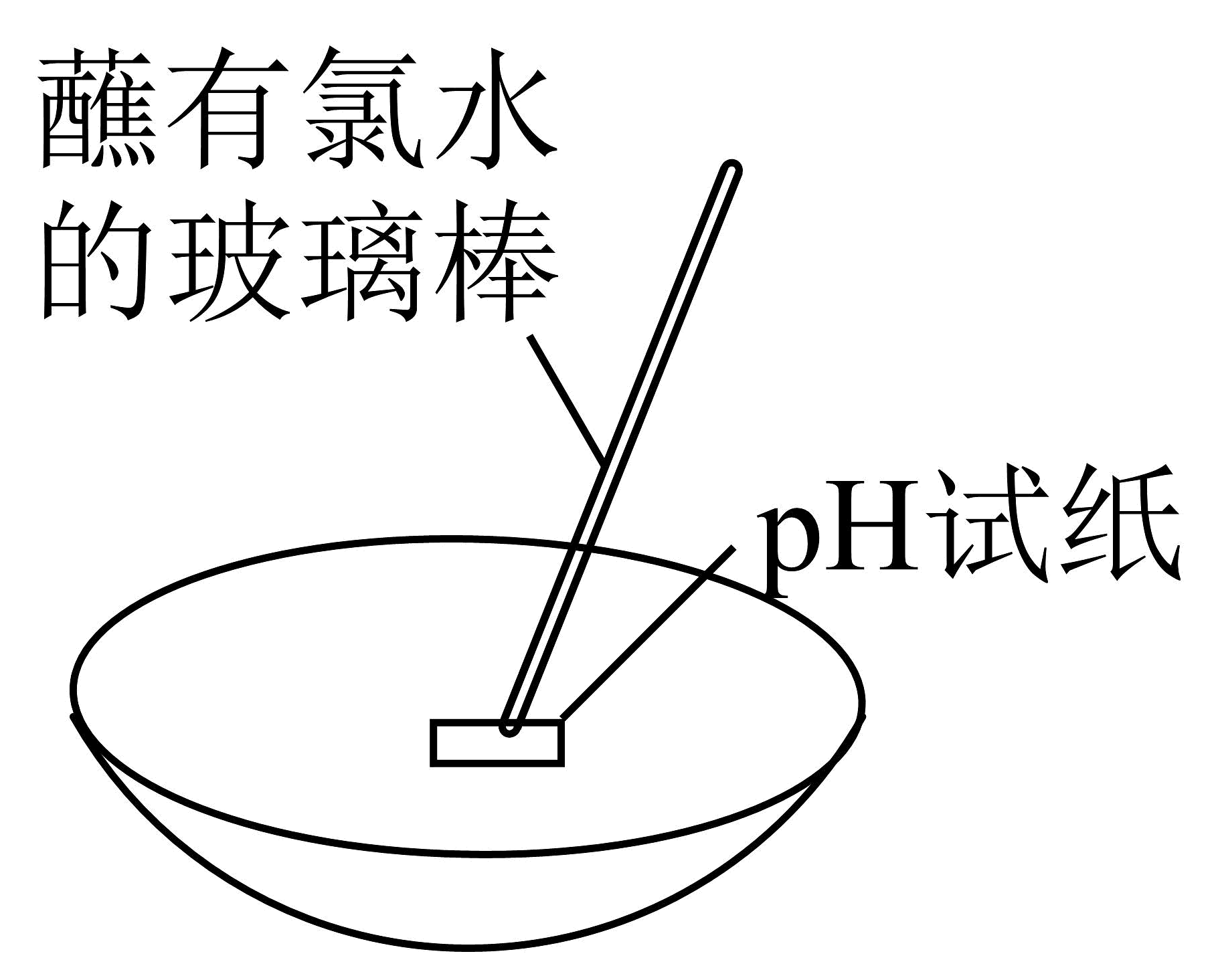
9、下列实验或操作方法正确的是
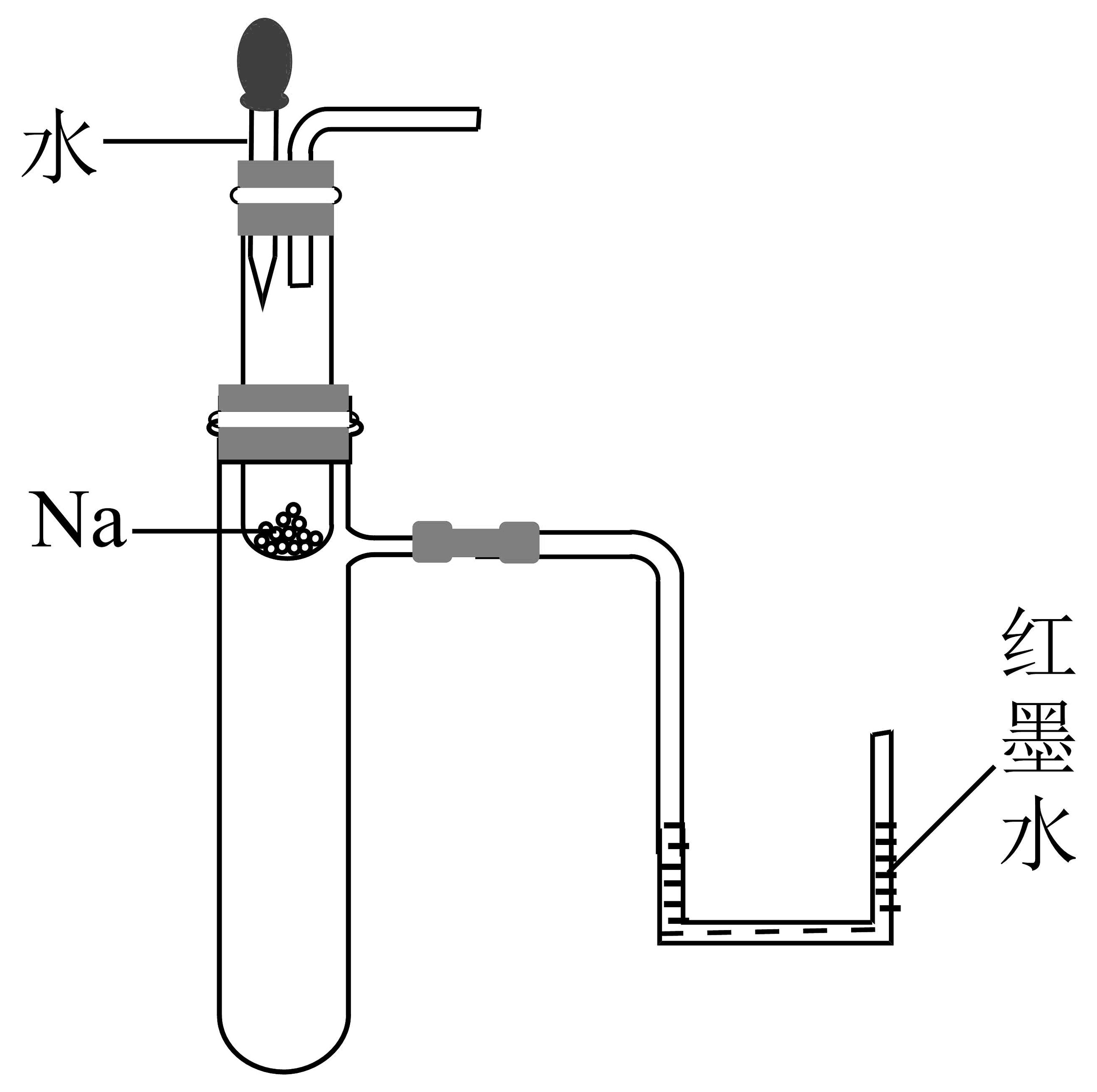
A验证钠与水反应为放热反应
B测氯水的
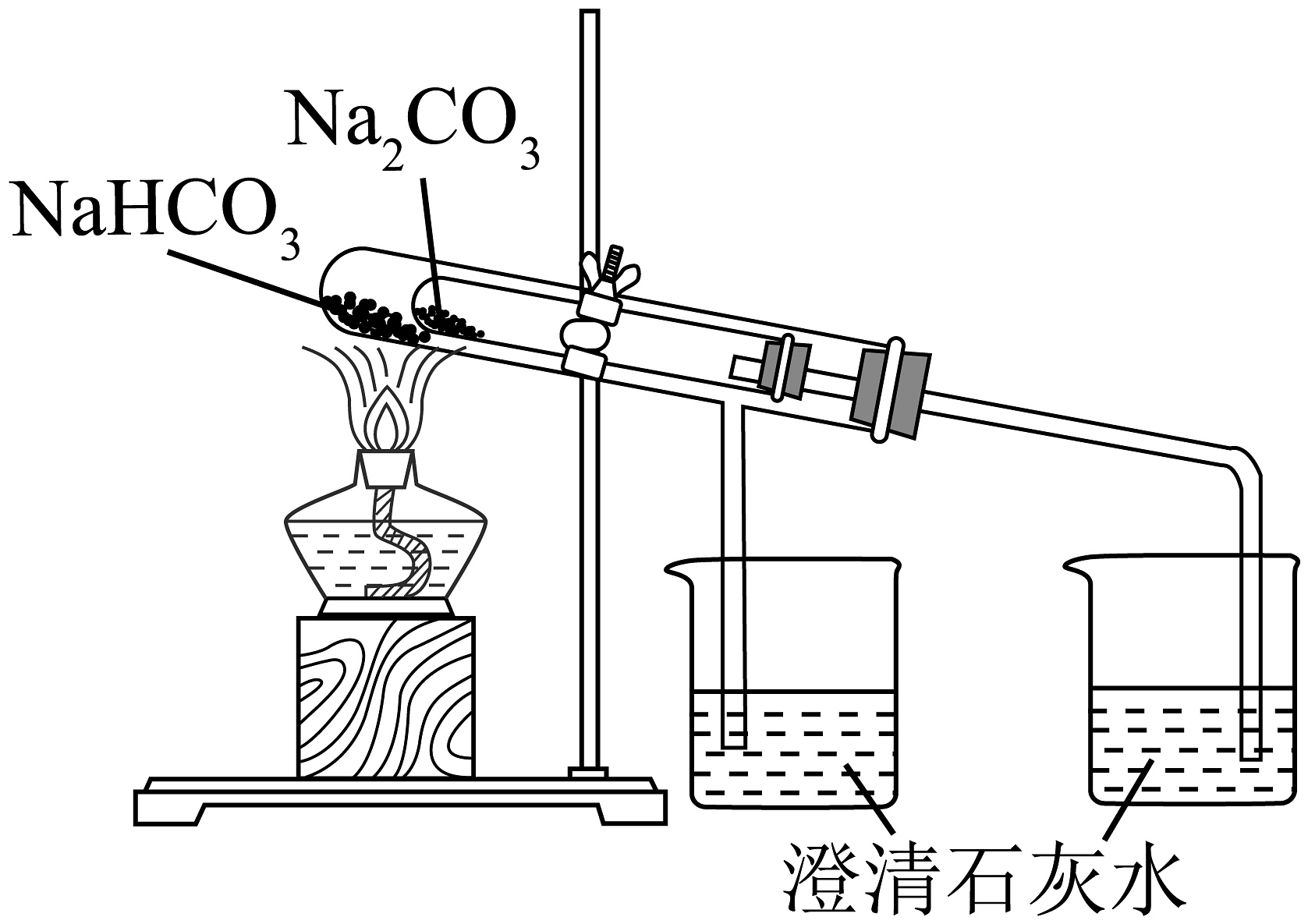
C检验
D验证热稳定性:
A、A B、B C、C D、D -
10、在给定条件下,下列选项所示的物质间转化均能实现的是A、稀盐酸漂白粉 B、 C、 D、
-
11、在某澄清透明溶液中,下列各组离子能大量共存的是A、、、、 B、、、、 C、、、、 D、、、、
-
12、数字化实验是利用传感器和信息处理终端进行实验数据的采集与分析。下图是用数字化实验采集的光照过程中氯水的变化情况,以下分析正确的是
 A、随时间增长,氯水的酸性减弱 B、随时间增长,氯水中的增大 C、随时间增长,氯水的漂白性增强 D、随时间增长,氯水的质量减小
A、随时间增长,氯水的酸性减弱 B、随时间增长,氯水中的增大 C、随时间增长,氯水的漂白性增强 D、随时间增长,氯水的质量减小 -
13、人民对美好生活的向往就是我们的奋斗目标。化学与生活密切相关,下列解释合理的是
选项
操作或现象
解释
A
节日燃放的烟花五彩缤纷
活泼金属单质易燃且火焰颜色各异
B
食品包装袋中装有“脱氧剂”
“脱氧剂”为 , 能吸收
C
用在潜水艇和消防员的呼吸面具中
能与、反应产生
D
漂白液与含盐酸的洁厕剂不能混合使用
两者混合产生沉淀,影响使用效果
A、A B、B C、C D、D -
14、化学与生活密切相关,下列物质与其用途不符合的是A、:漂白、消毒 B、:自来水消毒 C、纯碱:制玻璃、肥皂 D、苏打:制作馒头和面包的膨松剂
-
15、《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列有关传统文化的分析错误的是A、李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,生成“紫烟”发生了化学变化 B、《抱朴子》记载“以曾青涂铁,铁赤色如铜”,涉及置换反应 C、于谦诗句“千锤万凿出深山,烈火焚烧若等闲”,涉及分解反应 D、曹植诗句“萁在釜下燃,豆在釜中泣”,涉及氧化还原反应
-
16、是重要的化工原料,由软锰矿(主要成分为 , 主要杂质有和)制备的一种工艺流程如图:
软锰矿溶出液纯化液
资料:①该工艺条件下与不反应。
②部分金属阳离子沉淀的。
开始沉淀时
1.5
3.4
5.9
6.3
完全沉淀时
2.8
4.8
7.8
8.3
(1)、“溶出”时,Fe的氧化过程及得到的主要途径如图所示。
步骤Ⅱ是从软锰矿石中溶出的主要反应,反应的离子方程式是。
(2)、“纯化”时,先向溶出液中加入 , 将氧化;再加入调节溶液pH,使转化为氢氧化物沉淀而除去。适宜调节的pH范围是<pH<。(3)、已知:常温下,。某的滤液中的物质的量浓度为。(4)、向0.464g所得产品中依次加入足量和足量稀 , 加热至充分反应,再用溶液滴定剩余至终点,消耗溶液的体积为20.00mL。已知过程中发生的反应为:①滴定终点的现象是:。
②计算该产品中的纯度。(写出计算过程,已知的摩尔质量为)
-
17、已知如下表数据():
物质
HCN
电离常数
(1)、常温下,计算的HCN溶液。(2)、碳酸的第一步电离平衡常数表达式。(3)、同体积、同浓度的上述三种酸,溶液pH由大到小的顺序为。(4)、同体积、等pH的上述三种酸与碱完全中和时,消耗NaOH的物质的量最少的是。(5)、常温下,NaCN溶液的pH7(填>、=或<),写出水解离子方程式。(6)、常温下,溶液的pH7(填>、=或<),原因是(结合平衡常数进行解释)。(7)、在NaCN溶液中通入少量反应的离子方程式。 -
18、电解原理在化学工业中有广泛应用。如图所示电解池装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答下列问题:
 (1)、若都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。
(1)、若都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。①X电极上的电极反应式是 , 检验该电极反应产物的方法是。
②Y极上的电极反应式为。在Y极附近观察到的现象是。
(2)、如果用电解方法精炼粗铜,电解液选用溶液,则:①X电极的材料是 , 电极主要反应式是。
②Y电极的材料是 , 电极反应式是。
-
19、二甲醚在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上CO和为原料生产的新工艺主要发生三个反应:
①
②
③
(1)、新工艺的总反应为。①。
②升高温度,的产率(选填“增大”、“减小”或“不变”)。
(2)、当反应在恒温恒容条件下达到平衡时,下列各项叙述正确的是(选填编号)。A.一定等于1:1
B.反应物与生成物的物质的量浓度之比保持不变
C.反应速率之比存在关系:
(3)、为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图。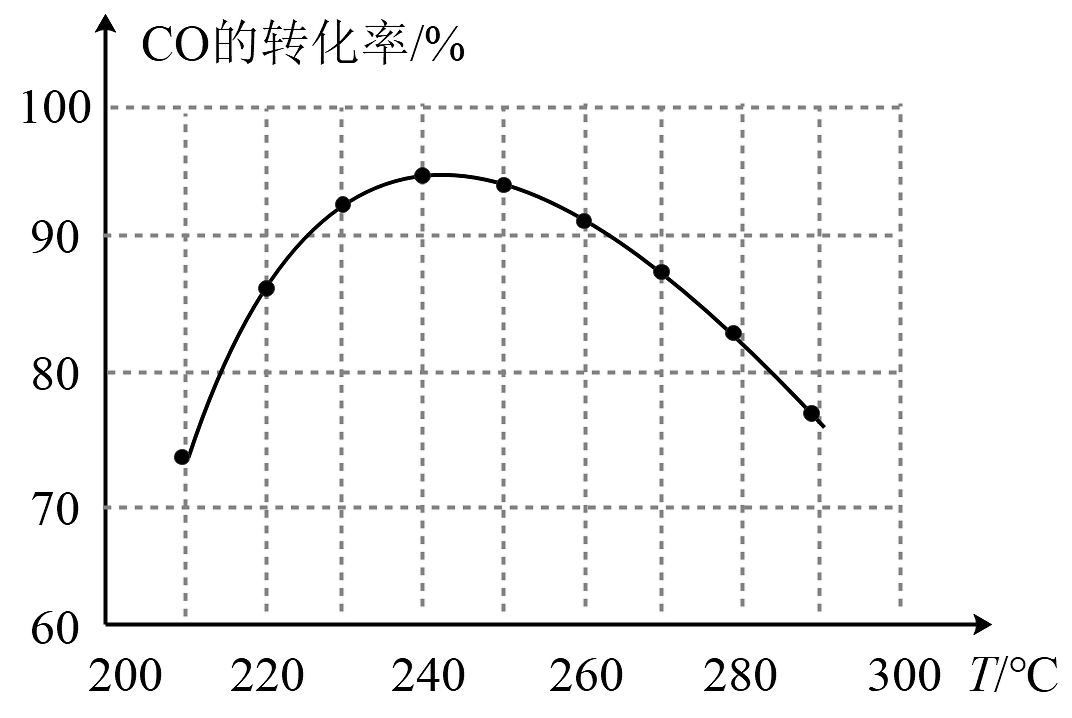
温度高于时,CO的转化率随温度升高而减小的原因是。
-
20、反应:机理如下,下列说法正确的是

反应I:
反应II:
A、反应I的 B、 C、该反应速率主要由反应I决定 D、通入过量空气,可提高的平衡转化率