相关试卷
-
1、通过传感器测定冰醋酸被水稀释后的电导率及pH,根据变化曲线图判断下列说法正确的是
 A、离子总浓度越大,溶液电导率越大 B、b点后,溶液继续稀释,所有离子浓度均减小 C、a点醋酸水溶液未达到电离平衡状态 D、实验曲线说明传感器测量值取决于带电微粒种类、浓度、温度等因素
A、离子总浓度越大,溶液电导率越大 B、b点后,溶液继续稀释,所有离子浓度均减小 C、a点醋酸水溶液未达到电离平衡状态 D、实验曲线说明传感器测量值取决于带电微粒种类、浓度、温度等因素 -
2、2-硝基-1,3-苯二酚(桔红色针状晶体,难溶于水,沸点为88℃)可由间苯二酚经磺化、硝化等步骤合成,其中一步按图示装置(部分仪器略去)收集产品。下列说法不正确的是

 A、“混酸”混合操作步骤是将浓硫酸慢慢地加入浓硝酸中,并及时搅拌冷却至室温 B、控制反应温度不超过30℃的主要原因是避免硝酸分解或挥发,同时避免副反应发生 C、水蒸气蒸馏中,2-硝基-1,3-苯二酚残留在三颈烧瓶中,取出加水过滤得粗产品 D、按上述步骤合成产物的主要目的是防止硝基取代间苯二酚羟基对位上的氢原子
A、“混酸”混合操作步骤是将浓硫酸慢慢地加入浓硝酸中,并及时搅拌冷却至室温 B、控制反应温度不超过30℃的主要原因是避免硝酸分解或挥发,同时避免副反应发生 C、水蒸气蒸馏中,2-硝基-1,3-苯二酚残留在三颈烧瓶中,取出加水过滤得粗产品 D、按上述步骤合成产物的主要目的是防止硝基取代间苯二酚羟基对位上的氢原子 -
3、清华大学某教授开发出一种锂离子电池,在室温条件下可进行循环充放电,实现对磁性的可逆调控。一极为纳米Fe2O3 , 另一极为金属锂和石墨的复合材料,电解质只传导锂离子。下列说法不正确的是
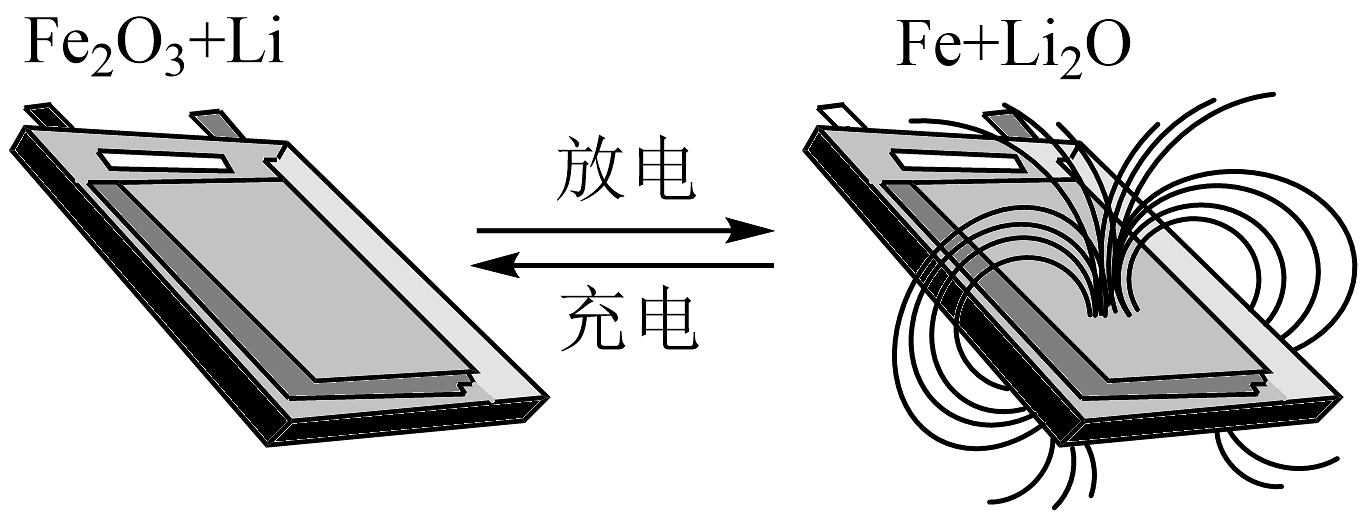 A、充电时,Fe2O3连接电源的负极,发生氧化反应 B、该电池不能使用氯化锂水溶液作为电解质溶液 C、该电池的正极的电极反应式为Fe2O3+6Li++6e-=3Li2O+2Fe D、放电时,电池逐渐靠近磁铁,且正极质量增加
A、充电时,Fe2O3连接电源的负极,发生氧化反应 B、该电池不能使用氯化锂水溶液作为电解质溶液 C、该电池的正极的电极反应式为Fe2O3+6Li++6e-=3Li2O+2Fe D、放电时,电池逐渐靠近磁铁,且正极质量增加 -
4、有机化合物甲、乙、丙均为合成非甾体抗炎药洛索洛芬钠片的反应物或中间体。下列关于甲、乙、丙的说法正确的是
 A、甲分子中所有碳原子共平面 B、乙分子能发生水解反应和消去反应 C、丙分子中只有一个手性碳原子 D、甲、乙、丙均能发生还原反应
A、甲分子中所有碳原子共平面 B、乙分子能发生水解反应和消去反应 C、丙分子中只有一个手性碳原子 D、甲、乙、丙均能发生还原反应 -
5、下列说法正确的是A、可用新制氢氧化铜悬浊液鉴别甲酸甲酯、甲醛和甲酸 B、可用金属钠或无水硫酸铜检验乙醇中是否混有蒸馏水 C、氢氧化铁胶体和久置氯化铁溶液可用丁达尔效应区别 D、用Br2的CCl4溶液或酸性KMnO4溶液区别二烯烃和芳香烃
-
6、下列反应的离子方程式正确的是A、工业上生产漂白粉:2OH-+Cl2=Cl-+ClO-+H2O B、用惰性电极电解饱和ZnCl2溶液:Zn2++2Cl-Zn+Cl2↑ C、二氧化硫通入氯化铁溶液中:SO2+2Fe3++2H2O=2Fe2++4H++SO D、NaHSO4溶液与Ba(OH)2溶液反应恰好呈中性:H++SO+Ba2++OH-=BaSO4↓+H2O
-
7、我国航天科工自主研发的某种芳纶纤维强度高,韧性强,不仅抗拉能力强,还有极强的防割性能,广泛用作头盔、航空航天等防护材料,其高分子结构片段如图。下列说法不正确的是
 A、氢键作用使芳纶纤维具有更优异的热稳定性和耐辐射性能 B、完全水解的产物分子中,苯环上的氢原子具有不同的化学环境 C、通过灼烧闻气味的方法可鉴别芳纶纤维和羊毛纤维 D、通过质谱法测定芳纶纤维的平均相对微粒质量,可计算出聚合度
A、氢键作用使芳纶纤维具有更优异的热稳定性和耐辐射性能 B、完全水解的产物分子中,苯环上的氢原子具有不同的化学环境 C、通过灼烧闻气味的方法可鉴别芳纶纤维和羊毛纤维 D、通过质谱法测定芳纶纤维的平均相对微粒质量,可计算出聚合度 -
8、下列说法正确的是
 A、甲装置可验证生铁的吸氧腐蚀 B、乙装置能收集到纯净干燥的Cl2 C、丙装置用蒸馏水分离苯和四氯化碳 D、丁装置用于制取并收集少量NH3
A、甲装置可验证生铁的吸氧腐蚀 B、乙装置能收集到纯净干燥的Cl2 C、丙装置用蒸馏水分离苯和四氯化碳 D、丁装置用于制取并收集少量NH3 -
9、物质的性质决定用途。下列两者对应关系不正确的是A、钾钠合金室温下呈液态,可用作核反应堆的传热介质 B、75%乙醇水溶液有强还原性,广泛用于皮肤或环境消毒 C、SO2能使某些色素褪色,加热恢复原色,可用作暂时性漂白剂 D、NaNO2是一种防腐剂和着色剂,可用于香肠等肉制品的添加剂
-
10、氢氧化钠是一种重要的化工原料,广泛应用于造纸和制皂工业等。下列说法不正确的是A、氢氧化钠属于强电解质 B、氢氧化钠不能使用高纯氧化铝坩埚熔化 C、厨房油烟机污渍可用氢氧化钠溶液清洗 D、工业上氢氧化钠由氧化钠与水反应制得
-
11、下列化学用语表示正确的是A、BF3价层电子对互斥模型:
 B、氦原子轨道的电子云图:
B、氦原子轨道的电子云图: C、羟基电子式:
C、羟基电子式: D、CH3CHBrCH2Br名称读作:2位3位两个溴丙烷
D、CH3CHBrCH2Br名称读作:2位3位两个溴丙烷
-
12、化学在药物开发、合成和使用中起着至关重要的作用。下列胃酸药物的成分属于有机物的是A、NaHCO3 B、Al2Mg6(OH)16CO3•4H2O C、C12H10O14BiK3 D、Al(OH)3
-
13、德国重离子研究中心人工合成Cn的过程可表示为Zn+Pb=Cn+n。下列叙述正确的是A、合成Cn的过程为化学变化 B、Cn的中子数为165 C、Cn元素位于第七周期IIA族 D、Pb与Hg互为同位素
-
14、喷他佐辛(化合物H)是一种镇痛药物,其合成路线之一如下(略去部分试剂、条件和步骤)。

已知:

回答下列问题:
(1)、试剂X的化学名称是。(2)、C的结构简式为。(3)、D中官能团的名称是、。(4)、G中手性碳原子的数目是。(5)、试剂Y为溴代烯烃,由G生成H的反应类型是;在Y的同分异构体中,不含甲基的同分异构体的数目是。(6)、化合物M的合成路线如下:
参照F的合成路线,写出第③步的反应方程式(忽略立体化学)。
-
15、甲烷氧化偶联制乙烯是提高甲烷附加值的一项重要研究课题,其涉及的反应如下:
①
②
③
已知:以乙烯为例,其选择性定义为。
回答下列问题:
(1)、氧化生成的热化学方程式④为 , 反应的0(填“>”或“<”或“=”),反应(填“能”或“不能”)自发进行。(2)、氧化偶联生成分步进行,和的选择性随反应时间的变化关系如图所示,第一步反应的产物为。 (3)、恒压进料,原料气的对转化率与选择性的影响如图所示,根据本研究课题的目的,在(填“”或“”)更优,其原因是。
(3)、恒压进料,原料气的对转化率与选择性的影响如图所示,根据本研究课题的目的,在(填“”或“”)更优,其原因是。 (4)、一定条件下,的生成速率v与分压p间的关系为:。若的初始分压为 , 随着反应进行,当的生成速率v降低到其初始生成速率的时,则分压(用表示)。(5)、若、初始压强为 , 在恒容反应器中达平衡,的转化率为30%,和的选择性均为40%,则反应④的平衡常数(保留整数)。
(4)、一定条件下,的生成速率v与分压p间的关系为:。若的初始分压为 , 随着反应进行,当的生成速率v降低到其初始生成速率的时,则分压(用表示)。(5)、若、初始压强为 , 在恒容反应器中达平衡,的转化率为30%,和的选择性均为40%,则反应④的平衡常数(保留整数)。 -
16、是一种能将转化为的光催化剂。
Ⅰ.一种制备的步骤如下(部分条件略):

已知:为粉状晶体,难溶于水;易溶于水和乙二醇。
Ⅱ.纯度测定
将a克样品分解处理后,配制成溶液。用移液管移取溶液于碘量瓶中,加入过量溶液反应后,用硫代硫酸钠标准溶液进行滴定,其原理如下:
回答下列问题:
(1)、称量时,下列仪器中用到的有、(填仪器名称)。 (2)、步骤③中,为使固液快速分离,应采用的方法是(填标号)。
(2)、步骤③中,为使固液快速分离,应采用的方法是(填标号)。a.蒸馏 b.减压过滤 c.蒸发
(3)、步骤④中,先用蒸馏水多次洗涤,检验产物中已洗净的方法是;最后用乙醇洗涤,其目的是。(4)、产物的晶体结构可用(填仪器名称)测定。(5)、纯度测定过程中,滴定所用的指示剂为(填名称),滴定终点的现象是。(6)、平行滴定三次,消耗硫代硫酸钠标准溶液的平均体积为 , 则产品的纯度为。(7)、下列操作会导致实验结果偏高的是(填标号)。a.未用待测溶液润洗水洗后的移液管
b.滴定前滴定管尖嘴有气泡,滴定后气泡消失
c.滴定终点时,俯视滴定管液面读数
-
17、具有广泛用途,一种从电解锌阳极泥回收电池级的流程如下。该阳极泥主要含有 , 以及和微量等杂质离子。

已知:。金属离子生成氢氧化物沉淀,其和溶液的关系如下图所示:

回答下列问题:
(1)、基态锰原子的电子排布式为。(2)、“溶解”步骤在酸性条件下进行,通入的作用是。(3)、“除钾钠”步骤中,控制溶液和与反应分别生成和沉淀,其中生成沉淀的离子方程式为。(4)、“除杂Ⅰ”步骤中,加调溶液 , 该步除杂的总反应方程式为。(5)、“除杂Ⅱ”步骤中,析出的“沉淀3”是、。(6)、“除杂Ⅲ”步骤中,随着“沉淀4”的生成,溶液将(填“升高”或“下降”或“不变”)。(7)、“浓缩结晶”步骤中,析出后的滤液应返回到步骤,其目的是。 -
18、常温下,溶液中含硫粒子分布系数[比如:]与的关系如图1所示;金属硫化物和在饱和溶液中达沉淀溶解平衡时,与的关系如图2所示(c为金属离子浓度)。

下列说法正确的是
A、溶液中的 B、直线④表示饱和溶液中的与的关系 C、金属硫化物的 D、浓度均为的和的混合溶液不能通过滴加饱和溶液实现分离 -
19、一种具有钙钛矿结构的光催化剂,其四方晶胞结构如图所示(α=β=γ=90°),NA是阿伏加德罗常数的值。

下列说法错误的是
A、该物质的化学式为 B、1位和2位的核间距为 C、晶体的密度为 D、2位的分数坐标可表示为 -
20、恒容反应器中,和均能催化反应:(羟基乙醛),反应历程如图所示,为中间体,为过渡态。

下列描述正确的是
A、“插入”步骤,为 B、催化作用下,“加氢”步骤为决速步骤 C、催化作用下,羟基乙醛的生成速率更小 D、反应达平衡时,升高温度,羟基乙醛的浓度增大