相关试卷
-
1、某实验小组通过如图所示实验,探究与水的反应。下列说法错误的是
 A、③中溶液变红,说明有碱性物质生成 B、④中现象可能是溶液中含有强氧化性物质造成的 C、⑤中的主要作用是验证溶液中存在 D、②中的大量气泡主要成分是氢气
A、③中溶液变红,说明有碱性物质生成 B、④中现象可能是溶液中含有强氧化性物质造成的 C、⑤中的主要作用是验证溶液中存在 D、②中的大量气泡主要成分是氢气 -
2、如图是氯元素的“价—类”二维图,根据所学知识判断下列说法正确的是
 A、的浓溶液与足量共热,转移电子数为 B、B能使有色鲜花褪色,说明B有漂白性 C、可以通过加入氧化剂实现 D、D不稳定,在光照下易分解
A、的浓溶液与足量共热,转移电子数为 B、B能使有色鲜花褪色,说明B有漂白性 C、可以通过加入氧化剂实现 D、D不稳定,在光照下易分解 -
3、设NA为阿伏加德罗常数的值。下列说法正确的是A、50g质量分数为46%的乙醇水溶液中含有的氧原子总数为2NA B、16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA C、1molNa2O2与过量的CO2反应,转移电子的数目为2NA D、1molD2O比1molH2O多2NA个质子
-
4、下列反应的离子方程式书写正确的是A、用溶液刻蚀铜板: B、与溶液恰好反应至中性: C、向溶液中滴加过量氨水: D、向溶液中加入少量NaOH溶液:
-
5、常温下,下列各组离子能大量共存的是A、、、、 B、、、、 C、、、、 D、、、、
-
6、中国科学技术大学的钱逸泰教授等以和金属钠为原料制造出纳米级金刚石粉末(直径约为)。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”,其化学方程式为。下列关于该反应的说法不正确的是A、金刚石是由原子构成的单质,它与碳纳米管、石墨烯互为同素异形体 B、该纳米级金刚石粉末能产生丁达尔效应 C、该反应利用了的强还原性 D、该反应不能在水中进行
-
7、下列物质的性质与实际应用不相符的是
选项
性质
实际应用
A
能与或反应产生
用作潜艇供氧剂
B
次氯酸盐具有氧化性
漂白粉用于漂白织物
C
碱金属化学性质活泼
钠钾合金作核反应堆的传热介质
D
氧化铝是两性氧化物
铝制餐具不宜长期存放酸性或碱性食物
A、A B、B C、C D、D -
8、下列物质的分类正确的是
选项
酸
碱
盐
酸性氧化物
碱性氧化物
A
HClO
烧碱
NaCl
B
NaClO
C
HCl
火碱
CO
D
纯碱
A、A B、B C、C D、D -
9、奥卡西平是一种可用于治疗神经系统疾病的药物。奥卡西平一种合成路线如下:
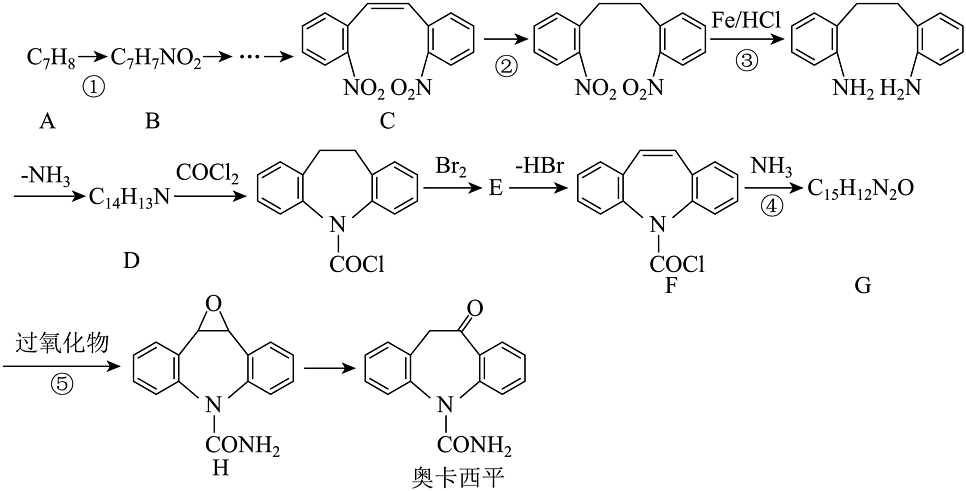 (1)、化合物C中含氧官能团的名称是。(2)、反应①的加热方式是;G的结构简式。(3)、合成路线中①②③④⑤属于还原反应的是。(4)、写出⑤的化学反应方程式(过氧化物用替代)。(5)、符合下列要求的D的同分异构体的数目种
(1)、化合物C中含氧官能团的名称是。(2)、反应①的加热方式是;G的结构简式。(3)、合成路线中①②③④⑤属于还原反应的是。(4)、写出⑤的化学反应方程式(过氧化物用替代)。(5)、符合下列要求的D的同分异构体的数目种i)含有联苯(
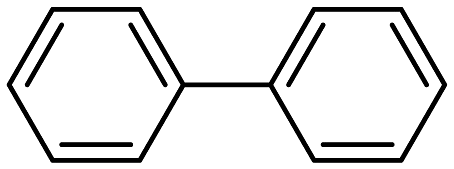 )结构,且除苯环外不含其他环状结构
)结构,且除苯环外不含其他环状结构ii)核磁共振氢谱显示苯环上的氢原子有四种不同的化学环境,且个数比为1:1:1:1
(6)、已知: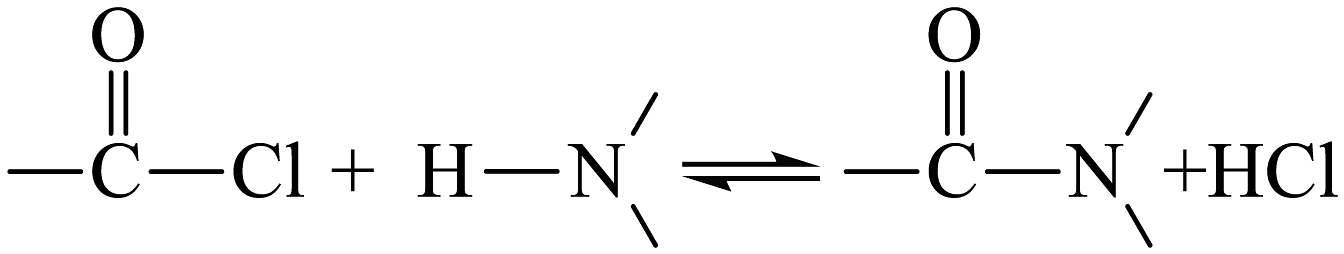 。反应④进行时,若不足,的转化率未发生明显降低,但的产率却显著下降,原因是。 (7)、合成路线中的转化过程是构建碳骨架的常见方法之一、已知:
。反应④进行时,若不足,的转化率未发生明显降低,但的产率却显著下降,原因是。 (7)、合成路线中的转化过程是构建碳骨架的常见方法之一、已知: (、为烃基或)结合相关信息,写出的转化路线(无机试剂任选)。(可表示为:目标产物)
(、为烃基或)结合相关信息,写出的转化路线(无机试剂任选)。(可表示为:目标产物) -
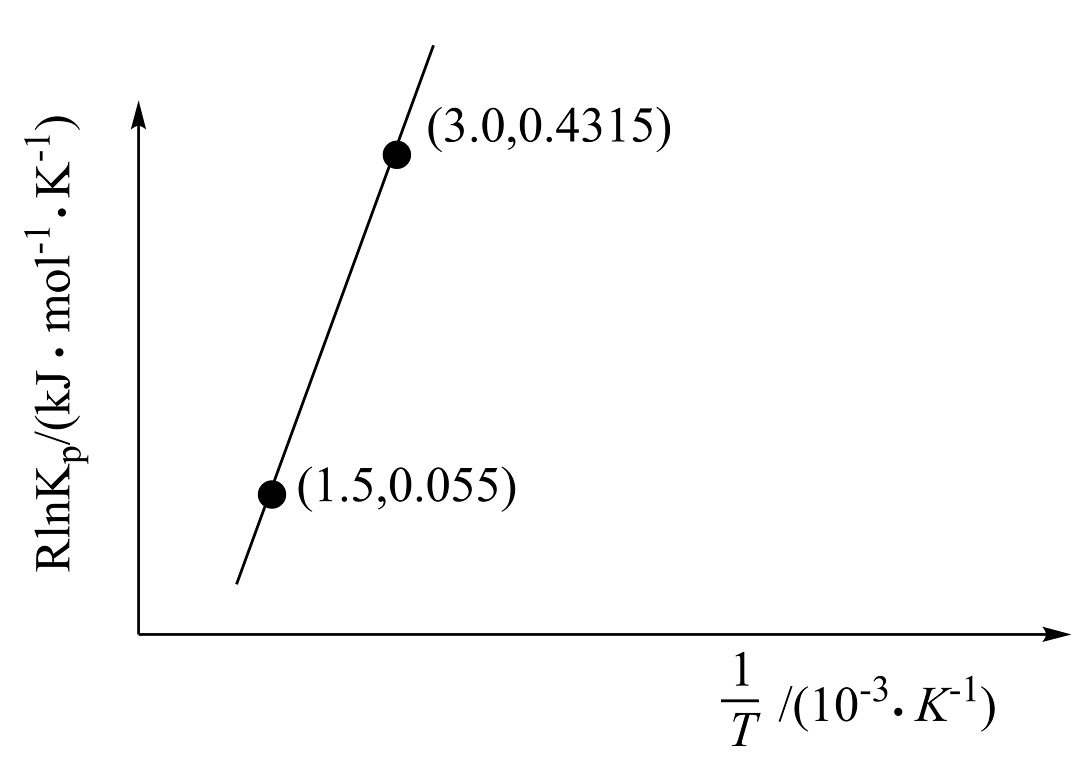
10、随着煤和石油等不可再生能源的日益枯竭,同时在“碳达峰”与“碳中和”可持续发展的目标下,作为清洁能源的天然气受到了广泛的关注。(1)、目前正在开发用甲烷和氧气合成甲醇: , 已知:(为常数)。根据图中信息,恒压条件下,温度升高,(填“增大”、“减小”或“不变”);该反应的热化学方程式为。
 (2)、甲烷干重整反应()可以将两种温室气体(和)直接转化为合成气(主要成分为和),兼具环境效益和经济效益。甲烷干重整过程中可能存在反应:
(2)、甲烷干重整反应()可以将两种温室气体(和)直接转化为合成气(主要成分为和),兼具环境效益和经济效益。甲烷干重整过程中可能存在反应::(主反应)
:
:
:
:
在、进料配比、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、的转化率和积碳率随着温度变化的规律如图所示。
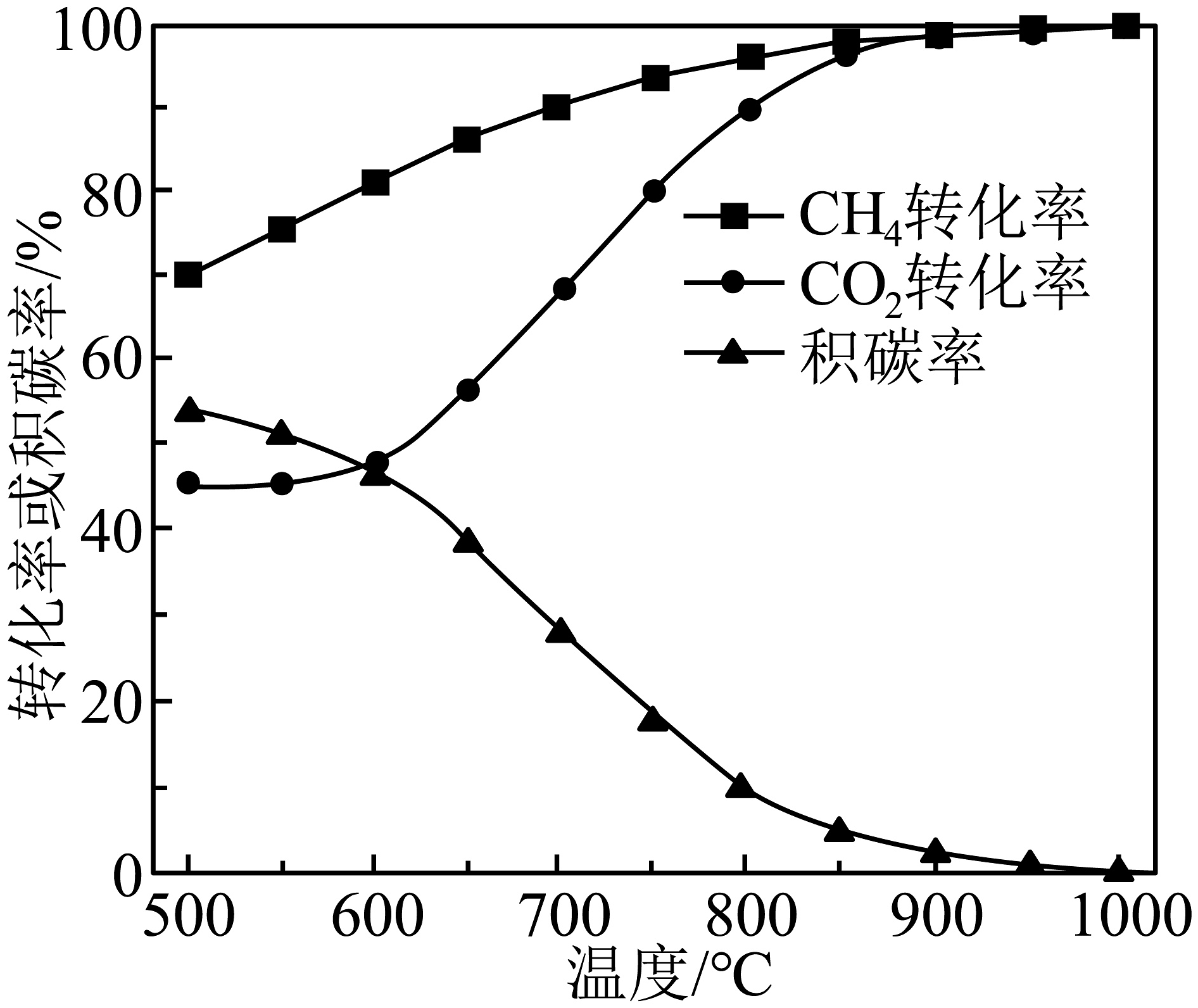
①甲烷干重整的最佳温度为℃。
②恒容绝热条件下仅发生主反应时,下列情况能说明该反应达到平衡状态的有(填标号)。
A.和的转化率相等 B.正逆
C.容器内气体密度不变 D.平衡常数不变
③在最佳温度、初始压强条件下,向某的恒容密闭容器中加入和 , 设只发生、两个反应。达平衡后,测得容器中的浓度为 , 的转化率为80%,则此时反应的压强平衡常数(列出计算表达式,压强平衡常数用各组分的平衡分压代替物质的量浓度进行计算,平衡分压=物质的量分数×平衡总压强)。
(3)、利用甲烷干重整反应中的气体和在某催化剂表面制备甲醇的反应机理如图所示。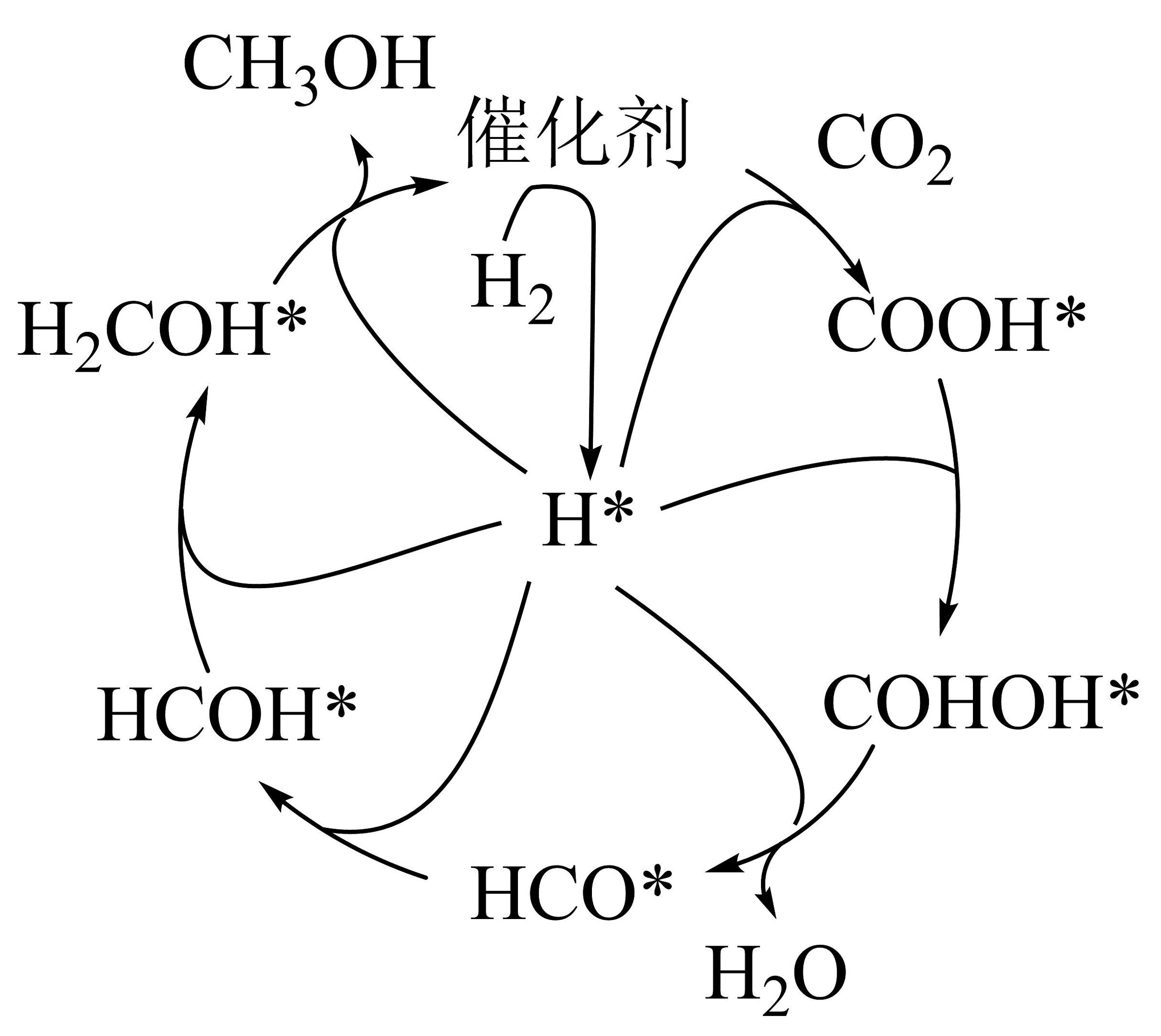
①催化循环中产生的中间体微粒共种。
②催化加氢制甲醇总反应的化学方程式为。
-
11、实验室用如图装置(夹持、搅拌等装置已省略)制备氢化铝钠。
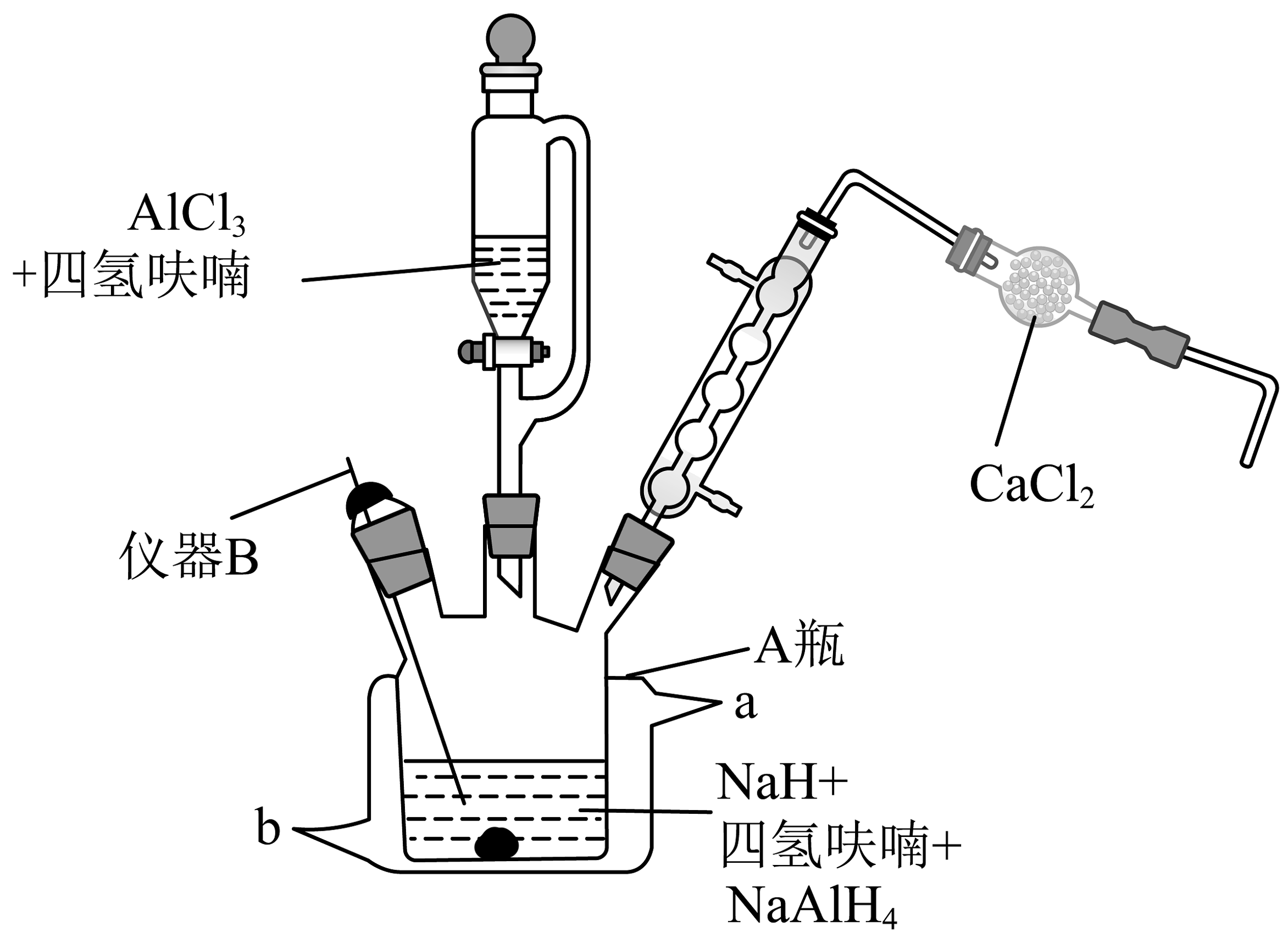
简要步骤如下:
I.在瓶中分别加入含的四氢呋喃悬浮液、固体,搅拌,接通冷凝水,控温30℃。
Ⅱ.滴加含的四氢呋喃溶液,有白色固体析出。
Ⅲ.滴加完后,充分搅拌 , 放置沉降,分离出固体和清液,经一系列操作得到产品。
已知:①在室温干燥空气中能稳定存在,遇水易燃烧爆炸,易溶于四氢呋喃(
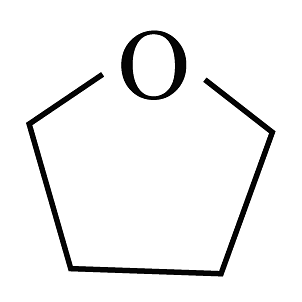 ),难溶于甲苯。常压下,四氢呋喃沸点66℃。
),难溶于甲苯。常压下,四氢呋喃沸点66℃。②;;。
请回答:
(1)、仪器B名称是 , 装置中的主要作用。(2)、请写出遇水发生反应的化学方程式。(3)、步骤Ⅰ中,加少量固体的作用是(写出其中一条)。步骤Ⅲ中,“沉降”得到的清液的主要成分为。(4)、若称量纯化后的质量为 , 计算该反应的产率为。(5)、氢化钠是一种重要的还原剂和供氢剂。氢化钠的晶胞类似氯化钠的晶胞,如图所示。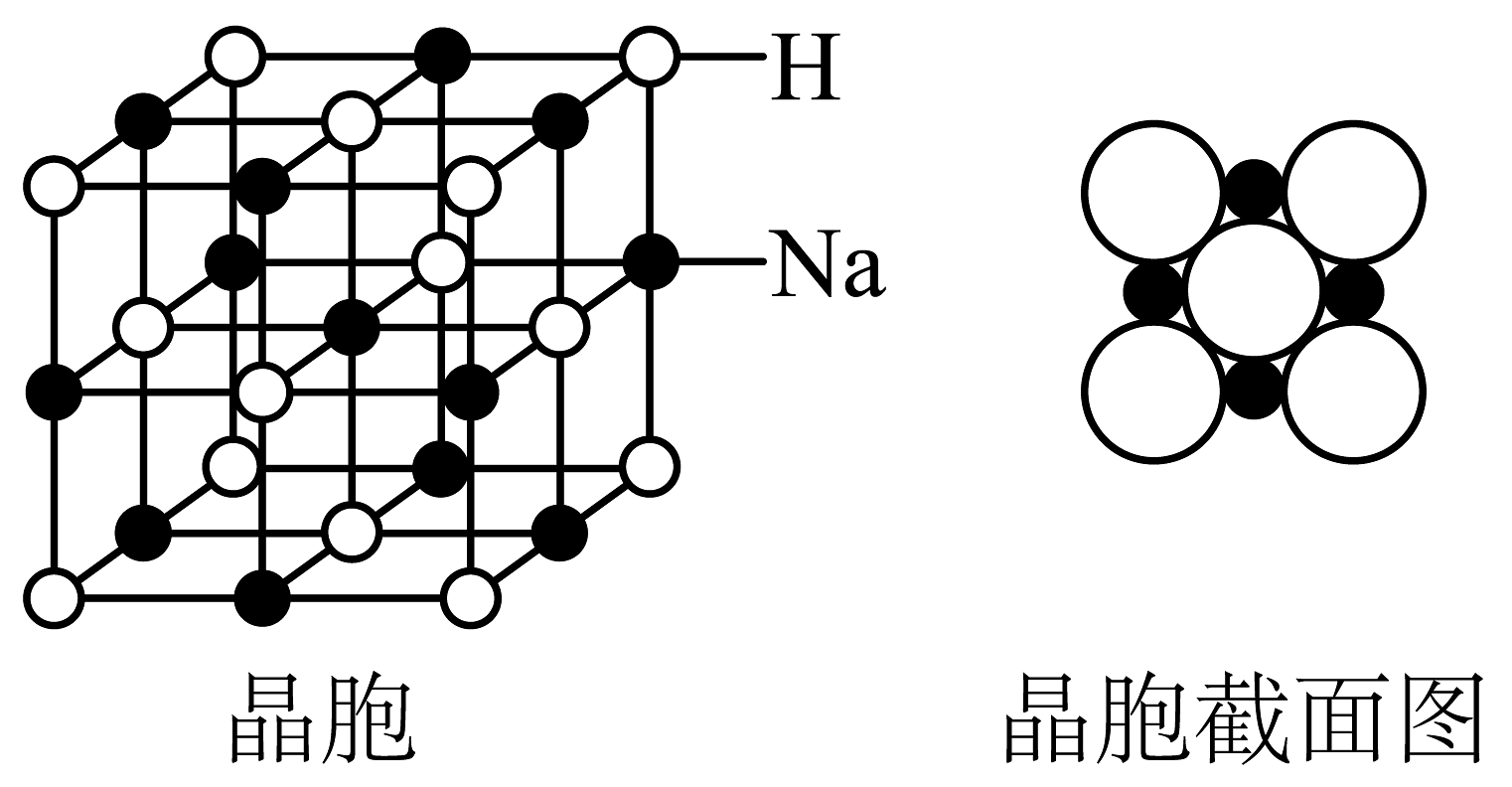
已知:晶胞参数为。晶体中阴、阳离子半径之比为。
-
12、
攀钢钒钛是中国主要的钛原料供应商和重要的钛渣生产企业,现用生产钛白粉的废渣制备铁黄氧化铁( , 淡黄色,具有良好的耐光性、耐大气性和耐碱性,较其他黄色颜料的遮盖力高,着力也强)过程如下。

资料:i.钛白粉废渣成分:主要为 , 含少量和不溶物;
ii.。
I.纯化过程
(1)纯化过程中加入铁粉不足会造成的后果是。
(2)充分反应后,采用过滤操作分离混合物,过滤时漏斗下端紧靠烧杯内壁原因。
II.制备晶种
(3)用、溶液和空气制备铁黄晶种过程时间比较长,加入亚硝酸钠等可缩短制备时间,经查阅文献发现,在反应中起催化剂作用,实际起催化作用的是其在酸性条件下生成的气体。改变不同的实验条件,发现适当的空气流速、合适的和温度(40℃)、增加催化剂用量都能够提高产率。温度过高或过低均影响产率的原因是(不考虑副反应)。
(4)实验中观察到沉淀的颜色变为色时,证明已经成功制备晶种。
(5)写出由精制溶液制备铁黄晶体的总反应化学方程式。
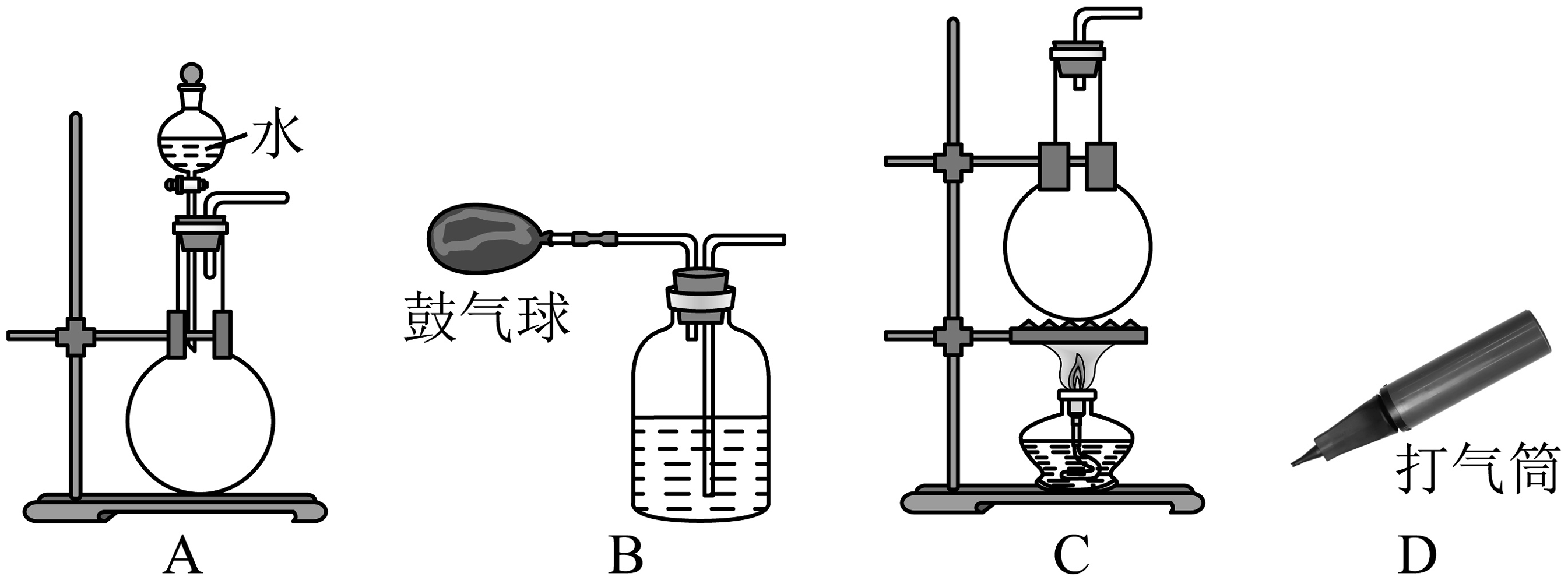
(6)下列装置可作为空气提供源的有。
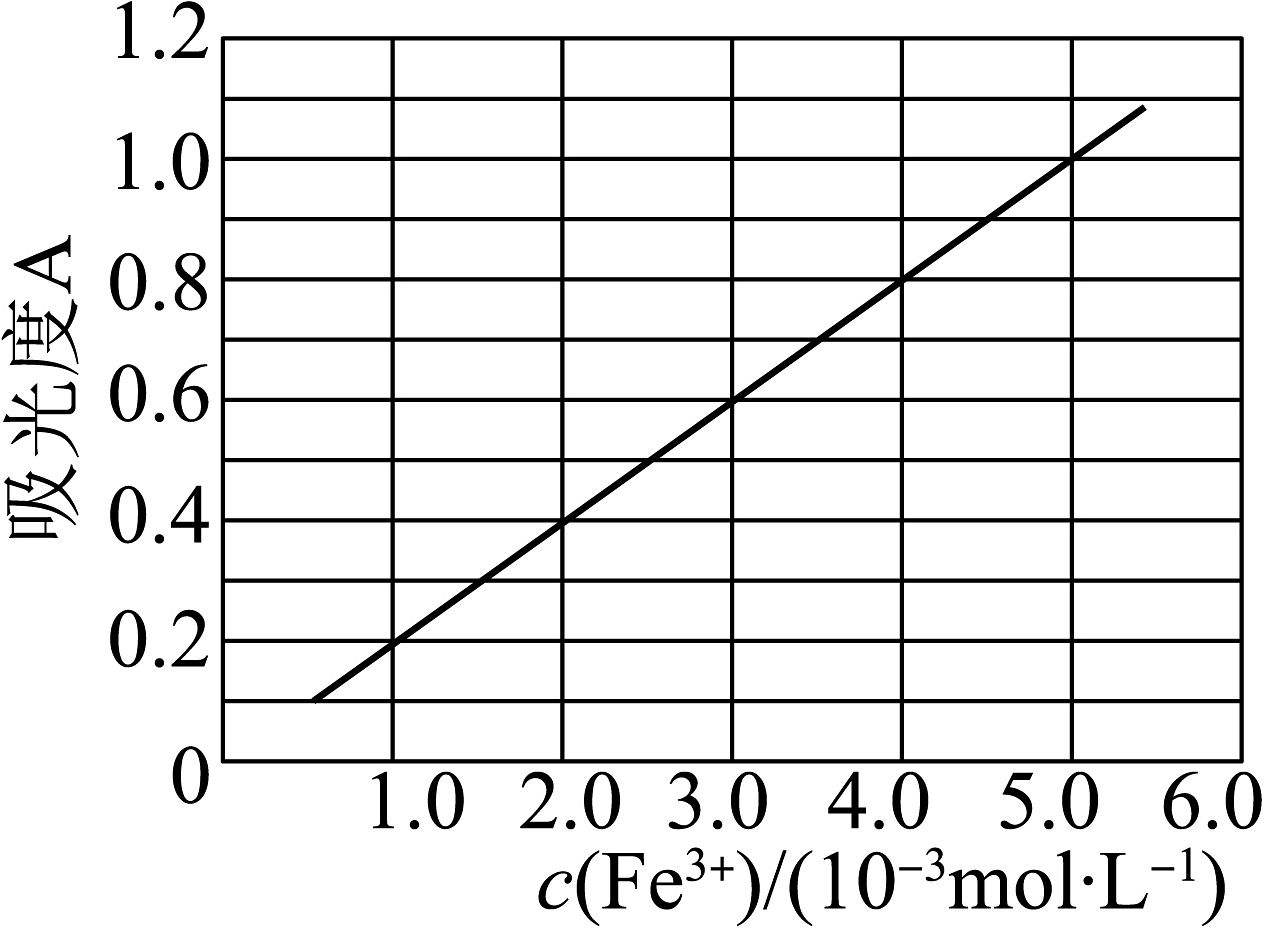
(7)制得的透明铁黄中往往混有氧化铁,可用分光光度法测定透明铁黄的含量。已知的吸光度(对特定波长光的吸收程度)与标准溶液浓度的关系如图所示。称取样品,用稀硫酸溶解并定容至 , 准确移取该溶液 , 加入足量溶液,再用蒸馏水定容至。测得溶液吸光度 , 计算样品中的质量分数%(保留两位有效数字)。
-
13、常温下Ag(Ⅰ)-水溶液体系中存在反应: , 平衡常数为K。已知初始浓度 , 所有含碳物种的摩尔分数与pH的变化关系如图所示(忽略溶液体积变化)。下列说法错误的是
 A、曲线Ⅱ、Ⅲ分别表示、的摩尔分数与pH的变化关系 B、常温下的电离常数 C、pH=n时, D、pH=8时,
A、曲线Ⅱ、Ⅲ分别表示、的摩尔分数与pH的变化关系 B、常温下的电离常数 C、pH=n时, D、pH=8时, -
14、金属钼()的一种晶胞为体心立方堆积(图1),晶胞参数为。以晶胞参数为单位长度建立如图所示坐标系(图2),该晶胞沿其体对角线方向上的投影如图3所示。下列说法错误的是
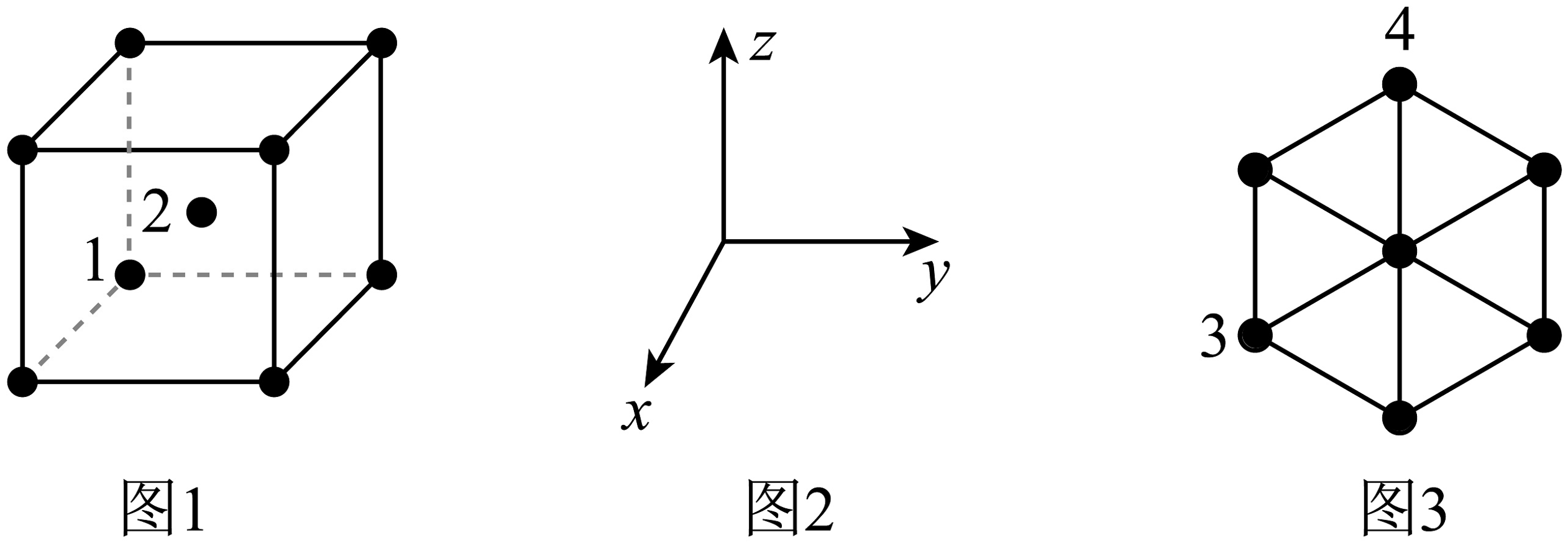 A、图3中原子3和原子4的连线长度为 B、金属钼的密度为 C、若图1中原子1的分数坐标为 , 则原子2的分数坐标为 D、钼原子的空间利用率为
A、图3中原子3和原子4的连线长度为 B、金属钼的密度为 C、若图1中原子1的分数坐标为 , 则原子2的分数坐标为 D、钼原子的空间利用率为 -
15、利用下图所示装置可合成己二腈。充电时生成己二腈,放电时生成O2 , 其中a、b是互为反置的双极膜,双极膜中的H2O会解离出H+和OH-向两极移动。下列说法正确的是
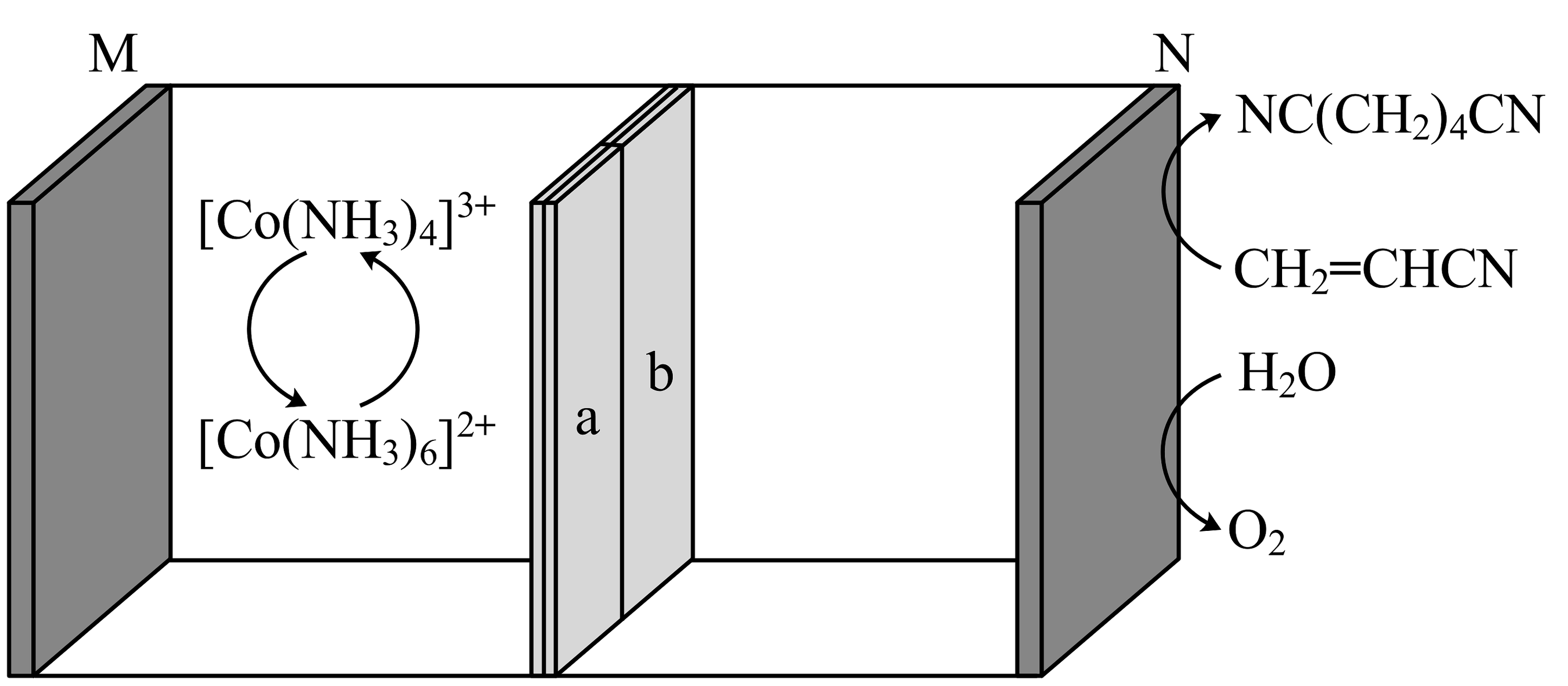 A、放电时,N极的电势高于M极的电势 B、放电时,双极膜中H+向N极移动 C、充电时,N极的电极反应式为 D、若充电时制得 , 则放电时需生成1molO2才能使左室溶液恢复至初始状态
A、放电时,N极的电势高于M极的电势 B、放电时,双极膜中H+向N极移动 C、充电时,N极的电极反应式为 D、若充电时制得 , 则放电时需生成1molO2才能使左室溶液恢复至初始状态 -
16、从废旧铅酸蓄电池的铅膏中回收铅的工艺流程如图所示(流程中部分产物已经略去)。查阅资料显示:、;、为可溶于水的强电解质。下列说法错误的是
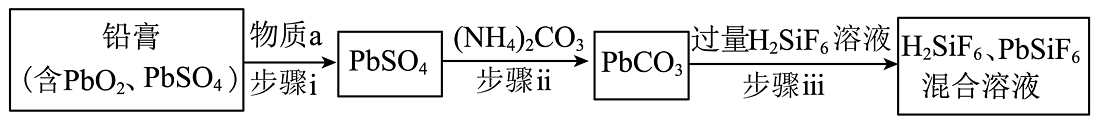 A、步骤i使用的物质a具有还原性 B、步骤ii的实验操作中需用到玻璃仪器有:烧杯、玻璃棒、漏斗 C、步骤iii反应的离子方程式是 D、工业上用和混合溶液作电解液,用电解法实现粗铅的提纯,可在阳极得到纯铅
A、步骤i使用的物质a具有还原性 B、步骤ii的实验操作中需用到玻璃仪器有:烧杯、玻璃棒、漏斗 C、步骤iii反应的离子方程式是 D、工业上用和混合溶液作电解液,用电解法实现粗铅的提纯,可在阳极得到纯铅 -
17、由直接脱氢制的反应为。在密闭容器中发生该反应,测得的平衡转化率与温度和压强的关系如图所示,下列说法正确的是
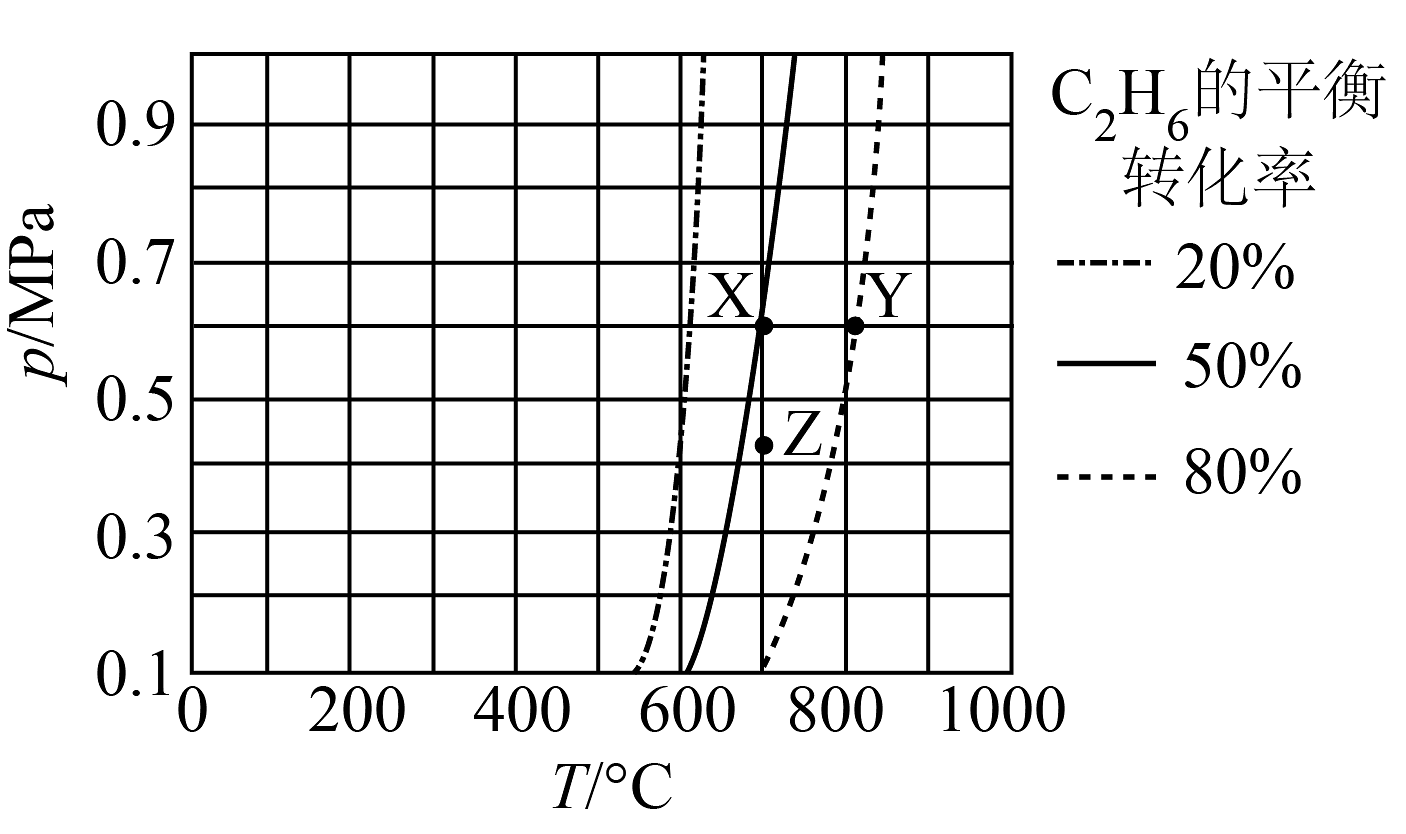 A、X、Z两点平衡常数: B、该反应在任何条件下都能自发进行 C、X、Y两点的化学反应速率: D、减压、升温均有利于提高的平衡转化率
A、X、Z两点平衡常数: B、该反应在任何条件下都能自发进行 C、X、Y两点的化学反应速率: D、减压、升温均有利于提高的平衡转化率 -
18、含元素或元素部分物质的“价-类”关系如图所示,下列叙述错误的是
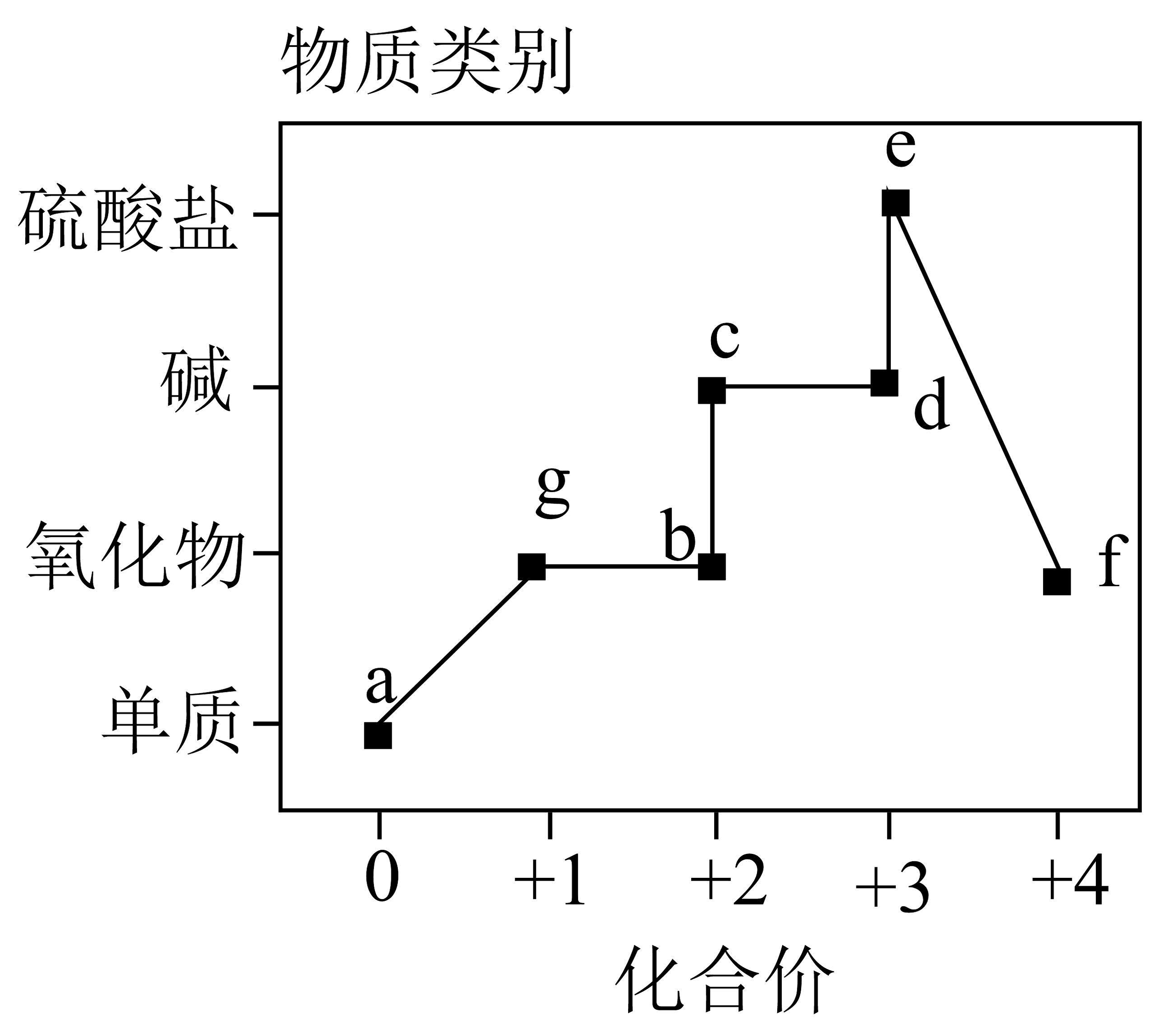 A、若为红色,则在高温下的稳定性强于 B、若为蓝色,则两种物质之间一步反应能实现: C、若能被强磁铁吸附,则和能发生化合反应 D、若为红褐色,则b、c均能与足量的稀硝酸发生氧化还原反应
A、若为红色,则在高温下的稳定性强于 B、若为蓝色,则两种物质之间一步反应能实现: C、若能被强磁铁吸附,则和能发生化合反应 D、若为红褐色,则b、c均能与足量的稀硝酸发生氧化还原反应 -
19、化合物是合成维生素的一种中间体,其合成路线如下图。

下列说法正确的是
A、分子中所有碳原子不可能全部共平面 B、分子中不存在手性碳 C、分子与氢氧化钠溶液反应后在水中的溶解度增大 D、可用酸性高锰酸钾溶液鉴别Y、Z -
20、下列仪器在相应实验中选用不正确的是
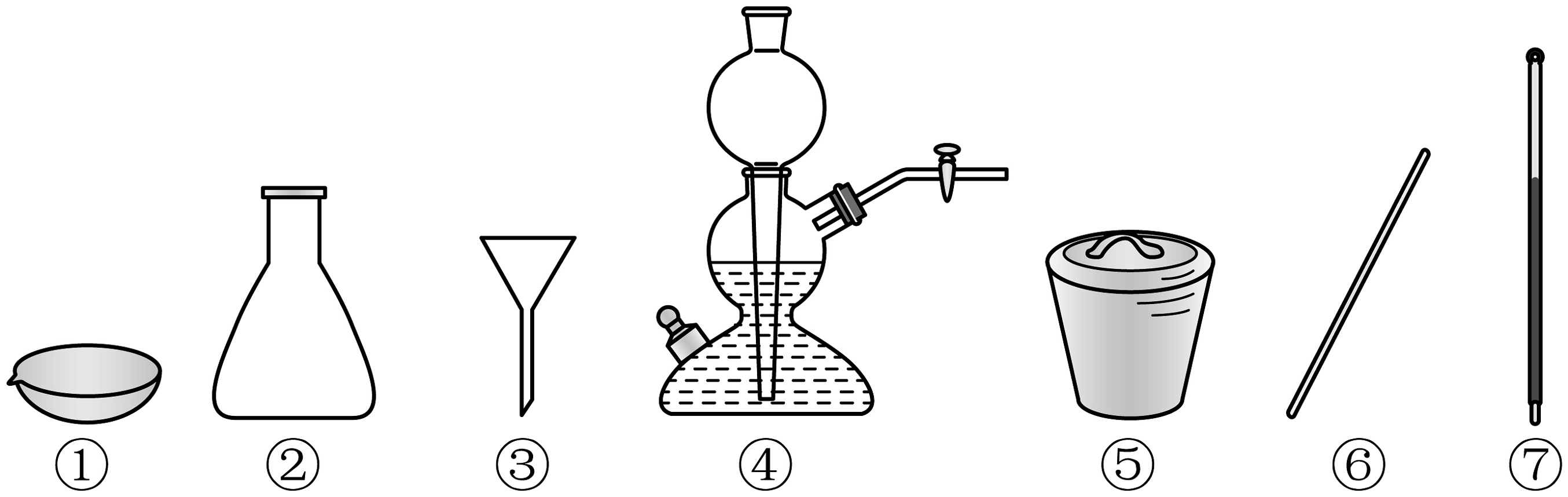 A、凝固熔融态物质制备硫晶体:① B、实验室用大理石制:④ C、灼烧海带:⑤⑥ D、重结晶法提纯苯甲酸:①③⑥⑦
A、凝固熔融态物质制备硫晶体:① B、实验室用大理石制:④ C、灼烧海带:⑤⑥ D、重结晶法提纯苯甲酸:①③⑥⑦