相关试卷
-
1、某实验小组尝试设计如下装置,利用光伏发电,以甲苯为原料通过间接氧化法制取苯甲酸并实现储能,反应原理如下图所示。下列有关说法错误的是
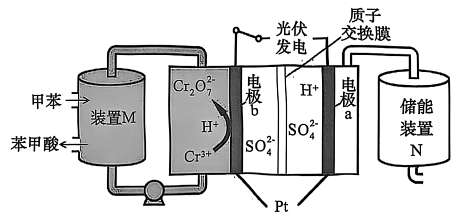 A、电极a为阴极,通过质子交换膜移向a极 B、装置中发生反应:
A、电极a为阴极,通过质子交换膜移向a极 B、装置中发生反应: C、每生成 , 理论上装置中可获得苯甲酸
D、电极发生电极反应为
C、每生成 , 理论上装置中可获得苯甲酸
D、电极发生电极反应为
-
2、部分含硫元素或氮元素物质的类别与相应化合价关系如图所示。

下列描述不合理的是
A、在自然界中存在c,说明该元素非金属性较弱 B、一定条件下,b与e可发生反应转化为c C、f、g为常见的强酸,常温下其浓溶液可用铁制容器储运 D、a、b分子中中心原子的VSEPR模型相同 -
3、已知:甲酸可以分解制取;某学习小组设计实验制取并验证其性质的装置如图所示(部分夹持装置略),下列说法不正确的是
 A、浓硫酸的作用为催化剂、脱水剂 B、碱石灰可吸收水蒸气和甲酸蒸气以及可能产生的和 C、该装置可验证具有还原性 D、可用NaOH溶液吸收尾气,防止污染空气
A、浓硫酸的作用为催化剂、脱水剂 B、碱石灰可吸收水蒸气和甲酸蒸气以及可能产生的和 C、该装置可验证具有还原性 D、可用NaOH溶液吸收尾气,防止污染空气 -
4、酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法错误的是
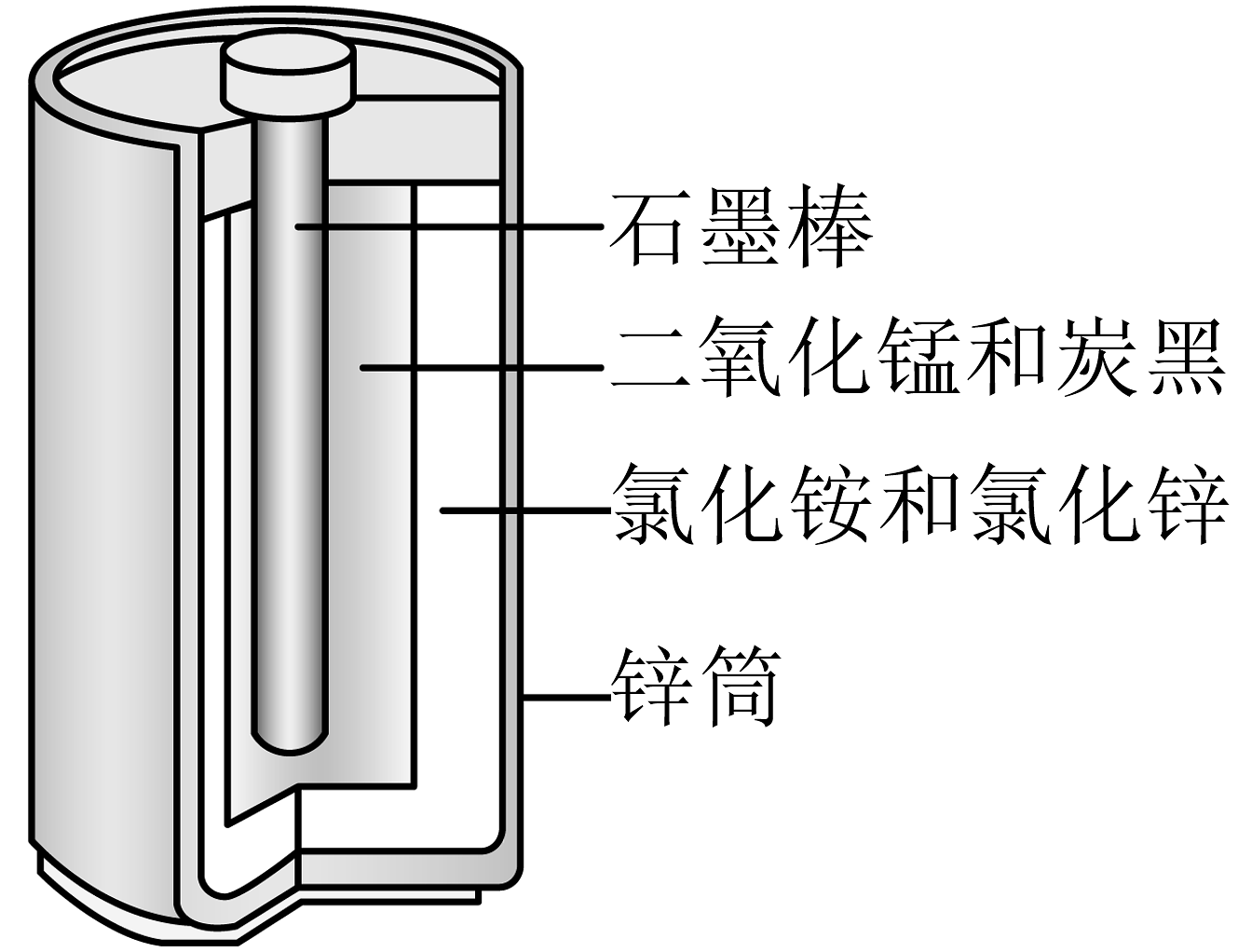 A、石墨作电池的正极材料 B、电池工作时,向正极方向移动 C、发生氧化反应 D、锌筒发生的电极反应为
A、石墨作电池的正极材料 B、电池工作时,向正极方向移动 C、发生氧化反应 D、锌筒发生的电极反应为 -
5、提纯混有少量苯甲酸的苯甲醇(常温为液态,微溶于水)过程如图所示,其中操作为
 A、冷却结晶 B、蒸发结晶 C、蒸馏 D、萃取分液
A、冷却结晶 B、蒸发结晶 C、蒸馏 D、萃取分液 -
6、劳动开创未来,下列劳动项目与所述的化学知识有关联的是
选项
劳动项目
化学知识
A
做水果罐头时加入维生素C
维生素C受热易分解
B
用固体疏通剂处理管道堵塞
C
用除去废水中的
具有很强的还原性
D
用氢氟酸雕刻玻璃花纹
氢氟酸具有弱酸性
A、A B、B C、C D、D -
7、1774年舍勒发现了氯气。下列有关氯气制备的实验装置不正确的是

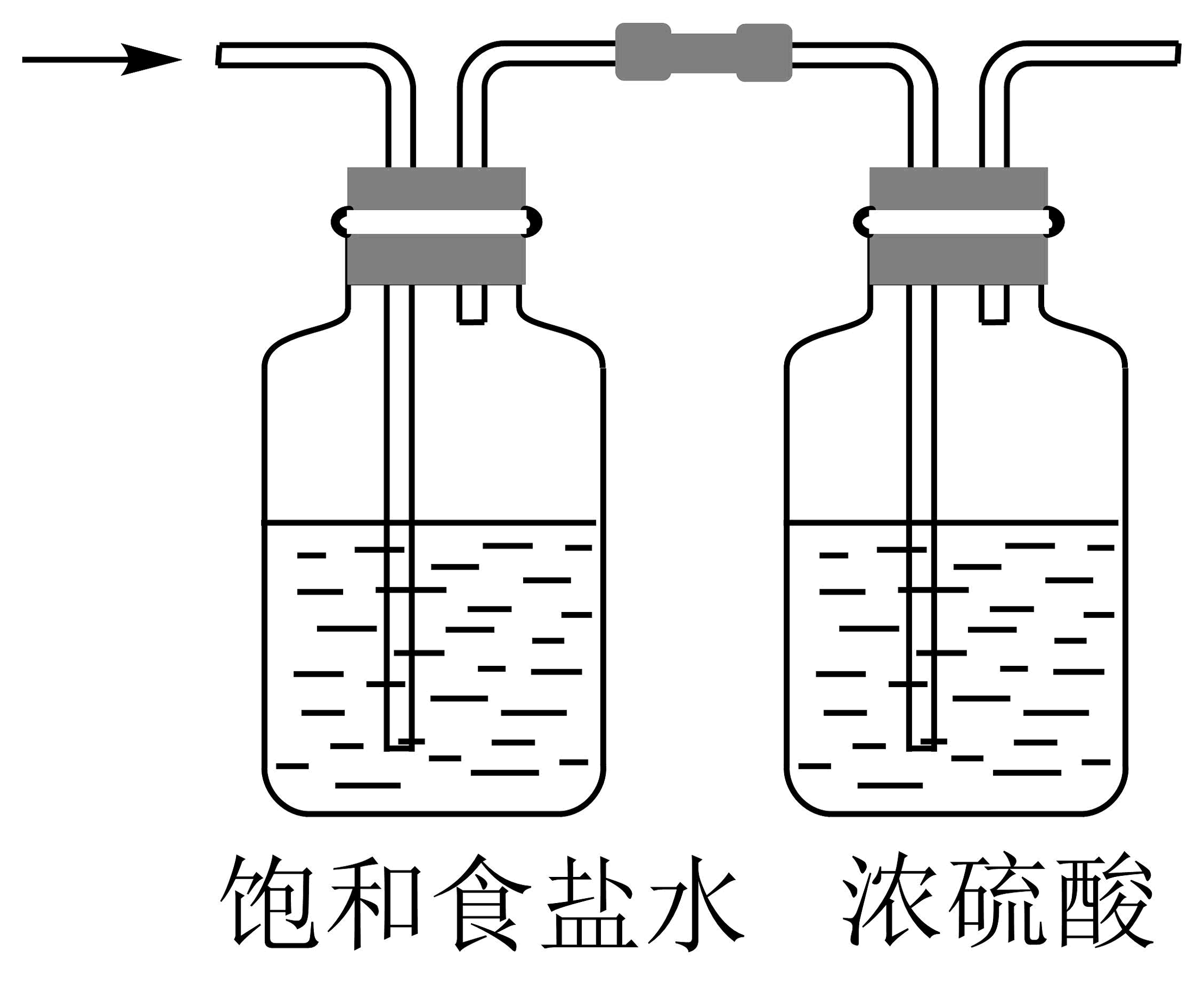
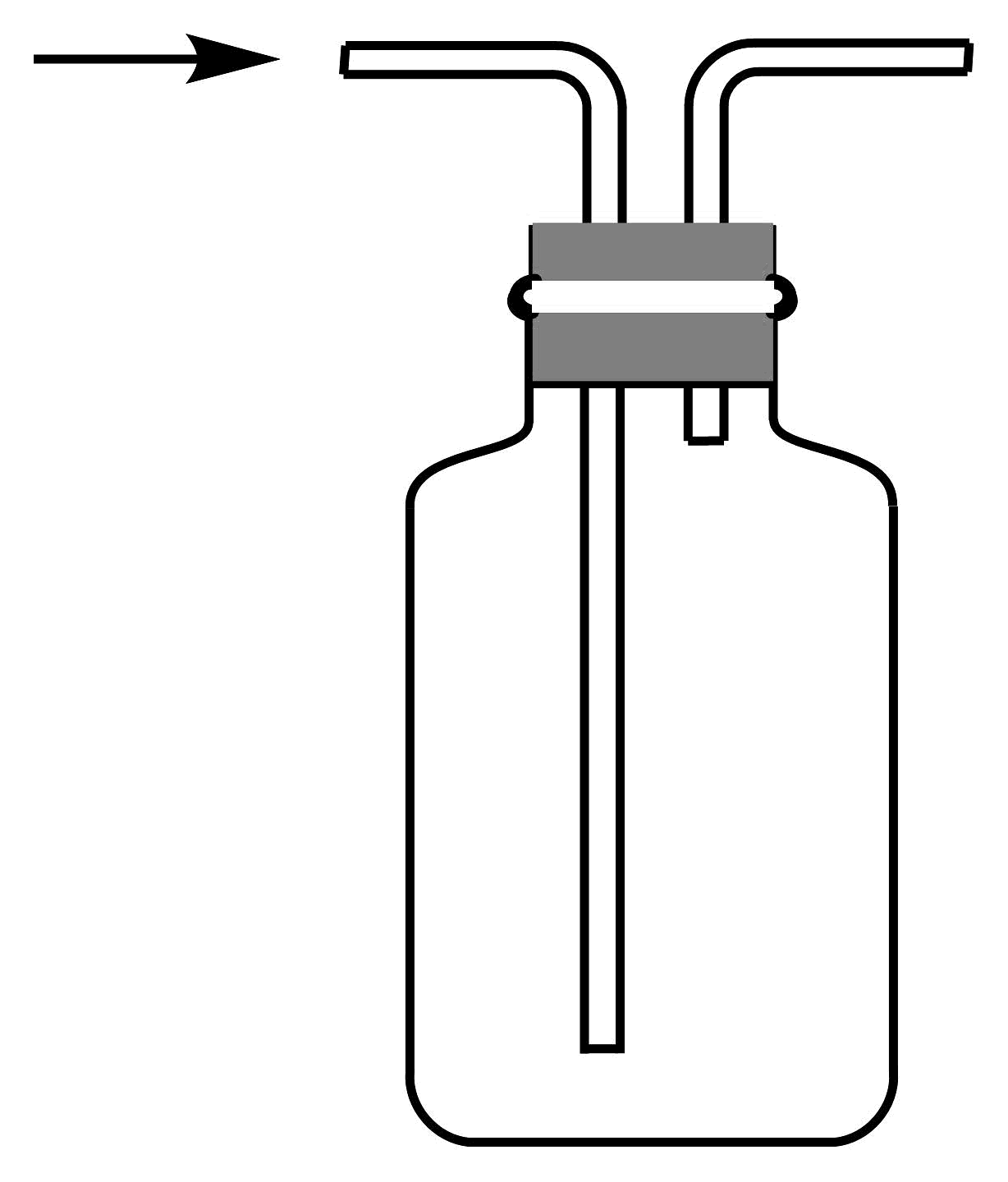

A.制备氯气
B.净化氯气
C.收集氯气
D.尾气处理
A、A B、B C、C D、D -
8、化学助力于人类创造美好生活,下列说法正确的是A、节日里燃放五颜六色的烟花,电子从基态跃迁到激发态以光的形式释放能量 B、传感器测土壤酸碱性,用改善酸性土壤 C、乘氢能源电池公交车出行,沸点低、极易液化 D、锂电池无人机助力现代农业,锂电池放电时化学能转化为电能
-
9、最近,我国在战斗机技术和预警机技术上实现重大跨越,第六代战机歼36试飞成功以及空警3000预警机首次亮相,标志着中国军事力量的全面提升。下列说法正确的是A、钛合金是一种高强度、耐腐蚀的复合材料,钛元素在元素周期表中位于第ⅡB族 B、碳化硅(SiC)是一种耐高温陶瓷材料,属于分子晶体 C、发动机用到的超高温合金含有铌、铁、镍等元素,的中子数为30 D、氢气是战斗机的主要燃料之一,H和D互为同素异形体
-
10、岭南文化源远流长,对社会的发展起着积极的推动作用。下列地方文化涉及的材料不属于有机高分子化合物的是
选项
A
B
C
D
地方文化

顺德木制龙舟

石湾陶塑

广东剪纸

粤剧现代戏服
A、A B、B C、C D、D -
11、有机化合物C和F是制造特种工程塑料的两种重要单体,均可以苯为起始原料按下列路线合成(部分反应步骤和条件略去):

回答下列问题:
(1)、B中含氧官能团名称为 ;B――→C的反应类型为.(2)、已知A―― B反应中还生成(NH4)2SO4和 , 写出A――→B的化学方程式.(3)、脂肪烃衍生物G是C的同分异构体,分子中含有羟甲基 , 核磁共振氢谱有两组峰.G的结构简式为 .(4)、下列说法错误的是 (填标号)a.A能与乙酸反应生成酰胺
b.B存在2种位置异构体
c.D――→E反应中,CCl4是反应试剂
d.E――→F反应涉及取代过程
(5)、4,4'-二羟基二苯砜(H)和F在一定条件下缩聚,得到性能优异的特种工程塑料——聚醚砜醚酮(PESEK).写出PESEK的结构简式 .(6)、制备PESEK反应中,单体之一选用芳香族氟化物F,而未选用对应的氯化物,可能的原因是.(7)、已知酮可以被过氧酸(如间氯过氧苯甲酸,MCPBA)氧化为酯:
参照题干合成路线,写出以苯为主要原料制备苯甲酸苯甲酯的合成路线(其他试剂任选).
-
12、I.通过甲酸分解可获得超高纯度的CO.甲酸有两种可能的分解反应:
(1)、反应的ΔH=(2)、一定温度下,向恒容密闭容器中通入一定量的 , 发生上述两个分解反应下列说法中能表明反应达到平衡状态的是 (填标号).a.气体密度不变
b.气体感压强不变
c.的浓度不变
d.的物质的量相等
(3)、一定温度下,使用某催化剂时反应历程如下图,反应①的选择性接近100%,原因是 ;升高温度,反应历程不变,反应①的选择性下降,可能的原因是.
Ⅱ.甲烷和二氧化碳重整是制取合成气(CO和H2)的重要方法,主要反应有:
③ ④⑤
(4)、恒温恒容条件下,可提高转化率的指施有 (填标号).a.增加原料中的量
b.增加原料中 的量
c.通人Ar气
(5)、恒温恒压密闭容器中,投人不同物质的量之比的//Ar混合气,投料组成与和的平衡转化率之间的关系如下图.
//Ar
i.投料组成中Ar含量下降,平衡体系中的值将 (填“增大 ”“减小”或“不变”).
ii.若平衡时Ar的分压为,根据a、b两点计算反应⑤的平衡常数(用含p的代数式表示,是用分压代替浓度计算的平衡常数,分压=总压×物质的量分数).
-
13、侯氏制碱法以为反应物制备纯碱.某实验小组在侯氏制碱法基础以为反应物,在实验室制备纯碱,步骤如下:
①配制饱和食盐水;
②在水浴加热下,将一定量研细的加入饱和食盐水中,搅拌,使溶解,静置,析出晶体;
③将晶体减压过滤、煅烧,得到固体.回答下列问题:
(1)、步骤①中配制饱和食盐水,下列仪器中需要使用的有 (填名称). (2)、步骤②中需研细后加入,目的是.(3)、在实验室使用代替制备纯碱,优点是.(4)、实验小组使用滴定法测定了产品的成分.滴定过程中溶液的pH随滴加盐酸体积变化的曲线如下图所示
(2)、步骤②中需研细后加入,目的是.(3)、在实验室使用代替制备纯碱,优点是.(4)、实验小组使用滴定法测定了产品的成分.滴定过程中溶液的pH随滴加盐酸体积变化的曲线如下图所示
i.到达第一个滴定终点B时消耗盐酸V1 mL,到达第二个滴定终点C时又消耗盐酸V2 mL,V1=V2.,所得产品的成分为(填标号).
a. Na2CO3
b. NaHCO3
d. Na2CO3和NaOH
c. Na2CO3和NaHCO3
ii.到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓.该同学所记录的V1'V1(填“>”“<”或“=”).
(5)、已知常温下Na2CO3和NaHCO3的溶解度分别为30.7g和10.3g.向饱和Na2CO3溶液中持续通人CO2气体会产生NaHCO3晶体.实验小组进行相应探究:选项 实验操作 实验现象 a 将CO2匀速通入置于烧杯中的20mL和Na2CO3溶液,持续20min。消耗600mL CO2 无明显现象 b 将20mL饱和Na2CO3溶液注入充满CO2的500mL矿泉水瓶中,密闭,剧烈摇动矿泉水瓶1~2min,静置 矿泉水瓶变瘪,3min后开始有白色晶体析出 i.实验a无明显现象的原因是 .
ii.析出的白色晶体可能同时含有.称取0.42g晾干后的白色晶体,加热至恒重,将产生的气体依次通过足量的无水和NaOH溶液,NaOH溶液增重0.088g,则白色晶体中 NaHCO3的质量分数为 .
-
14、某含锶(Sr)废渣主要含有SrSO4、SiO2、CaCO3、SrCO3和MgCO3等,一种提取该废渣中锶的流程如下图所示.

已知25℃时,
回答下列问题:
(1)、锶位于元素周期表第五周期第ⅡA族.基态原子价电子排布式为 .(2)、“浸出液”中主要的金属离子有Sr2+ 、 (填离子符号).(3)、“盐浸”中转化反应的离子方程式为;25℃时,向0.01mol SrSO4粉末中加入100mL 0.11mol▪L-1BaCl2溶液,充分反应后,理论上溶液中= (忽略溶液体积的变化).
(4)、其他条件相同时,盐浸2h,浸出温度对锶浸出率的影响如图1所示.随温度升高锶浸出率增大的原因是. (5)、“漫出渣2”中主要含有 、 (填化学式).(6)、将窝穴体a(结构如图2所示)与形成的超分子加入“浸出液”中,能提取其中的 , 原因是.(7)、由制备无水的最优方法是 (填标号).
(5)、“漫出渣2”中主要含有 、 (填化学式).(6)、将窝穴体a(结构如图2所示)与形成的超分子加入“浸出液”中,能提取其中的 , 原因是.(7)、由制备无水的最优方法是 (填标号).a.加热脱水
b.在 HCl气流中加热
c.常温加压
d.加热加压
-
15、H2A是二元弱酸,M2+不发生水解。25℃时,向足量的难溶盐MA粉末中加入稀盐酸,平衡时溶液中的关系如下图所示.

已知25℃时, , , 下列说法正确的是( )
A、时,MA的溶度积常数 B、pH=1.6时,溶液中 C、pH=4.5时,溶液中 D、pH=6.8时,溶液中 -
16、研究人员开发出一种锂-氢可充电电池(如图所示)使用前需先充电,其固体电解质仅允许Li+通过.下列说法正确的是( )
 A、放电时电解质溶液质量减小 B、放电时电池总反应为 C、充电时 移向惰性电极 D、充电时每转移1mol电子,降低
A、放电时电解质溶液质量减小 B、放电时电池总反应为 C、充电时 移向惰性电极 D、充电时每转移1mol电子,降低 -
17、碘晶体为层状结构,层间作用为范德华力,层间距为.下图给出了碘的单层结构,层内碘分子间存在“卤键”(强度与氢键相近)NA.为阿伏加德罗常数的值.下列说法错误的是( )
 A、碘晶体是混合型晶体 B、液态碘单质中也存在“卤键” C、127g碘晶体中有个“卤键” D、碘晶体的密度为
A、碘晶体是混合型晶体 B、液态碘单质中也存在“卤键” C、127g碘晶体中有个“卤键” D、碘晶体的密度为 -
18、恒温恒压密团容器中t=0时加入A(g),各组分物质的量分数x 随反应时间t变化的曲线如图(反应速率.v=kx , k为反应速率常数).

下列说法错误的是( )
A、该条件下 B、时间段,生成M和N的平均反应速率相等 C、若加入催化剂,增大,不变,则x1和均变大 D、若和均为放热反应,升高温度则 变大 -
19、下列实验操作能达到实验目的的是( )
选项
实验操作
实验目的
A
将铁制镀件与铜片分别接直流电源的正、负极,平行浸入CuSO4溶液中
在铁制镀件表面镀铜
B
向粗盐水中先后加入过量NaCO3溶液、NaOH液和 BaCl2溶液
粗盐提纯中,去除Ca2+、Mg2+和SO42-杂质离子
C
向2mL0.1mol·L-1K2Cr2O7溶液中滴加5滴6mol·L-1NaOH溶液,再滴加5滴6mol·L-1H2SO4溶液
探究c(H+)对如下平衡的影响:Cr2O72-+H2O ==2CrO42-+ 2H+
(橙色) (黄色)
D
将有机物M溶于乙醇,加入金属钠
操究M中是否含有羟基
A、A B、B C、C D、D -
20、某化合物的结构如图所示.W、X、Y、Z是原子序数依次增大的短周期元素,其中X、Z位于同一主族.下列说法错误的是( )
 A、元素电负性:X>Z>Y B、该物质中Y和Z均采取sp3 杂化 C、基态原子未成对电子数:W<X<Y D、基态原子的第一电离能:X>Z>Y
A、元素电负性:X>Z>Y B、该物质中Y和Z均采取sp3 杂化 C、基态原子未成对电子数:W<X<Y D、基态原子的第一电离能:X>Z>Y