相关试卷
-
1、工业上利用黑钨矿(其主要成分是FeWO4、MnWO4 , 还含有少量SiO2和Al2O3)制备钨的工艺流程如下图所示:

已知:①上述流程中,钨的化合价只在最后一步发生改变;②常温下钨酸难溶于水。回答下列问题:
(1)、已知元素钨与铬同族,钨在元素周期表中的位置是第六周期第族,其位于元素周期表区。(2)、提高黑钨矿“焙烧”效率的措施有(任写一条),FeWO4在“焙烧”过程中发生反应的化学方程式为。(3)、“滤渣”的主要成分是(填化学式)。(4)、钨酸钙(CaWO4)和氢氧化钙都是微溶电解质。某温度下Ca(OH)2和CaWO4的饱和溶液中,pc(Ca2+)与pc(阴离子)的关系如图所示,已知:pc(离子)=-lgc(离子)。该温度下将Na2WO4溶液加入石灰乳中得到大量钨酸钙,发生反应的离子方程式为 , 该反应的平衡常数K=。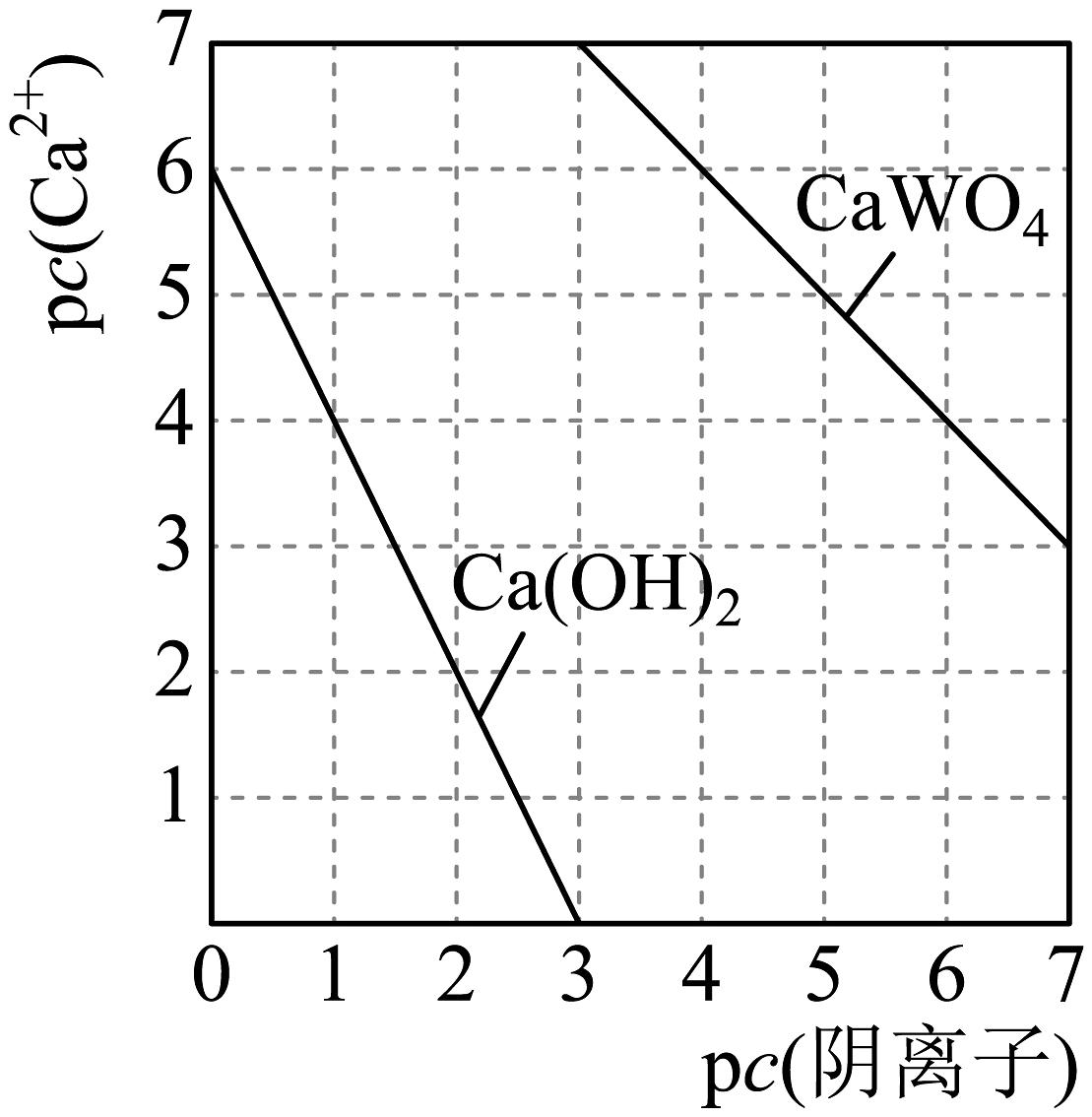 (5)、合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示(已知:Mn原子和Al原子位于Cu原子所构成的八个小正方体的体心)。
(5)、合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示(已知:Mn原子和Al原子位于Cu原子所构成的八个小正方体的体心)。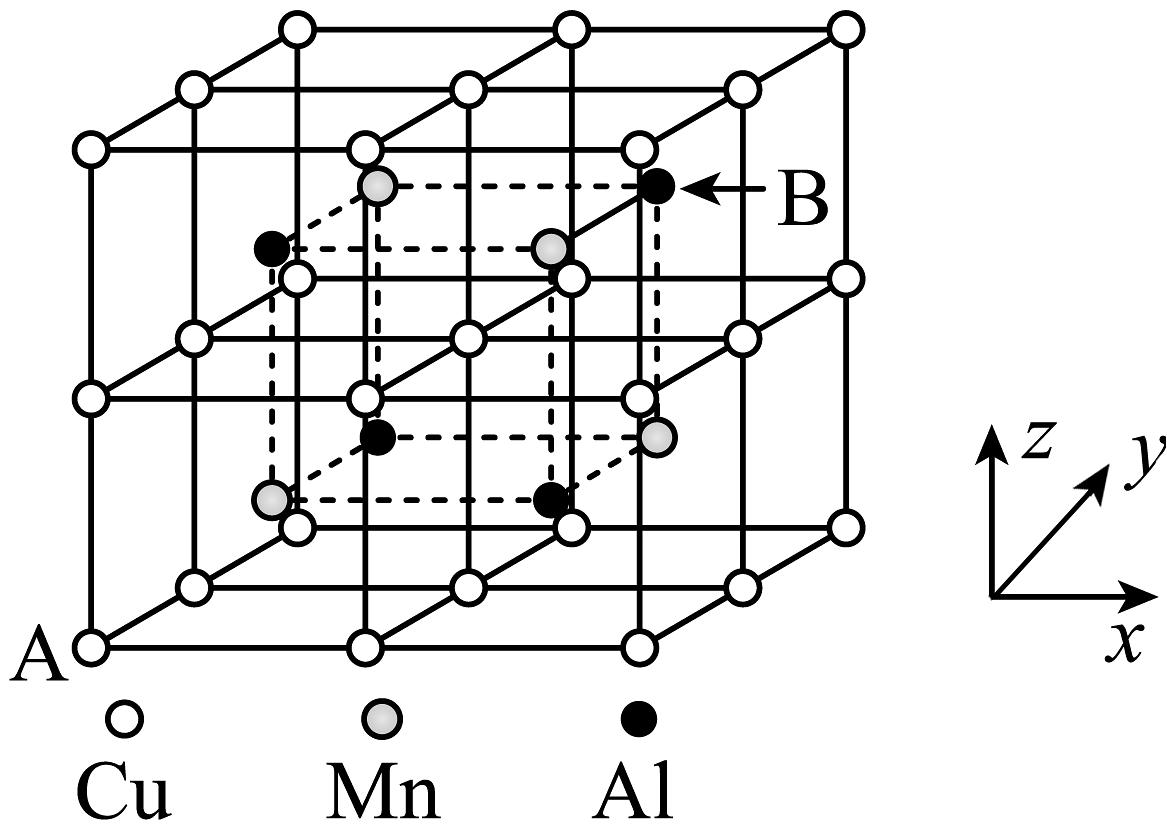
①若A原子的坐标参数为(0,0,0),则B原子的坐标参数为。
②已知该合金晶体的密度为pg·cm-3 , 则最近的两个Al原子间的距离为pm(列出计算式,阿伏加德罗常数的值用NA表示)。
-
2、苯酚能与形成的紫色配合物,该过程属于可逆反应。某小组同学探究铁离子与苯酚的反应。(1)、配制100mL0.1mol/L苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管和。(2)、探究铁盐种类和pH对苯酚与显色反应的影响。查阅资料:
ⅰ.对苯酚与的显色反应无影响;
ⅱ.小组同学得出猜想对与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是。
ⅲ.对特定波长光的吸收程度(用吸光度A表示)与浓度在一定范围内成正比。
提出猜想:猜想1:对苯酚与的显色反应有影响
猜想2:对苯酚与的显色反应有影响
进行实验:常温下,用盐酸调节pH,配制得到pH分别为a和b的0.1mol/L溶液();用硫酸调节pH,配制得到pH分别为a和b的0.05mol/L溶液。取4支试管各加入5mL0.1mol/L苯酚溶液,按实验1~4分别再加入0.1mL含的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对水解程度的影响可忽略)。

序号
含的试剂
吸光度
0.1mol/L溶液
0.05mol/L溶液
1
/
Al
2
/
A2
3
/
A3
4
/
A4
结果讨论:实验结果为
①根据实验结果,小组同学认为此结果不足以证明猜想“对与苯酚的显色反应有抑制作用”成立的理由是。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为。

序号
含Fe的试剂
再加入的试剂
吸光度
0.1mol/L溶液
0.05mol/L溶液
5
/
NaCl固体
A5
6
/
试剂M
A6
③根据实验1~6的结果,小组同学得出猜想1不成立,猜想2成立,且对苯酚与的显色反应起抑制作用,得出此结论的实验依据是:、AlA6(填“>”、“<”或“=”)。
(3)、通过以上实验结论分析:与苯酚相比,对羟基苯甲酸与溶液发生显色反应。(填“更容易”或“更难”)(4)、实验室中常用某些配合物的性质进行物质的检验,请举一例子并说明现象。 -
3、大苏打(Na2S2O3)、苏打(Na2CO3)和小苏打(NaHCO3)被誉为“苏氏三兄弟”,在生产、生活中应用广泛。下列离子方程式不正确的是A、用MnSO4和NaHCO3反应制备MnCO3:Mn2++2=MnCO3↓+CO2↑+H2O B、用Na2S2O3溶液吸收尾气中的Cl2:5H2O+4Cl2+=2+8Cl-+10H+ C、生活中常用泡沫灭火器灭火:2Al3++3+3H2O=2Al(OH)3↓+3CO2↑ D、用Na2S2O3与盐酸反应测反应速率:+2H+=SO2↑+S↓+H2O
-
4、已知二氧化氯(ClO2)为新型绿色消毒剂,沸点为9.9℃,可溶于水、有毒,浓度较高时易发生爆炸。利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置如图所示。

下列说法正确的是
A、实验中通入CO2气体的速率应尽可能慢 B、装置乙中应使用热水浴,以加快反应速率 C、为配制分液漏斗中的混合液,应将甲醇溶液倒入浓硫酸中搅拌 D、若装置甲烧瓶内氧化产物为HCOOH,则氧化剂与还原剂的物质的量之比为4∶1 -
5、下列陈述I与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述I
陈述Ⅱ
A
1mol
 可以和3mol氢气加成
可以和3mol氢气加成1mol
 中含有3mol碳碳双键
中含有3mol碳碳双键B
石墨的硬度比金刚石小很多
石墨中共价键的键能比金刚石小
C
二氧化硫可以使高锰酸钾溶液褪色
二氧化硫具有漂白性
D
酸性:甲酸>乙酸>丙酸
烷基越长推电子效应越大
A、A B、B C、C D、D -
6、实验室可利用反应MnO2+2KBr+3H2SO4MnSO4+2KHSO4+Br2+2H2O制备Br2。设NA代表阿伏加德罗常数的值。下列说法正确的是A、0℃、101kPa下,11.2LH2O所含的分子数为0.5NA B、9.8gH2SO4和H3PO4混合物中含氧原子数为0.4NA C、该反应中生成0.2molBr2时,转移的电子数为0.2NA D、0.1mol/L的KHSO4溶液中含有的离子数为0.3NA
-
7、部分含S(a、b、c、d)和Cl(e、f、g、h)的物质分类与相应化合价的关系如图所示。下列说法正确的是
 A、向h的溶液中通入c,溶液的酸性增强 B、b或f与金属Cu反应的产物中Cu的化合价均为+2 C、d的浓溶液因具有脱水性使胆矾晶体由蓝色变为白色 D、c和g都能使湿润的蓝色石蕊试纸先变红后褪色
A、向h的溶液中通入c,溶液的酸性增强 B、b或f与金属Cu反应的产物中Cu的化合价均为+2 C、d的浓溶液因具有脱水性使胆矾晶体由蓝色变为白色 D、c和g都能使湿润的蓝色石蕊试纸先变红后褪色 -
8、从中草药中提取的calebinA(结构简式如下图)可用于治疗阿尔茨海默症。下列关于calebinA的说法正确的是
 A、该物质在空气中能长时间保存 B、该物质能使高锰酸钾溶液褪色 C、该物质能与溶液反应生成 D、1mol该物质与浓溴水反应,最多消耗2mol
A、该物质在空气中能长时间保存 B、该物质能使高锰酸钾溶液褪色 C、该物质能与溶液反应生成 D、1mol该物质与浓溴水反应,最多消耗2mol -
9、将一块镀层破损的铁片置于海边潮湿环境中,一段时间后铁片如图所示。下列说法正确的是
 A、电子由镀层流向铁 B、铁片凹陷深处产生了较多OH- C、镀层的金属性比铁弱 D、对铁进行了牺牲阳极的阴极保护
A、电子由镀层流向铁 B、铁片凹陷深处产生了较多OH- C、镀层的金属性比铁弱 D、对铁进行了牺牲阳极的阴极保护 -
10、下列制备实验中,实验装置及操作均正确的是

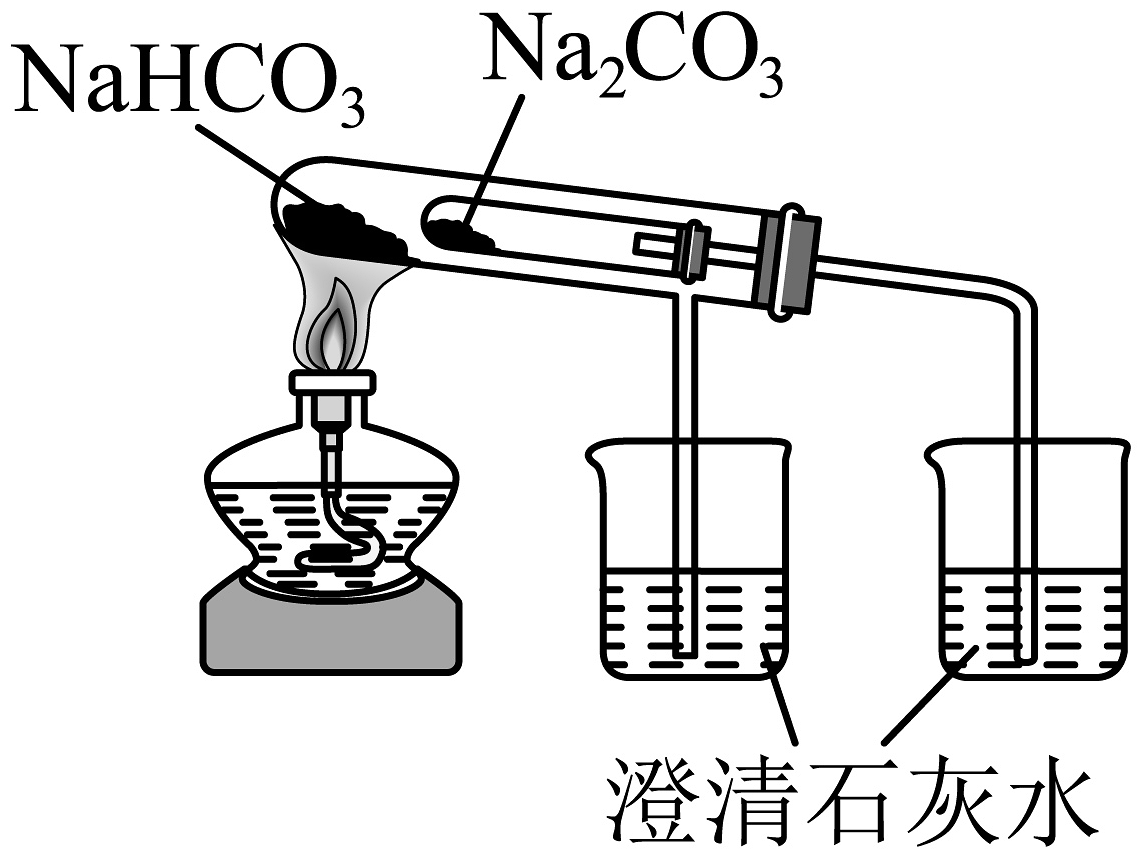
A.用高锰酸钾标准溶液滴定草酸溶液
B.探究苏打和小苏打的稳定性
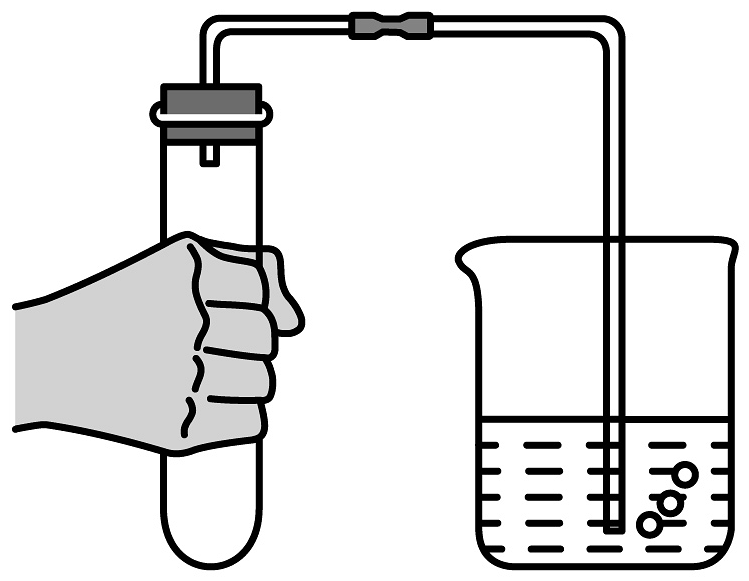
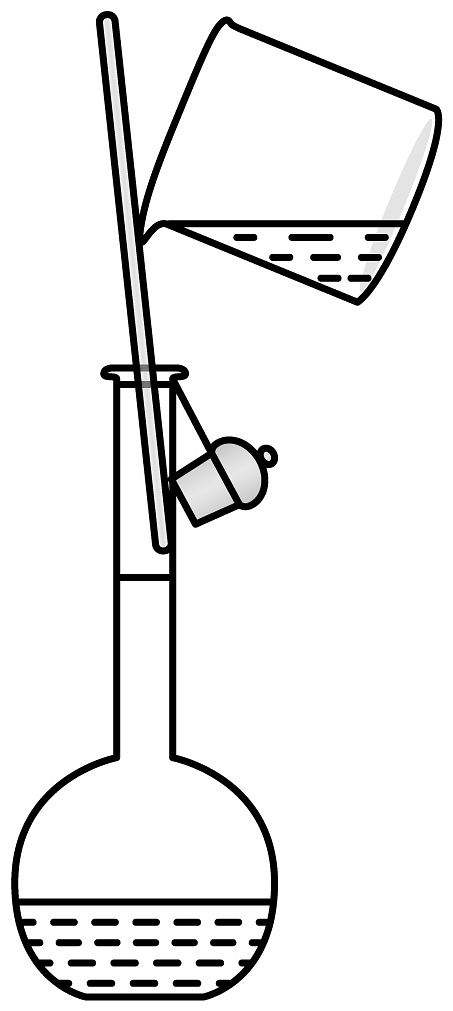
C.检验装置气密性
D.溶液转移
A、A B、B C、C D、D -
11、勤劳致富,越努力越幸福。下列项目与所述的化学知识没有关联的是
选项
生产活动
化学原理
A
冬季来临时,用石灰浆涂抹树皮
石灰浆可以减少植物光合作用
B
新会陈皮年份越陈,香气越浓郁
气味的来源之一柠檬烯具有果香味道
C
碳酸氢铵可用作饼干的膨松剂
碳酸氢铵中和酸且受热易分解产生气体
D
煮豆浆点卤水制作豆腐
胶体聚沉
A、A B、B C、C D、D -
12、化学处处呈现美。下列说法正确的是A、环己烷呈现对称美,分子中六个碳原子连接呈环,呈平面正六边形结构 B、S8分子呈现“皇冠”结构,分子中的硫原子通过共价键结合,S8属于共价晶体 C、霓虹灯发出五颜六色的光,该过程属于化学变化 D、锌片在AgNO3溶液中生成“银树”,反应中锌被氧化
-
13、化学和生活、科技、社会发展息息相关。下列说法正确的是A、太阳能电池使用的材料是半导体,其主要成分是 B、“深海一号”母船海水浸泡区镶上铝基是利用了牺牲阳极的金属防腐原理 C、巴黎奥运会场馆使用的“碲化镉”光伏发电系统将化学能转化为电能 D、“三元催化器”将汽车尾气中NO和CO转化为和 , 有利于实现碳中和
-
14、世界文明史上,中华文化是世界上唯一从未间断的文明,始终显示出顽强的生命力和无穷的魅力。下列文物主要由硅酸盐材料制成的是




A.东汉青铜奔马“马踏飞燕”
B.唐代“鎏金舞马衔杯纹银壶”
C.秦“兵马俑”
D.仅49g的西汉“直裾素纱禅衣”
A、A B、B C、C D、D -
15、利用如图实验装置进行相应实验,能达到实验目的的是


A.可用于制备和收集
B.可测定在催化作用下的分解速率


C.除去乙烷中的乙烯
D.实现化学能转化为电能
A、A B、B C、C D、D -
16、阿斯巴甜是一种非碳水化合物类的人造甜味剂,其甜味高和热量低,主要添加于饮料、维他命含片或口香糖中代替糖的使用。一种合成阿斯巴甜(G)的路线如下:

回答下列问题:
(1)、A的名称为 , G中含氧官能团名称为。(2)、标出阿斯巴甜( )中所有的手性碳原子(用*标注)。 (3)、A→B的反应类型为 , C的结构简式为。(4)、E→G的化学方程式为。(5)、B有多种同分异构体,符合下列条件的有种,写出核磁共振氢谱中有5组峰且峰面积之比为的结构简式为。
)中所有的手性碳原子(用*标注)。 (3)、A→B的反应类型为 , C的结构简式为。(4)、E→G的化学方程式为。(5)、B有多种同分异构体,符合下列条件的有种,写出核磁共振氢谱中有5组峰且峰面积之比为的结构简式为。①与B含有相同官能团;②苯环上有2个取代基。
-
17、天然气开采过程中普遍混有 , 它会腐蚀管道等设备,必须予以去除。工业上,和重整制氢的反应为:
 (1)、反应的(用代数式表示),在恒温恒容条件下,该反应达到平衡状态的判断依据是(填标号)。
(1)、反应的(用代数式表示),在恒温恒容条件下,该反应达到平衡状态的判断依据是(填标号)。A.混合气体密度不变 B.容器内压强不变
C. D.与的物质的量分数之比保持不变
(2)、和重整制氢的反应在金属硫化物的催化下进行,机理如图1所示。判断物质X、Y分别为和。 (3)、为了研究甲烷对制氢的影响,原料初始组成 , 保持体系压强为100kPa,反应达到平衡时,四种组分的物质的量分数随温度的变化如图2所示。
(3)、为了研究甲烷对制氢的影响,原料初始组成 , 保持体系压强为100kPa,反应达到平衡时,四种组分的物质的量分数随温度的变化如图2所示。
①图中曲线c表示的物质是。
②M点对应温度下,的转化率为 , N点对应的(以分压表示,分压=总压×物质的量分数)。
-
18、一种工业污泥含 , 以该工业污泥为原料提取Ni及其他化工原料的工艺流程如图所示:

已知:、。
回答下列问题:
(1)、“酸浸”中反应的化学方程式为;“滤渣1”的主要成分含有(填化学式)。(2)、“反应ⅰ”中,加入适量的 , 其目的:①使还原为;②。(3)、“反应ⅱ”中加入双氧水的目的为(用离子方程式表示)。(4)、“除铁”后所得滤液中的溶质有、(填化学式);“电解”时,用惰极电极电解,阴极析出金属Ni,阴极的电极反应式为。(5)、镍能形成多种配合物,其中是无色挥发性液体,是红黄色单斜晶体。的熔点高于的原因是。晶体中不存在的作用力有(填标号)。A.离子键 B.范德华力 C.极性键 D.金属键
-
19、十二钨硅酸[ , ]是一种环境友好型催化剂。可采用下列实验装置和实验步骤制备少量十二钨硅酸。已知:①乙醚沸点为34.6℃,密度小于水,有毒,微溶于水;②强酸条件下,十二钨硅酸与乙醚形成密度大于水且难溶于水的油状醚合物;③制备过程中反应体系pH过低会产生钨的水合氧化物沉淀。
【实验装置】

【实验步骤】
ⅰ.称取于三颈烧瓶中,加入20mL蒸馏水溶解,启动磁力加热搅拌器,使温度保持在60℃左右。
ⅱ.用10mL温度为60℃的蒸馏水溶解(过量),逐滴滴入三颈烧瓶中至全部滴完。
ⅲ.再向恒压分液漏斗中加入10mL浓盐酸,先用10min向三颈烧瓶逐滴滴入2mL浓盐酸,再用15min滴入剩余的浓盐酸,搅拌反应液30min。
ⅳ.将全部反应混合液转移至分液漏斗中,加入乙醚,再分多次加入浓盐酸,充分振荡,萃取,静置;将油状醚合物转移至蒸发皿,加少量水,水浴蒸发至溶液表面有晶膜出现,冷却结晶、抽滤、洗涤、干燥,得纯净产品7.44g。回答下列问题:
(1)、仪器a的名称是 , 其进水口为(填“b”或“c”)。(2)、中钨元素的化合价是价。(3)、生成十二钨硅酸的化学方程式是。(4)、“步骤ⅲ”采用较长时间逐滴滴入浓盐酸,而不是一次性加入,原因是。(5)、“步骤ⅳ”加入乙醚、浓盐酸萃取静置后,油状醚合物从分液漏斗的口取出(填“上”或“下”),不能改用乙醇作为萃取剂的原因是。(6)、理论上十二钨硅酸的产率为%。 -
20、戊二酸(用表示)易溶于水,向溶液中加入NaOH固体,保持溶液为常温,忽略溶液体积的变化,过程中测得pX随溶液pH的变化如图所示。已知:[X为]。下列说法错误的是
 A、曲线Ⅱ为随pH的变化曲线 B、开始时,戊二酸溶液的浓度 C、时, D、戊二酸的
A、曲线Ⅱ为随pH的变化曲线 B、开始时,戊二酸溶液的浓度 C、时, D、戊二酸的