相关试卷
-
1、一种氮掺杂碳材料用于碱性溶液中电催化N2合成NH3 , 工作原理如图所示,常温常压下NH3产率达到3.4μmol·h-¹。下列有关说法正确的是
 A、N2发生氧化反应 B、将化学能转化为电能 C、这是一种新型的人工固氮技术 D、该条件下O2产率为3.4μmol·h-¹
A、N2发生氧化反应 B、将化学能转化为电能 C、这是一种新型的人工固氮技术 D、该条件下O2产率为3.4μmol·h-¹ -
2、椰汁马蹄糕是广东名小食,主要原料有椰浆、马蹄粉和白砂糖。下列说法正确的是A、椰浆含有的椰子油属于高分子化合物 B、马蹄粉是一种食用淀粉,与纤维素属于同分异构体 C、白砂糖的主要成分是蔗糖,蔗糖可以发生水解反应 D、在蒸制椰汁马蹄糕的过程中,只发生了蛋白质变性
-
3、化学之美无处不在。下列说法正确的是A、绚丽的焰火与电子跃迁时产生的吸收光谱有关 B、水可形成晶莹剔透的晶体,可燃冰中存在氢键 C、手性分子互为镜像,能在三维空间里叠合 D、呈现规则多面体外形的金刚石为分子晶体
-
4、“月背采壤”“六代机首飞”等彰显了我国科技发展的巨大成就。下列说法正确的是A、嫦娥六号智能月背采壤:采壤过程中月壤发生化学变化 B、首款600公斤推力涡扇发动机成功点火:点火时存在化学能转化为热能 C、第六代战机采用“智能皮肤”隐身技术:所用陶瓷基复合新材料属于合金 D、076型两栖攻击舰采用柴燃联合动力:柴油、天然气属于烃的衍生物
-
5、“伏羲画卦,仓颉造字”开书画先河。下列颜料主要成分属于无机物的是


A.从赤铁矿中提取的赭石
B.由蓼蓝叶制成的花青


C.由红蓝花制成的胭脂
D.从海藤中提取的藤黄
A、A B、B C、C D、D -
6、不饱和酯类化合物在药物、涂料等领域应用广泛。一种由烯烃直接制备不饱和酯的新方法如下:
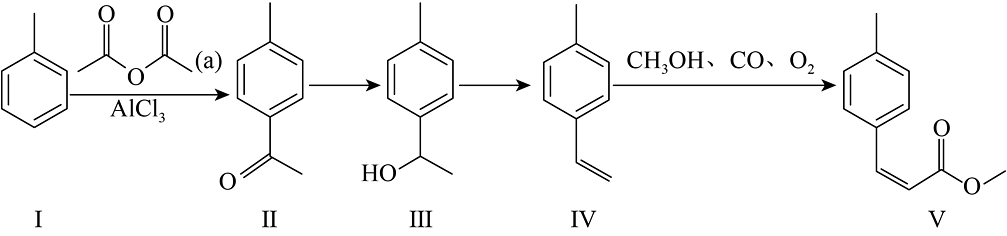 (1)、化合物I的分子式为 , 化合物Ⅳ的名称为。(2)、化合物Ⅱ中的官能团名称是。化合物Ⅱ的某种同分异构体含有苯环,在核磁共振氢谱图上只有4组峰,其结构简式为(写一种)。(3)、根据化合物Ⅲ的结构特征,分析预测其可能的化学性质,完成下表。
(1)、化合物I的分子式为 , 化合物Ⅳ的名称为。(2)、化合物Ⅱ中的官能团名称是。化合物Ⅱ的某种同分异构体含有苯环,在核磁共振氢谱图上只有4组峰,其结构简式为(写一种)。(3)、根据化合物Ⅲ的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新物质
反应类型
a
Ⅱ
b
取代反应
(4)、关于上述合成路线图中相关物质及转化,下列说法中正确的是______。A、化合物种物质中所有碳原子均可共平面 B、化合物可表示为: , 则化合物b为乙酸 C、化合物Ⅱ的沸点比Ⅲ低,因为Ⅲ存在分子间氢键 D、化合物的转化中,存在原子杂化方式的转变(5)、以化合物Ⅱ为原料,用两步原子利用率为的反应制备 , 第一步试剂为极性分子(填分子式,下同),第二步试剂为非极性分子。 (6)、参考上述流程,用溴乙烷为唯一有机原料合成聚合物涂料
, 第一步试剂为极性分子(填分子式,下同),第二步试剂为非极性分子。 (6)、参考上述流程,用溴乙烷为唯一有机原料合成聚合物涂料 的单体,基于你设计的合成路线,回答下列问题:
的单体,基于你设计的合成路线,回答下列问题:①有CO参与反应的化学方程式为(不用注明反应条件)。
②第一步反应的化学方程式为(写一个即可,注明反应条件)。
-
7、
Ⅰ.二氧化碳的高效转化与利用是当前研究热点,以下是某研究团队设计的二氧化碳加氢制甲醇的工艺过程。
反应1:
反应2:
(1)已知: , 则________。
(2)一定温度下,和在恒压的密闭容器中仅发生反应1和反应2,测得平衡时的转化率、和CO的选择性随温度的变化曲线如图所示。
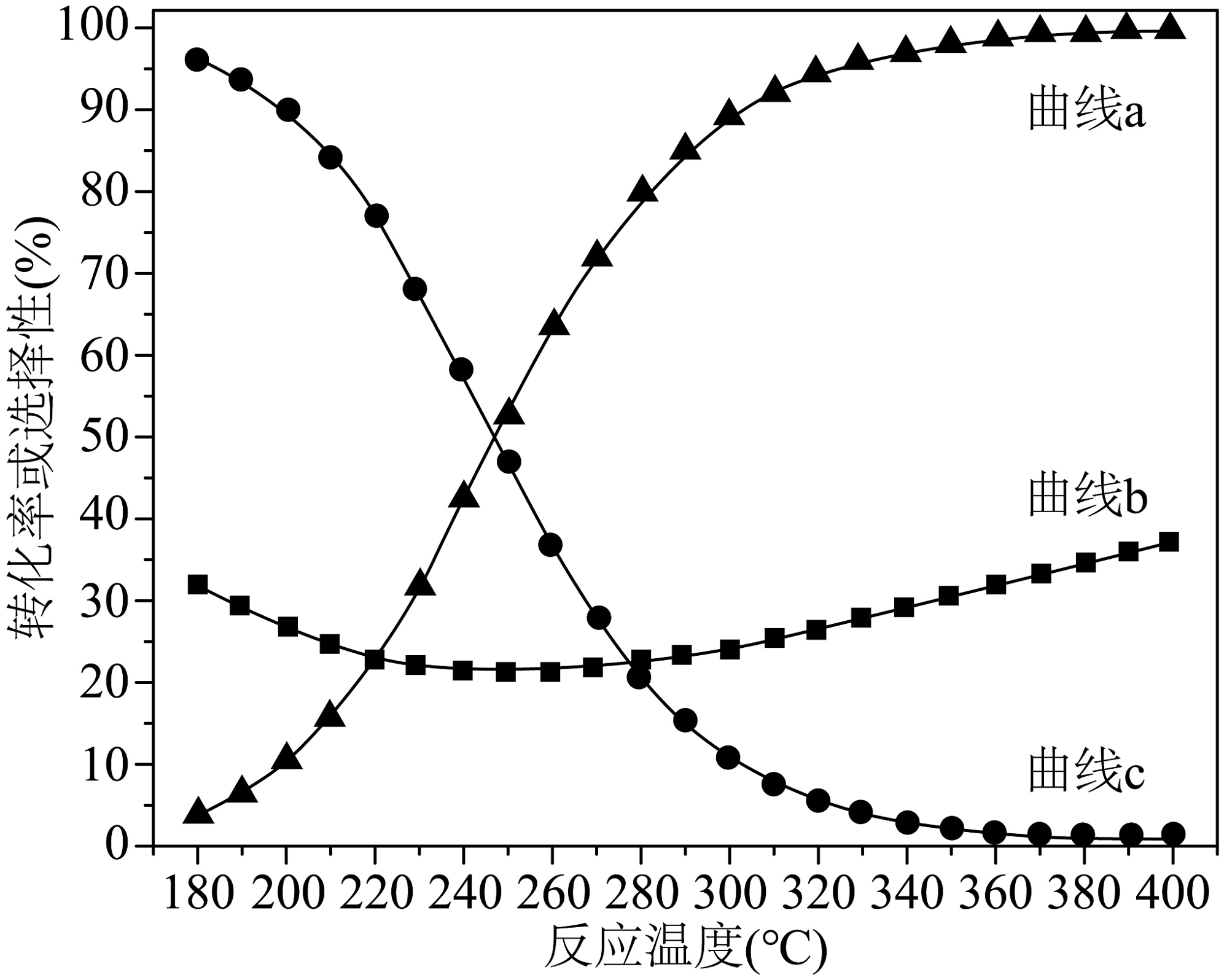
[物质A的选择性]
①图中曲线a表示________。
②某温度下,反应10min后测得容器中的体积分数为 , 则内________。
③试利用平衡移动原理解释曲线b的变化趋势________。
(3)关于上述反应体系的说法,正确的是______(填标号)。
A. 升高温度,反应1速率增大,反应2速率减小 B. 增大压强,既能提高的平衡转化率,又能提高的选择性 C. 使用合适的催化剂可降低反应1的活化能,提高的平衡产率 D. 恒温恒压下通入惰性气体,平衡时的物质的量减少 Ⅱ.在空气和溶液之间存在如下平衡关系:
反应3:代表标准浓度,为代表标准压强,为100kPa.)
反应4:
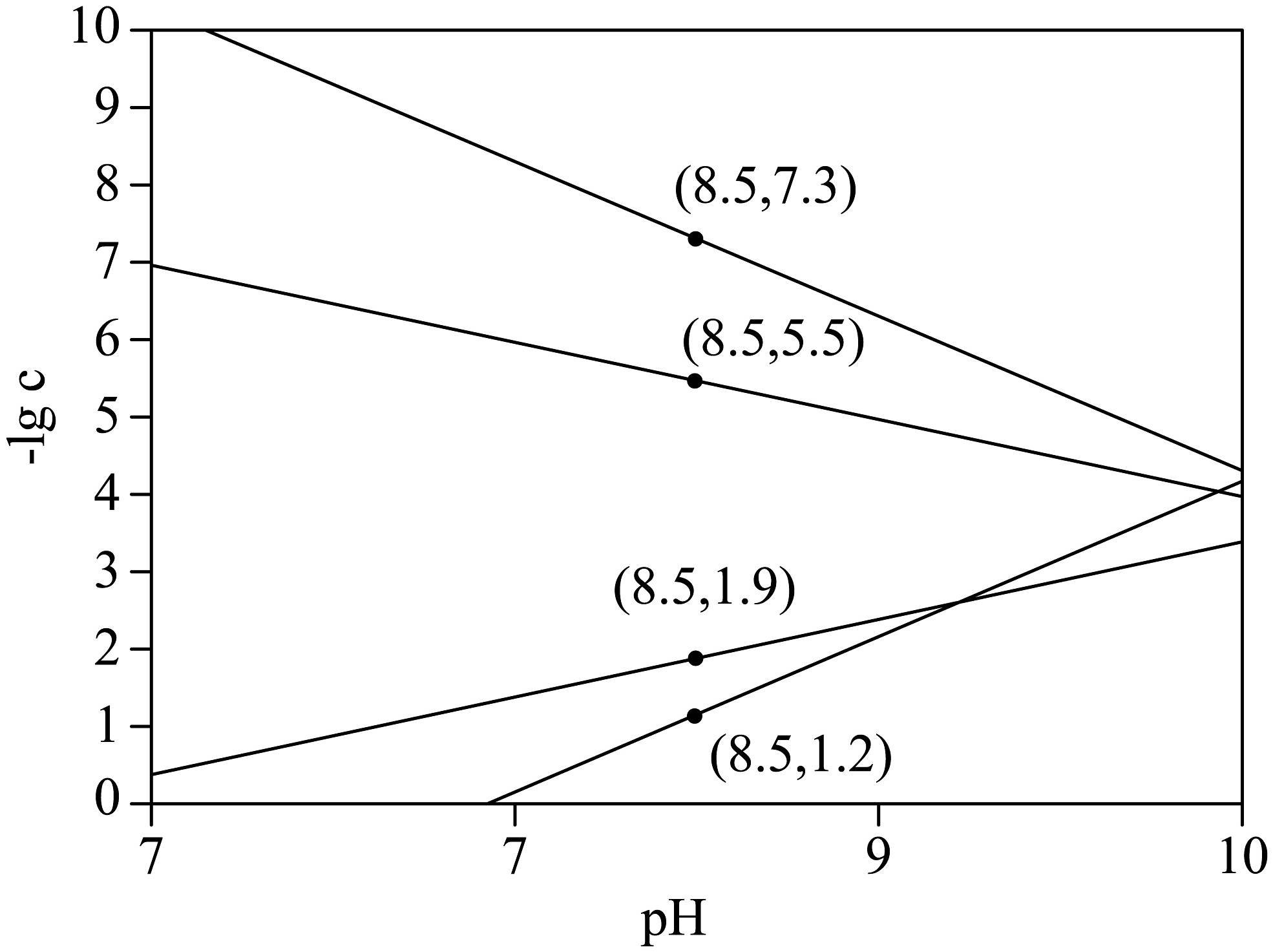
(4)将含有的溶液敞口放在空气中,始终保持空气中分压不变,通过调节溶液pH使形成碳酸盐沉淀,体系中pH与-关系如图所示代表的浓度,单位为)。
①随pH增大,溶液中将________。(填“增大”、“减小”或“不变”)
②结合图中数据计算:________。
-
8、漂浮阳极泥是电解精炼铜过程中产生的含砷(As)、锑(Sb)、铋(Bi)较高的金银物料,具有较大的回收价值。一种从漂浮阳极泥中富集金银并回收的工艺如下。
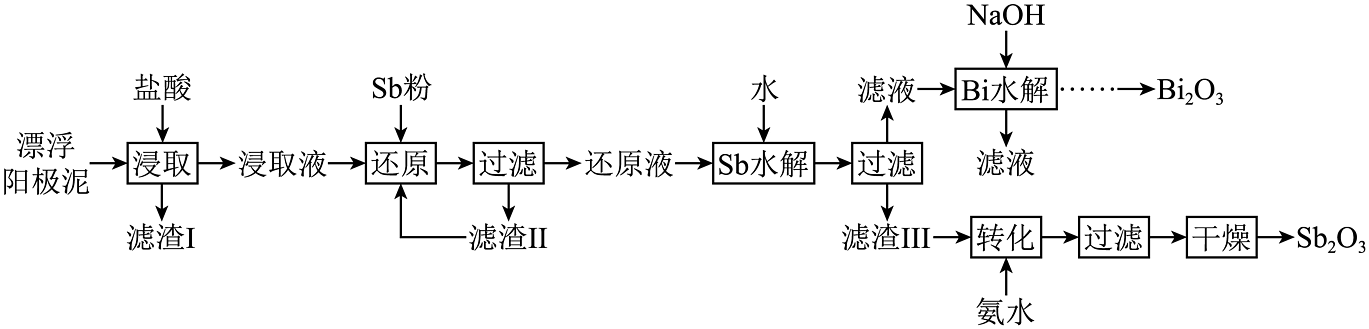
已知:①浸取液中的主要存在形式为;其中,与易浸出,而正五价的锑大多以难溶物形式存在,温度较高时逐步溶解。
②pH不同时,水解固体产物可能有或;
③。
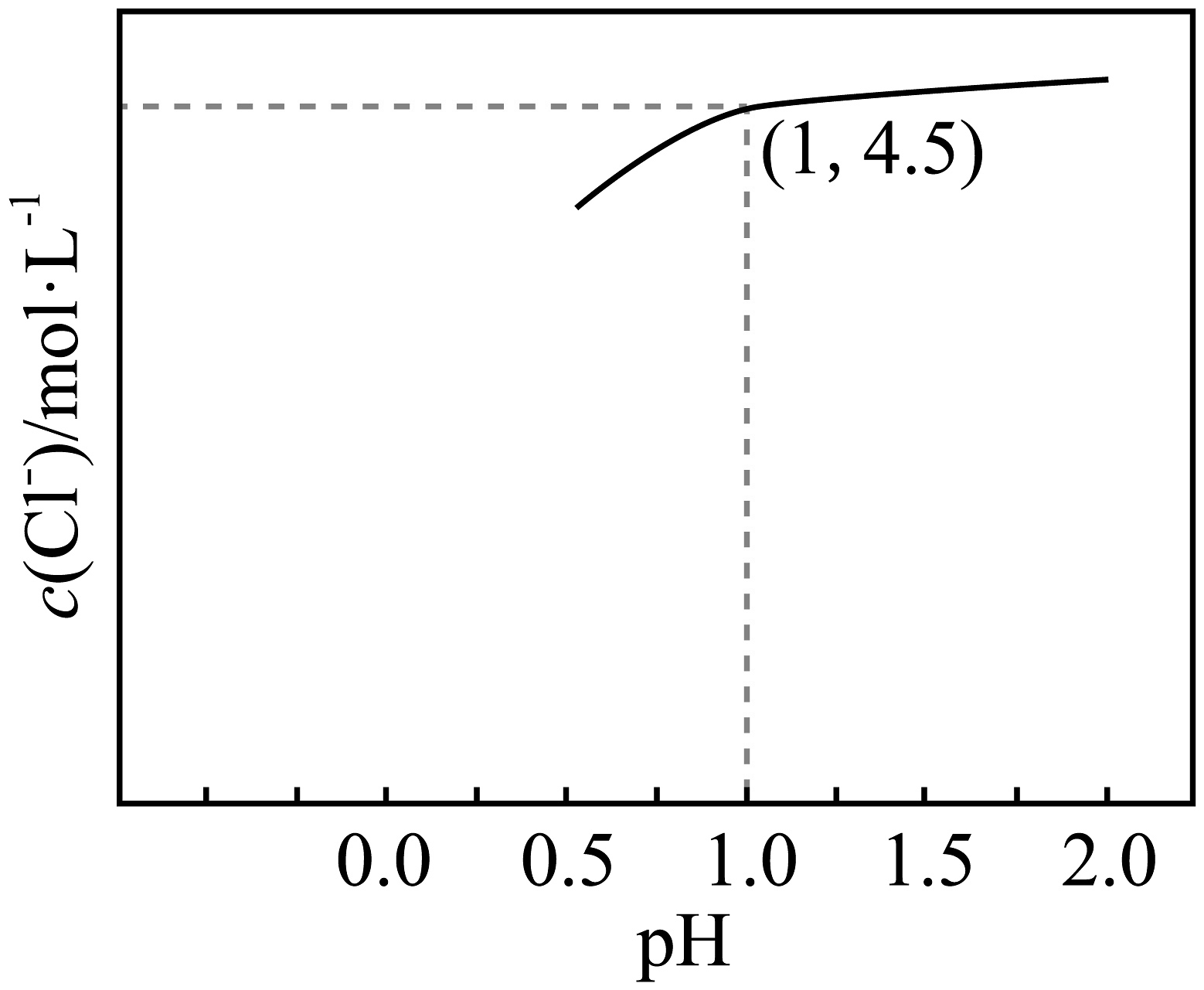
(1)、提高“浸取”率的方法是 , “浸取”过程中,需控制温度约为 , 其原因是。(2)、“还原”时,Sb将还原为 , 该反应的氧化剂与还原剂的物质的量之比为。(3)、①“Sb水解”过程中,初始锑浓度为 , 氯离子浓度为5 , 溶液中游离氯离子浓度随pH变化图像如图所示,维持pH的状态下,水解过程的离子方程式为。②“Sb水解”过程中,溶液中与水解液中的形成复杂的砷酸盐沉淀,调节pH不小于(保留小数点后1位),可使溶液中。
 (4)、“转化”过程中存在多步反应,其中由生成的离子方程式为。(5)、的立方晶胞结构如图所示占据部分Bi的四面体空隙),已知晶胞边长为点坐标为(点坐标为 , 则B点到C点的距离为nm,晶胞密度为的摩尔质量为)。
(4)、“转化”过程中存在多步反应,其中由生成的离子方程式为。(5)、的立方晶胞结构如图所示占据部分Bi的四面体空隙),已知晶胞边长为点坐标为(点坐标为 , 则B点到C点的距离为nm,晶胞密度为的摩尔质量为)。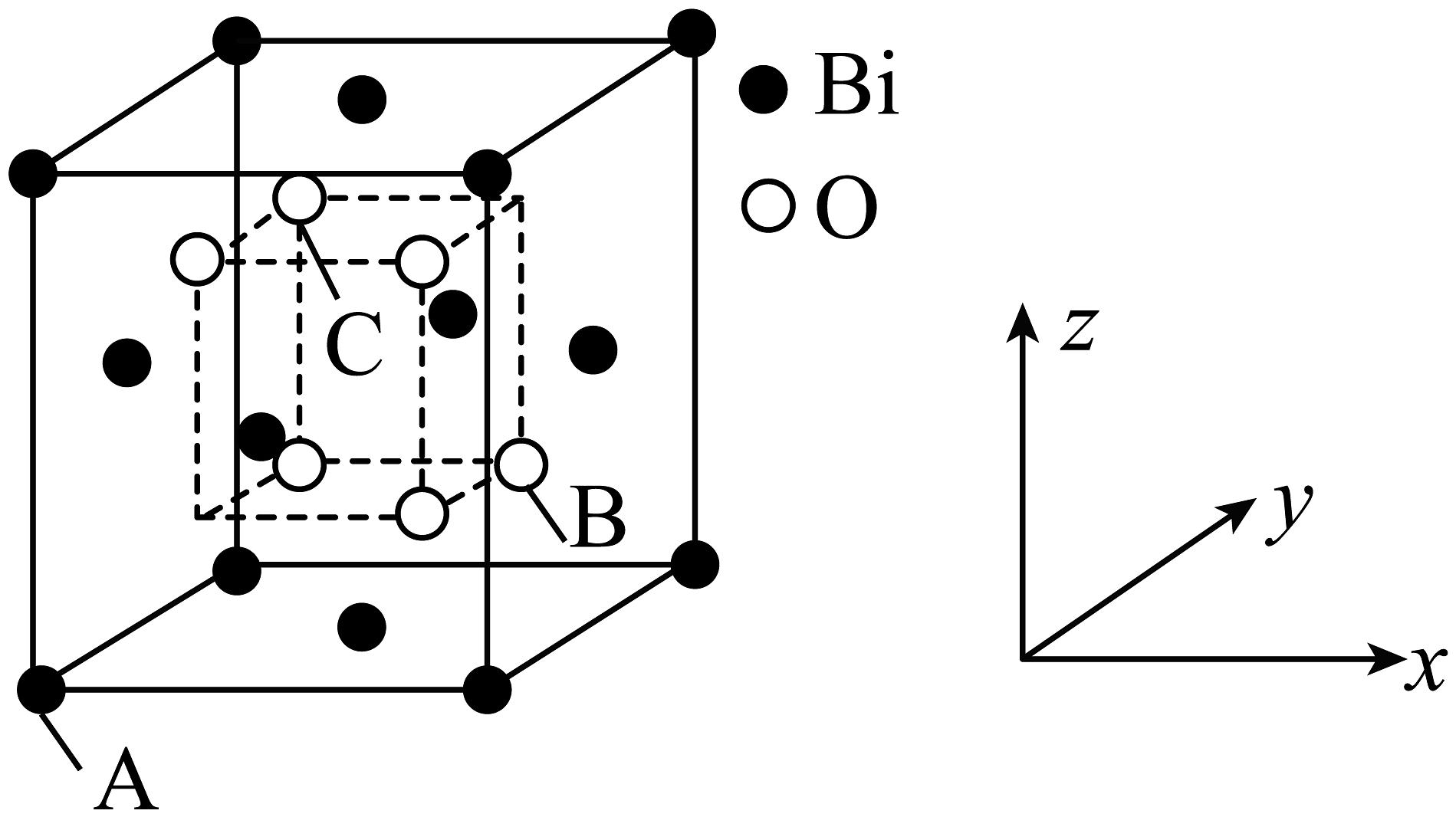
-
9、某化学实验小组探究镁与醋酸的反应,进行如下实验。
【实验一】把两个形状和大小相同、质量均为1.3g(过量)的光亮镁条分别放入的乙酸溶液和的盐酸中,测定上述2个反应体系的pH和生成气体的体积随反应时间的变化曲线如图。
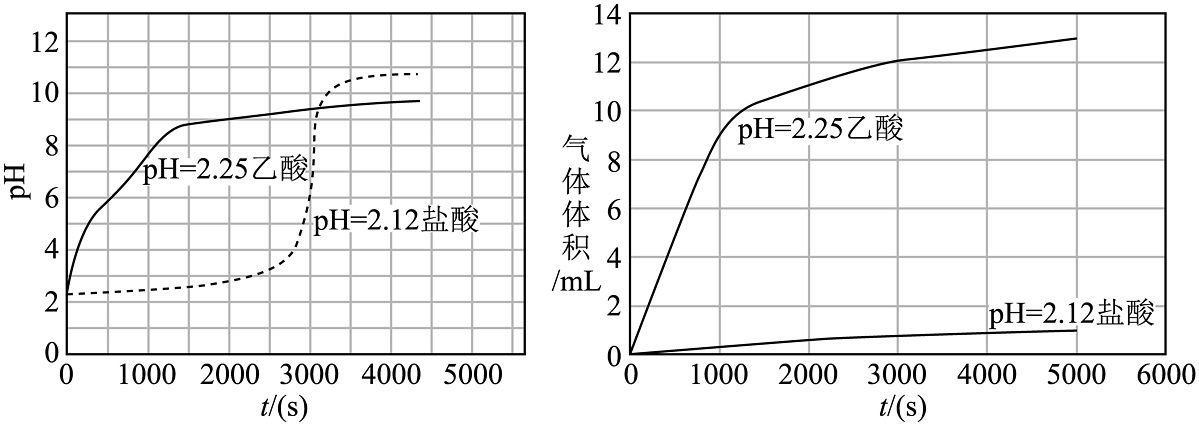
回答下列问题:
(1)、镁与醋酸反应的离子方程式为:。(2)、①3000s后盐酸体系的pH发生突跃是由于镁和盐酸反应结束,体系中又生成了(填化学式)。②该小组同学认为在反应的起始阶段,导致两反应体系气体生成速率差异的主要因素是溶液中的浓度不同,你认为该说法是否成立(填“是”或“否”),理由是。
(3)、进一步探究该反应体系中镁与乙酸的反应速率大于盐酸的原因。查阅资料:镁与水反应生成附着在镁条表面会阻碍反应进一步进行;
时 , ;
研究小组提出两个如下假设,通过实验验证和计算分析得出假设均成立。
①假设1:分子能直接与Mg反应
实验方案及现象: , 假设1成立。
②假设2:乙酸分子可以破坏镁表面的
常温下反应:的平衡常数 , 假设2成立。
(4)、基于上述结论。该小组同学猜想乙酸溶液与镁反应的主要微粒是乙酸分子,设计如下实验。【实验二】取与实验一完全相同的镁条,分别放入80mL如下两组溶液进行实验,生成气体的起始速率记录如下:
组别
第1组
第2组
试剂
的溶液
______溶液和一定浓度的溶液等体积混合
起始速率
amL/min
补充数据及得出结论:第2组实验中的乙酸浓度为 , 若 , 则猜想成立。
(5)、如图为1.3g光亮镁条与反应的温度-时间图像,根据上述实验探究,请在图中绘制相同的镁条与溶液反应的温度变化曲线。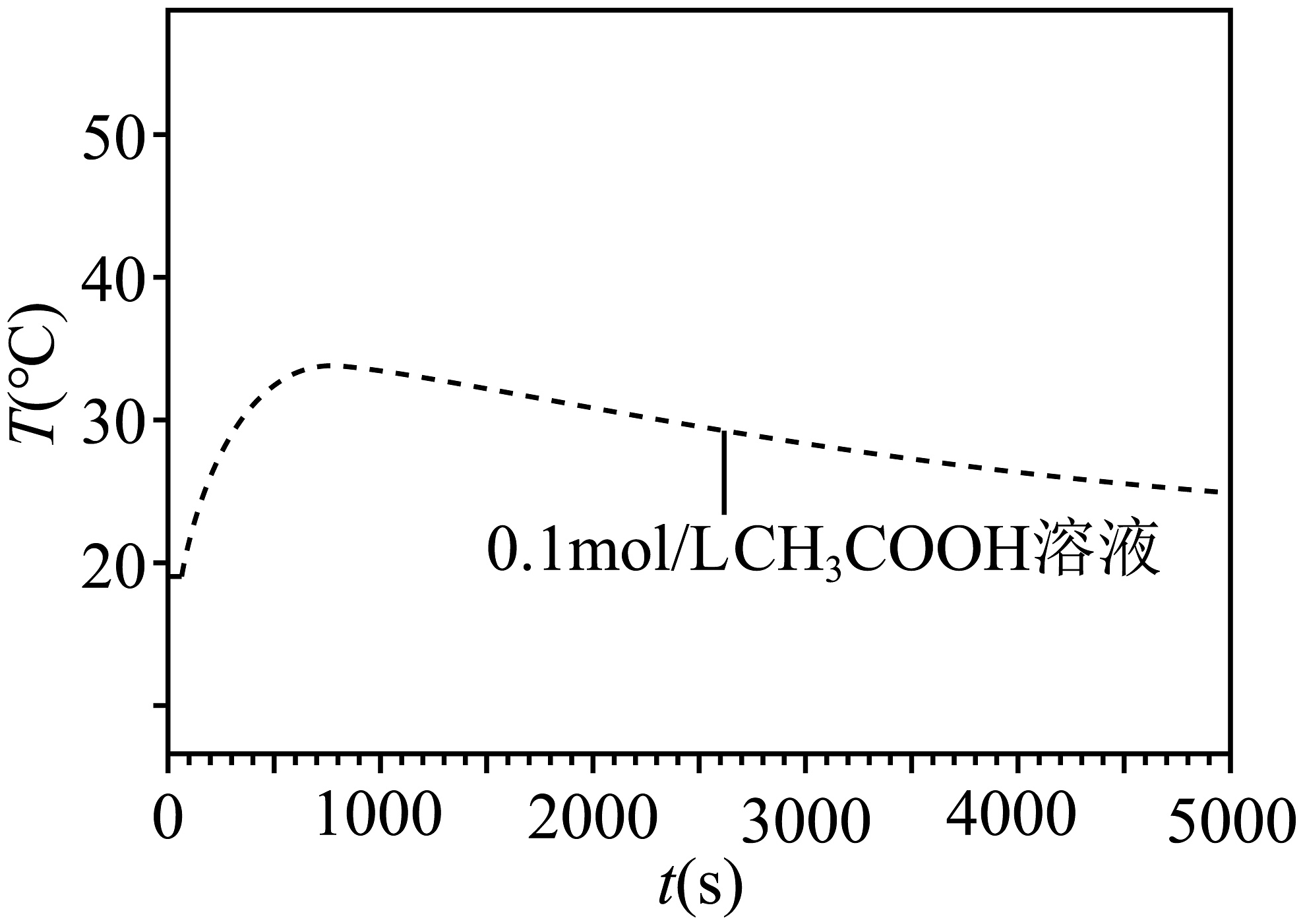
-
10、近日,我国科学家研发出一种“双极制氢”的电解装置,制氢原理如图所示(为有机物
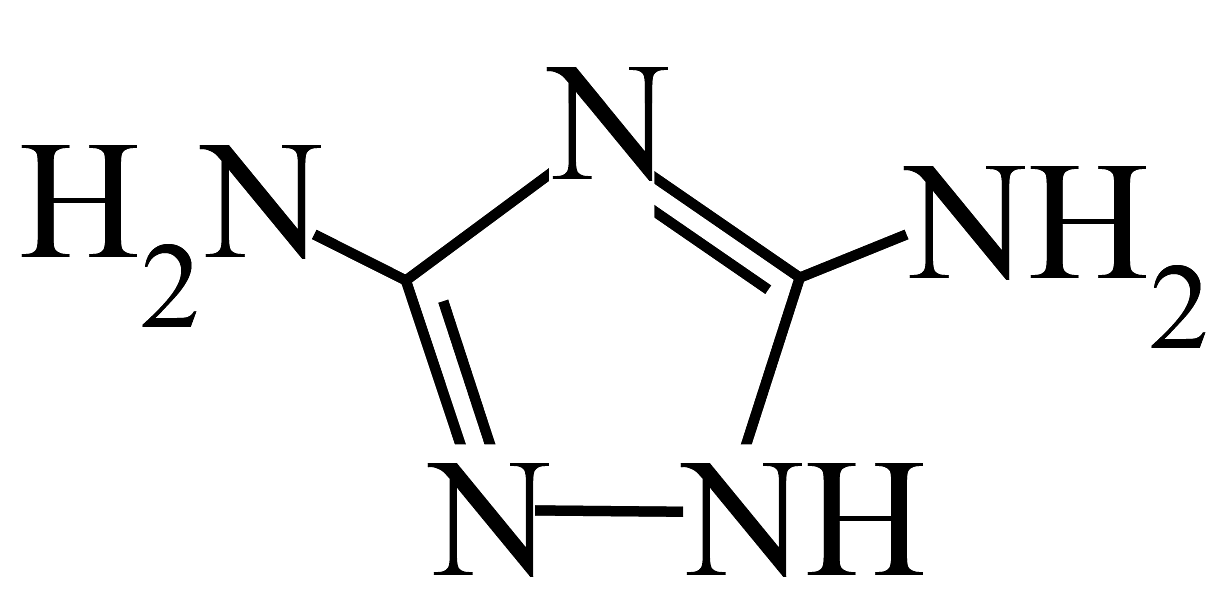 的简写)。以下说法不正确的是
的简写)。以下说法不正确的是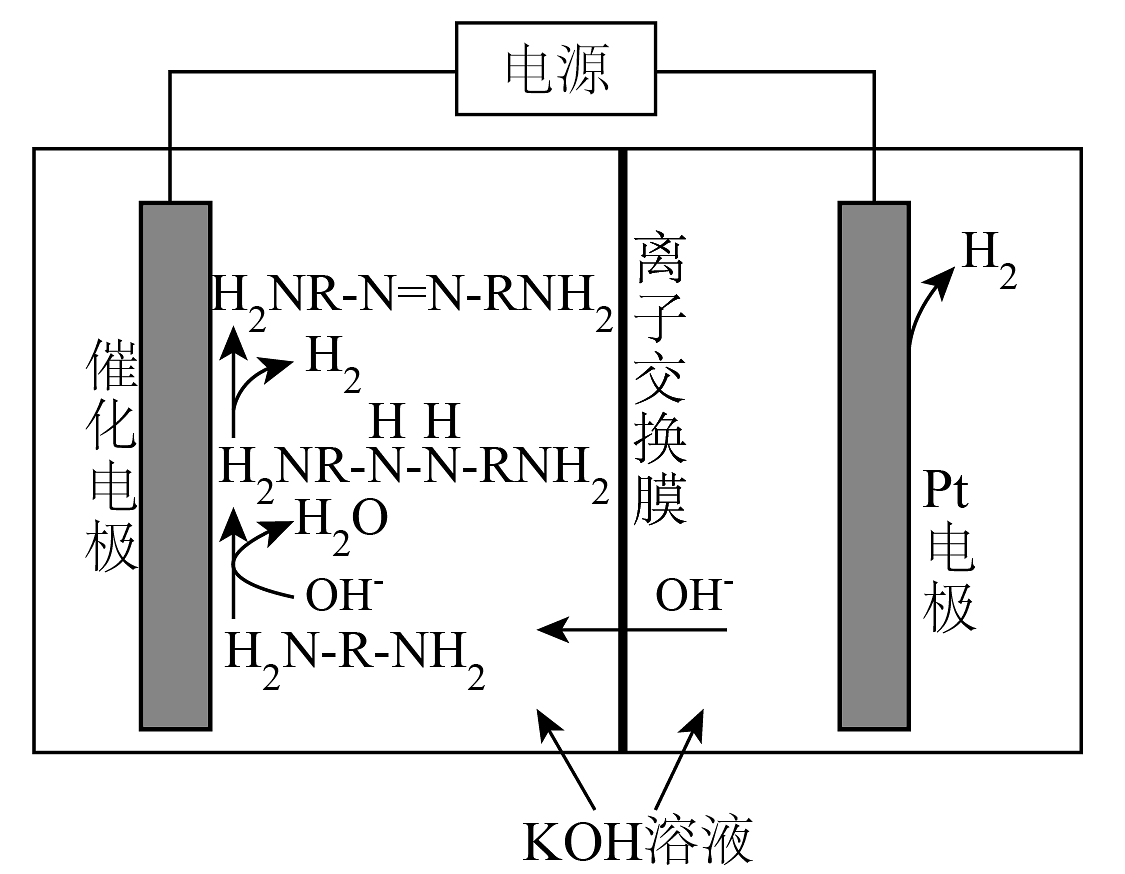 A、Pt电极与外接电源的负极相连 B、催化电极区总反应为: C、转移相同数目电子时,该装置生成氢气的物质的量为传统电解水装置的两倍 D、理论上,当电极上转移0.2mol电子时,阳极区质量变化值为3.4g
A、Pt电极与外接电源的负极相连 B、催化电极区总反应为: C、转移相同数目电子时,该装置生成氢气的物质的量为传统电解水装置的两倍 D、理论上,当电极上转移0.2mol电子时,阳极区质量变化值为3.4g -
11、苯与在一定条件下能发生如下反应,其中部分转化历程与能量变化如图所示。
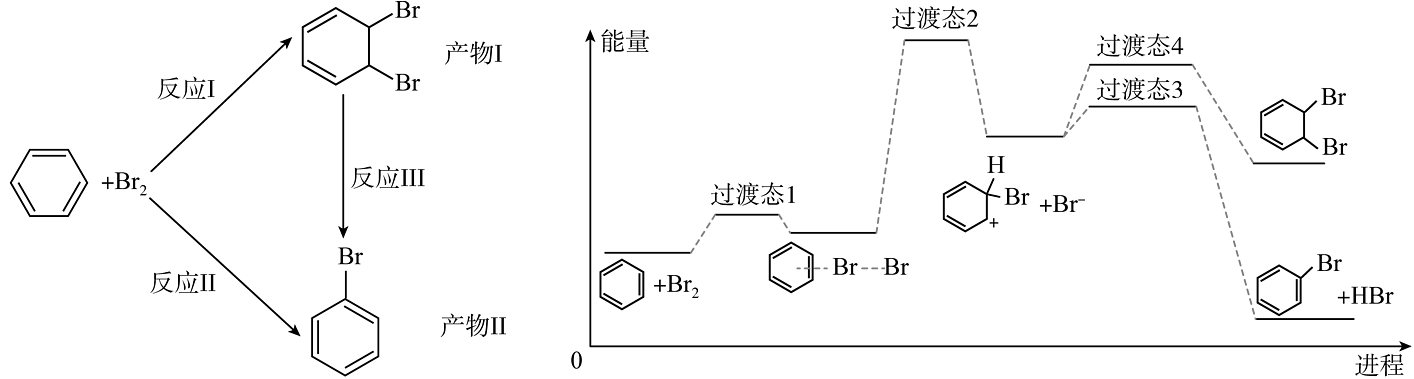
下列说法不正确的是
A、反应焓变:反应反应II B、产物稳定性:产物I>产物II C、生成两种产物的决速步骤相同 D、向体系中加入溴化铁,溴苯的平衡产率会提高 -
12、部分含Fe或Al的物质的分类与相应化合价关系如图。下列推断不合理的是
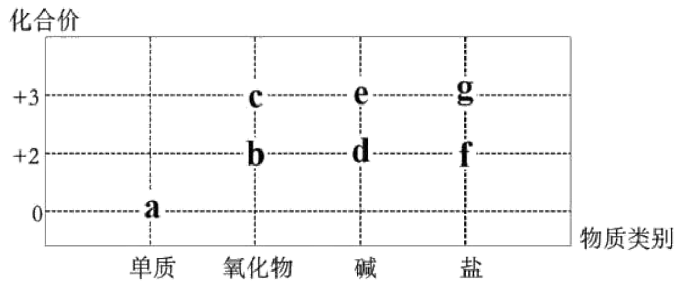 A、a的氯化物可能属于分子晶体 B、常温下,a遇到浓硝酸或者浓硫酸会钝化 C、若的转化中出现了颜色变化,则a在纯氧中点燃会生成b D、的转化可通过化合反应或置换反应来实现
A、a的氯化物可能属于分子晶体 B、常温下,a遇到浓硝酸或者浓硫酸会钝化 C、若的转化中出现了颜色变化,则a在纯氧中点燃会生成b D、的转化可通过化合反应或置换反应来实现 -
13、下列陈述Ⅰ与陈述Ⅱ均正确,但不具备因果关系的是
选项
陈述I
陈述II
A
酸性强弱:
烷基为吸电子基团,使羟基极性减弱,酸性减弱
B
非金属性:O>S
沸点
C
离子半径大小:
熔点:
D
某冠醚与能形成超分子,与则不能
该冠醚可与形成稳定的离子键
A、A B、B C、C D、D -
14、化合物是制备(结构如图所示)的一种原料,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,与原子的核外电子数之和等于原子的价层电子数,基态原子的s能级与p能级填充的电子总数相等。下列说法正确的是
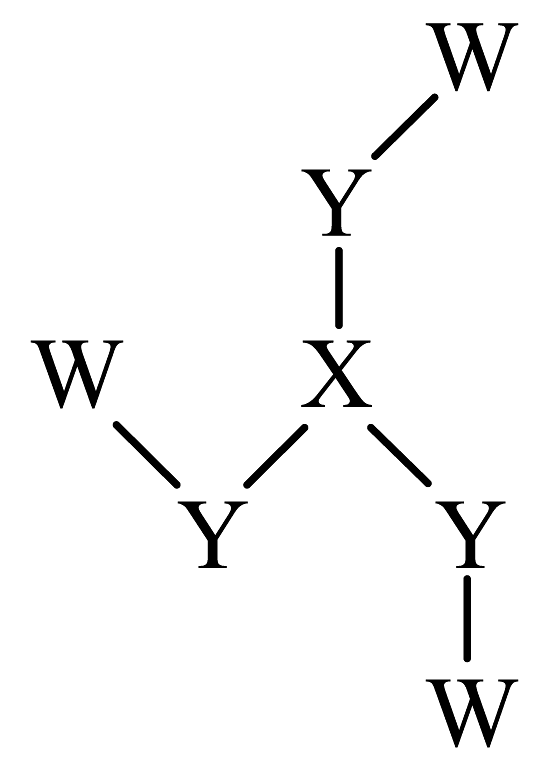 A、元素的电负性: B、中键角: C、中X和Y均满足8电子稳定结构 D、Z的单质可通过电解其氯化物水溶液的方法冶炼
A、元素的电负性: B、中键角: C、中X和Y均满足8电子稳定结构 D、Z的单质可通过电解其氯化物水溶液的方法冶炼 -
15、下图是铜和浓硫酸反应实验及性质探究实验的一体化装置。下列说法不正确的是
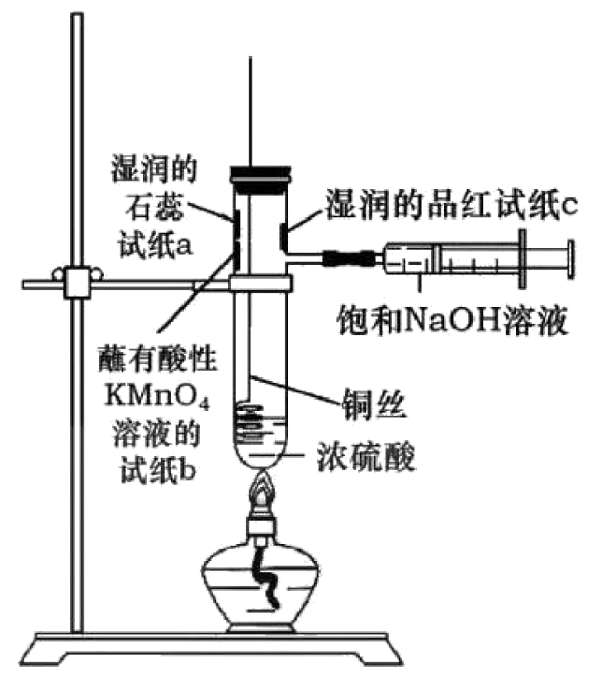 A、a处试纸变红,说明为酸性氧化物 B、c处和b处试纸均褪色,且原因相同 C、该设计的优点之一是能控制反应的发生与停止 D、铜和浓硫酸反应过程中出现灰白色固体,用水稀释后得到蓝色溶液
A、a处试纸变红,说明为酸性氧化物 B、c处和b处试纸均褪色,且原因相同 C、该设计的优点之一是能控制反应的发生与停止 D、铜和浓硫酸反应过程中出现灰白色固体,用水稀释后得到蓝色溶液 -
16、设为阿伏加德罗常数的值。下列说法正确的是A、中含键数目为 B、0.1mol肼中孤电子对数为 C、标准状况下,中含有氯离子的数目为 D、的溶液,含铬微粒总浓度为
-
17、为了保护埋在地下的钢管道,常用下图设计减缓腐蚀。下列说法正确的是
 A、装置中的钢管道作正极,发生电极反应: B、电子由镁块流出,经过潮湿的碱性土壤移动至钢管道 C、若将镁块替换成铜块,可减缓钢管道腐蚀速率 D、该金属保护方法为牺牲阳极保护法
A、装置中的钢管道作正极,发生电极反应: B、电子由镁块流出,经过潮湿的碱性土壤移动至钢管道 C、若将镁块替换成铜块,可减缓钢管道腐蚀速率 D、该金属保护方法为牺牲阳极保护法 -
18、下列描述物质制备和应用的离子方程式不正确的是A、模拟侯氏制碱法制备晶体: B、胃舒平[主要成分为]治疗胃酸过多: C、与水反应用作潜水艇氧气来源: D、海水提溴过程中将溴吹入吸收塔:
-
19、用碳酸钠标定盐酸,实验步骤为①研细、②加热 , 至质量不变、③冷却、④称量、⑤溶解、⑥用待测盐酸滴定。下列实验步骤所对应的操作正确的是
A.步骤①
B.步骤②
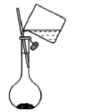
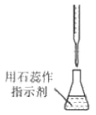
C.步骤⑤
D.步骤⑥
A、A B、B C、C D、D -
20、“光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
用石墨作工业机械润滑剂
石墨可以导电
B
“卤水点豆腐”时加入硫酸钙
电解质能够使胶体聚沉
C
兴趣活动:新榨苹果汁提取液可使溶液变为浅绿色
苹果汁中含有还原性物质,能把溶液中的转化为
D
用氯乙烷气雾剂降温麻醉、快速镇痛
氯乙烷易汽化吸收热量
A、A B、B C、C D、D