相关试卷
-
1、《洞天奥旨》记载:中药樟脑,气芳香浓烈刺鼻,有通窍、杀虫、止痛、辟秽之功效。下列说法正确的是
 A、樟脑属于芳香酮类化合物 B、樟脑分子中只有一个手性碳原子 C、樟脑分子可与氯气在光照条件下反应 D、樟脑不能使酸性溶液褪色,因此樟脑不能发生氧化反应
A、樟脑属于芳香酮类化合物 B、樟脑分子中只有一个手性碳原子 C、樟脑分子可与氯气在光照条件下反应 D、樟脑不能使酸性溶液褪色,因此樟脑不能发生氧化反应 -
2、化学处处呈现美。下列说法正确的是A、形状美:缺角的晶体能变成完美的立方体块,体现晶体自范性 B、结构美:石炭酸分子中具有单双键交替且呈平面六边形对称的结构 C、颜色美:烟花燃烧时,火焰颜色所呈现的是金属的化学性质 D、溶液美:在淀粉溶液中加入食用加碘盐,溶液变蓝色
-
3、下列化学用语或图示正确的是A、基态Mn原子价层电子轨道表示式:
 B、键形成的轨道重叠示意图:
B、键形成的轨道重叠示意图: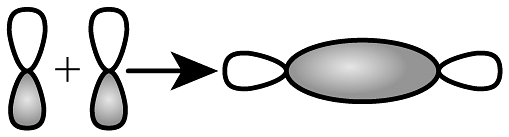 C、二氧化碳的空间填充模型:
C、二氧化碳的空间填充模型: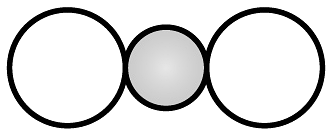 D、的离子结构示意图:
D、的离子结构示意图: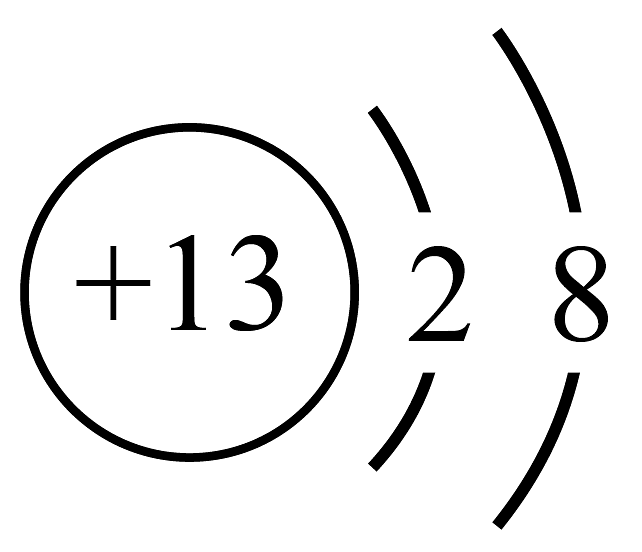
-
4、化学与生产生活、科技密切相关。下列说法正确的是A、“奋斗者号”潜水器含钛合金,其熔点、强度都高于纯钛金属 B、高强度芳纶纤维(聚对苯二甲酰对苯二胺)可通过缩聚反应合成 C、美缝剂-环氧彩砂中的石英砂与金刚砂属于同素异形体 D、利用合成脂肪酸,实现了无机小分子向有机高分子的转变
-
5、化合物是从大豆中分离出来的一种新型异戊烯基异黄酮,具有重要的生物防御活性,其合成路线如下。

已知:
 (R为H或烃基)。(1)、化合物A的化学名称为 , 化合物D中官能团的名称为。(2)、化合物C的结构简式为。(3)、EF的反应类型是 , F中碳原子的杂化轨道的类型为。(4)、的化学方程式为。(5)、在B的同分异构体中,同时满足下列条件的共有种。
(R为H或烃基)。(1)、化合物A的化学名称为 , 化合物D中官能团的名称为。(2)、化合物C的结构简式为。(3)、EF的反应类型是 , F中碳原子的杂化轨道的类型为。(4)、的化学方程式为。(5)、在B的同分异构体中,同时满足下列条件的共有种。①能够发生银镜反应;②与溶液发生显色发应;③苯环上有2个取代基。
(6)、J→K多步反应中包含“去除保护”步骤,依据I→K的原理,I先“去除保护”再“关环”会生成一种含有4个六元环的有机化合物 , 其结构简式是。 -
6、高铁酸钾是一种新型绿色消毒剂,其制备与应用探究如下:
I.合成
步骤①:按图1装置,将溶液加入仪器a中,控制温度低于20℃,搅拌下通入至饱和,再加入固体,充分反应得到强碱性饱和溶液。
步骤②:将盛有固体的烧杯置于冰水浴中,分批加入①中所得溶液,搅拌,反应得到溶液,过滤。
步骤③:在滤液中加入饱和溶液,冰水浴保持 , 过滤得到粗产品。将粗产品纯化得到纯产品。

II.用去除废水中苯酚的探究
对苯酚的去除率随着的变化关系如图2所示。

已知:
1.在较高温度下发生歧化反应生成。
II.在强碱性溶液中比较稳定,其氧化能力随着的增大而减小。
回答下列问题:
(1)、图1中,仪器a的名称是;乙装置的导管口应连接(填丙中标号)。(2)、步骤①中“控制温度低于20℃”的目的是。(3)、步骤②合成的离子方程式为。(4)、步骤③中,物质的溶解性:(填“>”或“<”);粗产品的纯化方法为。(5)、的产率为。(6)、图2中,时,苯酚去除率最高的原因是。 -
7、工业合成氨的反应为 , 原料中的可来源于水煤气,相关反应如下:
a.
b.
回答下列问题:
(1)、已知 , 则。(2)、在一定温度下,在体积固定的密闭容器中加入一定量的和 , 发生反应、 , 下列说法错误的是_______(填标号)。A、平衡时向容器中充入惰性气体,反应的平衡逆向移动 B、混合气体的密度保持不变时,说明反应体系已达到平衡 C、使用催化剂可提高CO平衡转化率 D、高温有利于反应a自发进行(3)、已知合成氨反应在催化剂表面要经历吸附(附着催化剂表面)、断键……成键、脱附(脱离催化剂表面)等过程,和在催化剂上进行断键的过程要(填“吸收”或“放出”)较多的能量,和在催化剂表面合成的反应过程的顺序为⑤→(用图1中序号表示)。 (4)、在℃、压强为的条件下,向一恒压密闭容器中通入的混合气体,体系中气体的含量与时间变化关系如图2所示:
(4)、在℃、压强为的条件下,向一恒压密闭容器中通入的混合气体,体系中气体的含量与时间变化关系如图2所示:①反应达到平衡,试求内氨气的平均反应速率 , 该反应的(用数字表达式表示,为以分压表示的平衡常数,分压总压物质的量分数)。
②若起始条件相同,在恒容容器中发生反应,则达到平衡时的含量符合图中(填“d”“e”“f”或“g”)点。
(5)、以为氮源通过电解法制取氨气装置如图所示。阴极的电极反应式为。
-
8、广西是中国铟(49In)产业的重要基地。某工厂从金属冶炼的废渣(主要含、、及少量不溶于酸的杂质)中回收铟的工艺流程如图所示:

已知:①室温下:;
②若溶液中某离子浓度小于 , 则认为该离子沉淀完全。
回答下列问题:
(1)、铟与铝同主族,基态铟原子的价层电子排布式为。(2)、为提高“酸浸1”的速率,可采取的措施是(任举一例)。(3)、“操作1”的具体操作:加热浓缩、、过滤、洗涤、干燥。(4)、若“酸浸2”后溶液中浓度为 , 用进行“中和”时,需控制的范围为。(5)、“浸渣3”的主要成分为(填化学式)。(6)、“还原”中主要反应的离子方程式为。(7)、磷化铟是半导体领域的重要原料,其晶胞结构类型与金刚石的相似,磷化铟晶体类型是晶体。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图为磷化铟的晶胞示意图,在晶胞坐标系中,a点铟的原子坐标为 , 则b点磷的原子坐标为。
-
9、常温下向的溶液中通入气体,随反应进行(不考虑分解),溶液中代表或)的值随溶液变化存在如图所示关系,下列说法错误的是
 A、线代表随溶液pH的变化线 B、 C、溶液的约为12 D、溶液中存在:
A、线代表随溶液pH的变化线 B、 C、溶液的约为12 D、溶液中存在: -
10、在工业生产上可利用硫与为原料制备。
450℃以上,发生反应I:;
600℃以上,发生反应Ⅱ:2。
一定条件下,分解产生的体积分数、与反应中平衡转化率与温度的关系如图所示。下列说法错误的是
 A、反应Ⅱ的 B、的体积分数保持不变,说明反应处于平衡状态 C、在密闭容器中 , 某温度下若完全分解,当体积分数为时,转化率为 D、反应Ⅱ温度不低于600℃的原因是:低于此温度,浓度小,反应速率慢
A、反应Ⅱ的 B、的体积分数保持不变,说明反应处于平衡状态 C、在密闭容器中 , 某温度下若完全分解,当体积分数为时,转化率为 D、反应Ⅱ温度不低于600℃的原因是:低于此温度,浓度小,反应速率慢 -
11、某新型储氢材料的晶胞结构如图所示,该立方晶胞参数为为阿伏加德罗常数的值,下列说法错误的是
 A、与最近且距离相等的有12个 B、晶胞的化学式为 C、的空间结构为正四面体形 D、晶体的密度为
A、与最近且距离相等的有12个 B、晶胞的化学式为 C、的空间结构为正四面体形 D、晶体的密度为 -
12、下列离子方程式书写正确的是A、用醋酸处理水垢中的碳酸钙: B、与反应生成蓝色沉淀: C、向溶液中加入过量的溶液: D、向的悬浊液中滴加溶液:
-
13、一种清洁、低成本的双联装置工作原理如图所示,浓缩海水形成的离子浓度差会驱动离子从高浓度区域向低浓度区域迁移,进而产生离子电流。下列说法错误的是
 A、装置I中Li+移向X电极 B、装置II中电极W为阳极 C、装置II中电极反应为 D、装置II中电极W产生标准状况下22.4L气体时,装置I中可制得42.5gLiCl
A、装置I中Li+移向X电极 B、装置II中电极W为阳极 C、装置II中电极反应为 D、装置II中电极W产生标准状况下22.4L气体时,装置I中可制得42.5gLiCl -
14、下列实验方案不能达到探究目的的是
实验方案
探究目的
A
将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入少量稀硝酸,再滴加几滴KSCN溶液,观察现象
菠菜中是否含有铁元素
B
向盛有水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化
是否具有漂白性
C
常温下,向溶液中滴加5滴溶液,充分反应后,再滴加5滴溶液,观察沉淀颜色变化
比较的大小
D
向两支试管中各加入的溶液,分别滴加2滴蒸馏水和2滴溶液,观察产生气泡的速率
是否能加快分解
A、A B、B C、C D、D -
15、镁电池是未来能源存储的重要发展方向。部分含物质的分类与相应化合价关系如图,下列说法正确的是
 A、基态Mg原子核外电子的空间运动状态有12种 B、工业上常通过电解熔融来制备 C、经过的转化可实现从海水中提取镁 D、蒸干的水溶液一定能得到原溶质
A、基态Mg原子核外电子的空间运动状态有12种 B、工业上常通过电解熔融来制备 C、经过的转化可实现从海水中提取镁 D、蒸干的水溶液一定能得到原溶质 -
16、以为原料合成氢叠氮酸的流程如下:。为阿伏加德罗常数的值,下列说法正确的是A、中所含电子的数目为 B、中含键的数目为 C、完全转化为 , 转移电子的数目为 D、已知为弱酸,溶液中含的数目为
-
17、丹参酮IIB是中国传统中药丹参中的重要活性成分之一,具有抗氧化、抗炎、抗菌等多种药理作用,其结构如下图。下列有关丹参酮IIB分子的说法正确的是
 A、有3种含氧官能团 B、有2个手性碳 C、可发生氧化反应、酯化反应和消去反应 D、该分子最多可与发生加成反应
A、有3种含氧官能团 B、有2个手性碳 C、可发生氧化反应、酯化反应和消去反应 D、该分子最多可与发生加成反应 -
18、短周期主族元素的原子序数依次增大。已知元素形成的化合物最多,基态、原子核外未成对电子数之比为 , 在同周期主族元素中原子半径最大。下列说法正确的是A、电负性: B、第一电离能: C、原子半径: D、最简单氢化物的沸点:
-
19、某小组在实验室用茉莉花提取茉莉花精油的操作流程如下。下列实验操作对应的装置错误的是A、研磨
 B、溶解
B、溶解 C、过滤
C、过滤 D、蒸馏
D、蒸馏
-
20、是有机合成常用的催化剂,一定条件下可发生如图转化。下列说法错误的是
 A、是极性分子 B、键角: C、中存在氢键和配位键 D、熔化可产生阴、阳离子
A、是极性分子 B、键角: C、中存在氢键和配位键 D、熔化可产生阴、阳离子