相关试卷
-
1、电解吸收CO2的KOH溶液(主要成分是K2CO3)可将CO2转化为有机物,图1是双膜三室法电解CO2的吸收液。图2是在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率随电解电压的变化曲线。

下列说法错误的是
A、Y是直流电源的负极,交换膜b是阴离子交换膜 B、当电解电压为U1V时,阴极主要还原物质为H2 C、当电解电压为U2V时,生成CH4的电极反应式:CO+8e-+7H2O=CH4↑+10OH- D、当电解电压为U3V时,生成的C2H4和HCOO-的物质的量之比为2:1 -
2、我国化学家侯德榜改良索尔维的纯碱生产工艺,其流程如下:

下列说法正确的是
A、已知醋酸铵溶液显中性,则反应所得到NH4HCO3溶液中:c(HCO)>c(NH) B、沉淀池中的反应方程式为2NaCl+CO2+2NH3+H2O=Na2CO3↓+2NH4Cl C、饱和NaCl溶液中通入NH3后,溶液中存在:c(H+)+c(NH)= c(OH-) D、通NH3前的母液中一定存在:c(NH3·H2O)+c(NH)= c(Cl-) -
3、加热N2O5时,发生以下两个分解反应:
①N2O5N2O3+O2 , ②N2O3N2O+O2 ,
在2 L密闭容器中充入8 mol N2O5 , 加热到T ℃达到化学平衡时O2为9 mol,N2O3为3.4 mol,则在该温度下反应①的化学平衡常数为
A、8.5 B、9.6 C、10.2 D、10.7 -
4、光催化氧化甲烷制甲醛的机理如图所示。下列说法不正确的是
 A、在光催化剂表面会发生反应 B、为中间产物 C、上述过程中有非极性键的断裂与生成 D、含O分子参与的反应一定有电子转移
A、在光催化剂表面会发生反应 B、为中间产物 C、上述过程中有非极性键的断裂与生成 D、含O分子参与的反应一定有电子转移 -
5、近年来钠离子电池备受关注。利用钠离子在电极间“脱嵌”实现充放电的原理如图所示,电池工作时总反应为 , 下列说法正确的是
 A、若用该电池进行铜的电解精炼,粗铜应与硬碳极相连 B、充电时,电子由电源负极经硬碳、电解液、流向电源正极 C、放电时,当电路中转移电子时,正极质量减少 D、放电时,正极反应为
A、若用该电池进行铜的电解精炼,粗铜应与硬碳极相连 B、充电时,电子由电源负极经硬碳、电解液、流向电源正极 C、放电时,当电路中转移电子时,正极质量减少 D、放电时,正极反应为 -
6、下列实验方案能达到目的的是
实验目的
实验方案
A
除去苯酚中混有的苯
加适量的NaOH溶液分液,向水层通入足量CO2过滤
B
测定中和反应的反应热
酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度
C
证明牺牲阳极的保护法
将Zn与Fe用导线相连,插入稀硫酸酸化的3%NaCl溶液,一段时间后,从Fe电极区取出少量溶液,滴入2滴K3[Fe(CN)6]溶液
D
分离乙酸和过氧乙酸
蒸馏(已知:沸点分别为118℃和105℃)
A、A B、B C、C D、D -
7、下列物质中仅含共价键的是A、NH4NO3 B、NaOH C、MgCl2 D、CH4
-
8、碱金属氯化物是典型的离子化合物,和的晶胞结构如下图所示。其中的碱金属离子能够与冠醚形成超分子。

下列说法不正确的是
A、晶胞中含4个a离子 B、晶体中周围紧邻8个 C、碱金属离子与冠醚通过离子键形成超分子 D、不同空穴尺寸的冠醚可以对不同碱金属离子进行识别 -
9、实验室常用氯化钠粉末和浓硫酸制备氯化氢,化学反应为 , 的结构式为
 。下列化学用语或叙述错误的是 A、分子间氢键使浓硫酸呈黏稠状和密度较大 B、NaCl的电子式:
。下列化学用语或叙述错误的是 A、分子间氢键使浓硫酸呈黏稠状和密度较大 B、NaCl的电子式: C、中阴离子的VSEPR模型:
C、中阴离子的VSEPR模型: D、HCl中共价键的形成过程:
D、HCl中共价键的形成过程:
-
10、非物质文化遗产是一个国家和民族历史文化成就的重要标志。下列河南非物质文化遗产中主要成分为有机物的是


A.浚县泥咕咕
B.开封汴绣


C.镇平玉雕
D.棠溪宝剑
A、A B、B C、C D、D -
11、丙烯可发生如下转化,请回答:
 (1)、W中官能团的名称是 , 检验F中的官能团所用的试剂。(2)、下列有关说法不正确的是_______。A、丙烯与氢气生成丙烷的反应属于还原反应 B、等质量的丙烯与Z完全燃烧消耗O2的量不相等 C、Z能使酸性高锰酸钾溶液褪色 D、丙烯与氧气生成环氧丙烷(
(1)、W中官能团的名称是 , 检验F中的官能团所用的试剂。(2)、下列有关说法不正确的是_______。A、丙烯与氢气生成丙烷的反应属于还原反应 B、等质量的丙烯与Z完全燃烧消耗O2的量不相等 C、Z能使酸性高锰酸钾溶液褪色 D、丙烯与氧气生成环氧丙烷( )的反应原子利用率为
(3)、类比烷烃的取代反应,丙烯的化学反应方程式是。(4)、写出的化学方程式是。(5)、丙烯过程中会产生副产物(与W互为同分异构体),其结构简式为。
)的反应原子利用率为
(3)、类比烷烃的取代反应,丙烯的化学反应方程式是。(4)、写出的化学方程式是。(5)、丙烯过程中会产生副产物(与W互为同分异构体),其结构简式为。 -
12、
I.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验。实验原理:氧化 , 生成和(无色)。
实验编号
室温下,试管中所加试剂及其用量
室温下溶液褪色至无色所需时间/min
溶液
溶液
溶液
1
3.0
13.0
2.0
2.0
8.0
2
2.0
14.0
2.0
2.0
10.4
3
1.0
2.0
12.8
请回答以下问题:
(1)完成离子方程式:。
____________________________。
(2)请完成上述实验设计表:。
(3)根据上表中的实验数据,可知本实验探究的是对反应速率的影响。
(4)利用实验1中数据计算,反应速率为。
II.侯氏制碱法以和为反应物制备纯碱。某实验小组在侯氏制碱法基础上,以NaCl和为反应物,在实验室制备纯碱,步骤如下:
①配制饱和食盐水;
②在水浴加热下,将一定量研细的 , 加入饱和食盐水中,搅拌,使溶解,静置,析出晶体;
③将晶体减压过滤、煅烧,得到固体。
回答下列问题:
(5)步骤①中配制饱和食盐水,下列仪器中需要使用的有(填名称)。

(6)步骤②中需研细后加入,目的是。
(7)在实验室使用代替和制备纯碱,优点是。
-
13、按要求回答下列问题。(1)、下列反应中,生成物总能量低于反应物总能量的是_______。A、八水合氢氧化钡与氯化铵的反应 B、铝与氧化铁在高温下的反应 C、金属与酸的反应 D、碳酸钙受热分解(2)、298K时,燃烧生成放热 , 蒸发吸热44kJ,表示燃烧热的热化学方程式为。(3)、研究氧化制对资源综合利用有重要意义。相关的主要化学反应有:
I.
II.
III.
已知:298K时,相关物质的相对能量(如图1)。可根据相关物质的相对能量计算反应或变化的随温度变化可忽略)。例如:。

根据相关物质的相对能量计算。
(4)、依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:①。
②
③
根据盖斯定律,计算298K时由和生成反应的反应热为。
(5)、一碳化学是以分子中只含一个碳原子化合物为原料生产化工产品的方法。合成气(CO和的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中发生如下两个反应:I:;II:。①当反应I达到平衡后,下列措施可提高反应II正反应速率的是。
A.加入焦炭B.通入COC.升高温度D.分离出氢气
②若在恒温恒容容器中仅发生反应II,则下列能说明反应达到平衡状态的是。
A.混合气体的压强不变
B.容器内氢气的质量分数不变
C.容器内气体的平均相对分子质量不变
D.单位时间内,每有键断裂,同时有键断裂
(6)、可作为燃料使用,用和组合形成的质子交换膜燃料电池的结构示意图如图,电池总反应为 , c电极的电极反应式为。若线路中转移2mol电子,则上述燃料电池消耗的在标准状况下的体积为L。
-
14、
I.按要求完成下列填空。
(1)俗称________。
(2)写出甘油的结构简式________。
II.中学常见的四种元素A、D、E、W,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,位于同周期,的原子最外层电子数之和为是人体必需的微量元素,缺乏W会导致贫血症状。
(3)A在元素周期表中的位置是________。
(4)D、E最高价氧化物对应的水化物相互反应的离子方程式________。
(5)下列说法不正确的是_______(填字母序号)。
A. D的最高价氧化物对应水化物的碱性弱于 B. A形成的氢化物中只含有极性键 C. 配制的溶液通常需加些单质 D. 工业上用与E的氢化物的浓溶液来制备E单质 (6)W的单质可用于处理酸性废水中的 , 使其转换为 , 同时生成有磁性的W的氧化物X,再进行后续处理。上述反应的离子方程式为________。
-
15、下列实验方案设计、现象和结论均正确的是
实验方案
实验现象
实验结论
A
把通入含酚酞的氢氧化钠溶液
红色褪去
具有漂白性
B

左边棉球变为橙色,右边棉球变为蓝色
非金属性:
C
取溶液,滴加溶液,充分反应后,滴加KSCN溶液
溶液变红
与反应是可逆的
D
向溶液中加入一小块钠
产生无色气泡,溶液底部有蓝色沉淀生成
Na不能从溶液置换出铜
A、A B、B C、C D、D -
16、下列对图示的解释不正确的是


A.该装置可比较硫、碳、硅三种元素的非金属性强弱
B.b时刻导电能力增强,溶液中含较多的Ba2+和OH-


C.NaCl固体在水中形成水合离子
D.可能是HClO分解使溶液pH降低
A、A B、B C、C D、D -
17、某有机物结构简式如图所示,关于该有机物,下列叙述不正确的是
 A、该化合物能发生加成、还原、氧化、取代和加聚反应 B、该有机物能使酸性高锰酸钾和溴水褪色,且原理不相同 C、1 mol该有机化合物能消耗2 molNaOH D、1 mol该有机物分别与足量的钠、碳酸氢钠反应生成气体的物质的量不相同
A、该化合物能发生加成、还原、氧化、取代和加聚反应 B、该有机物能使酸性高锰酸钾和溴水褪色,且原理不相同 C、1 mol该有机化合物能消耗2 molNaOH D、1 mol该有机物分别与足量的钠、碳酸氢钠反应生成气体的物质的量不相同 -
18、标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知和的相对能量为0],下列说法不正确的是
 A、 B、历程II中,ClO是中间产物 C、相同条件下,该反应的总反应速率:历程历程II D、可计算键能为
A、 B、历程II中,ClO是中间产物 C、相同条件下,该反应的总反应速率:历程历程II D、可计算键能为 -
19、某温度下,在2 L恒容密闭容器中投入一定量的 , 发生反应: , 时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是
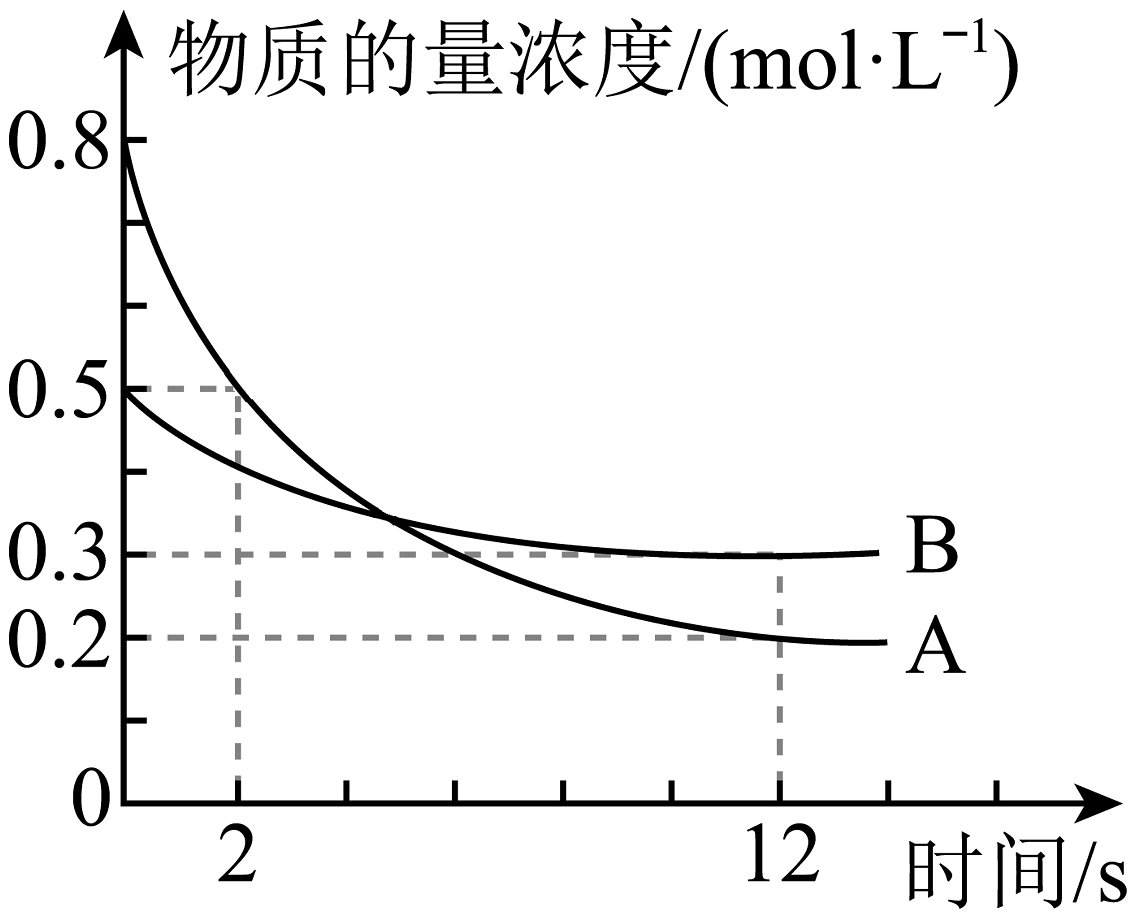 A、2 s时B的转化率为 B、内,D的平均反应速率为 C、化学计量系数之比 , 且 D、图中两曲线相交时,A的消耗速率大于A的生成速率
A、2 s时B的转化率为 B、内,D的平均反应速率为 C、化学计量系数之比 , 且 D、图中两曲线相交时,A的消耗速率大于A的生成速率 -
20、已知对应的反应中已省略,且];下列说法正确的是
 A、 B、的值是的燃烧热 C、 D、稳定性:正丁烷>异丁烷
A、 B、的值是的燃烧热 C、 D、稳定性:正丁烷>异丁烷