相关试卷
-
1、有以下10种物质,请回答下列问题:
①石墨②氯化钠③蔗糖④稀硫酸⑤溶液⑥碳酸氢钠⑦氢氧化钡溶液⑧冰醋酸⑨氯化氢⑩氢氧化铁胶体
(1)、属于非电解质的是。(2)、写出物质⑥在水中的电离方程式:。(3)、写出物质④和⑦反应的离子方程式:。(4)、写出物质⑥和⑨在水中发生反应的离子方程式:。(5)、写出往物质⑤中滴加物质⑦至溶液恰好成中性时反应的离子方程式:。(6)、⑩的实验室制备方案:向沸水中滴加几滴溶液,加热至液体呈红褐色,停止加热。(7)、已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯氢氧化铁胶体的装置是下列中的(填序号)。A.
 B.
B.  C.
C. 
-
2、过碳酸钠(2Na2CO3·3H2O2),有Na2CO3和H2O2的双重性质,用作漂白剂和氧化剂,可有效杀灭禽流感病毒。合理组合下列装置可用于测定过碳酸钠中碳酸钠的含量,下列说法不正确的是
 A、装置Ⅲ→I→II的顺序连接装置 B、装置b和e中盛放的试剂相同 C、d装置的作用是防止空气中的H2O和CO2进入到c中 D、若b中盛放澄清的石灰水,只用装置I可验证过碳酸钠与硫酸反应是否生成CO2(不考虑空气CO2的影响)
A、装置Ⅲ→I→II的顺序连接装置 B、装置b和e中盛放的试剂相同 C、d装置的作用是防止空气中的H2O和CO2进入到c中 D、若b中盛放澄清的石灰水,只用装置I可验证过碳酸钠与硫酸反应是否生成CO2(不考虑空气CO2的影响) -
3、下列叙述中正确的是A、向含有沉淀的水中通入至沉淀恰好溶解,再向溶液中加入饱和溶液,又有沉淀生成 B、将石灰水加入溶液中不产生沉淀,加入溶液中产生白色沉淀 C、等质量的和分别与足量盐酸反应,在相同的条件,生成的质量相同 D、向饱和溶液中通入足量 , 有结晶析出
-
4、某同学将金属钠露置于空气中,观察到下列现象:银白色
 变灰暗
变灰暗 变白色
变白色 出现液滴
出现液滴 白色固体,根据钠及其化合物的性质分析,下列说法正确的是( ) A、①发生了氧化还原反应 B、①变灰暗色是因为生成了过氧化钠 C、③是碳酸钠吸收空气中的水蒸气形成了溶液 D、④只发生物理变化
白色固体,根据钠及其化合物的性质分析,下列说法正确的是( ) A、①发生了氧化还原反应 B、①变灰暗色是因为生成了过氧化钠 C、③是碳酸钠吸收空气中的水蒸气形成了溶液 D、④只发生物理变化 -
5、氯元素的化合价与其形成的常见物质种类的关系如图所示。

下列说法不正确的是( )
A、b只有还原性 B、c没有漂白性,d具有漂白性 C、一定条件下e和f均属于较强氧化剂 D、g的化学式为HClO4 -
6、氮化铝(AlN)被广泛应用于电子、陶瓷等工业领域。在一定条件下,高温AlN可通过如下反应制取:。下列叙述正确的是A、AlN中N元素的化合价为+3 B、上述反应中AlN为氧化产物 C、上述反应中氮元素被还原,发生还原反应 D、上述反应中有电子的转移,是因为有元素的化合价发生变化
-
7、在给定的条件下,下列选项所示的物质间转化能实现的是A、 B、 C、 D、
-
8、工业上将通入冷的溶液中可制得漂白液,下列说法不正确的是A、漂白液的有效成分是 B、通入后的漂白液的消毒能力增强 C、若温度偏高,发生反应的离子方程式为: D、溶液比HClO溶液稳定
-
9、实验室有一瓶失去标签的无色溶液,测得其成强酸性,则该溶液中还可能大量存在的离子组是A、 B、 C、 D、
-
10、将一块黄豆粒大小的钠块投入到滴有几滴酚酞的水中,会有如下现象,对下列现象解释错误的是
选项
实验现象
结论和解释
A
钠浮在水面上
钠的密度比水小
B
钠熔成光亮的小球
反应放热,钠的熔点低
C
钠在水面四处游动,嘶嘶作响
反应生成了
D
溶液最终变成浅红色
反应生成了碱性物质
A、A B、B C、C D、D -
11、未来医疗将使用“纳米药物分子运输车”提高肿瘤的治疗效果,其结构如图所示。下列有关说法不正确的是
 A、二氧化硅属于酸性氧化物 B、含“纳米药物分子运输车”的分散系属于胶体 C、四氧化三铁与氧化铝均为金属氧化物 D、甲烷与“纳米药物分子运输车”的外壳均含有碳元素
A、二氧化硅属于酸性氧化物 B、含“纳米药物分子运输车”的分散系属于胶体 C、四氧化三铁与氧化铝均为金属氧化物 D、甲烷与“纳米药物分子运输车”的外壳均含有碳元素 -
12、中国传统文化博大精深,源远流长,下列叙述错误的是( )A、《抱朴子》中“以曾青涂铁,铁赤色如铜”,“曾青”是可溶性铜盐 B、《本草纲目拾遗》写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”“强水”是指盐酸 C、唐诗《放灯》中“火树银花不夜天, 游人元宵多留连”,“火树银花”指的是金属元素的焰色反应 D、《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的“碱”是K2CO3
-
13、化合物K是一种具有抗菌作用的药物,其合成路线如下:
 (1)、G分子中所含官能团名称。(2)、H的分子式为。(3)、E分子与足量氢气加成后的产物中含有个手性碳原子(酯基不与氢气加成)。(4)、H→K的反应类型是。(5)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、G分子中所含官能团名称。(2)、H的分子式为。(3)、E分子与足量氢气加成后的产物中含有个手性碳原子(酯基不与氢气加成)。(4)、H→K的反应类型是。(5)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①分子中不同化学环境的氢原子个数比是6∶2∶1∶1
②苯环上有4个取代基,且只有一种含氧官能团
-
14、下图中化合物E常用于合成医药、染料、发光材料等原料,其合成路线如下:

回答下列问题:
(1)、由A合成B的反应类型是。(2)、与化合物A同属于芳香族化合物的同分异构体共有种(不包含A本身)。(3)、化合物D中碳原子的杂化类型是。(4)、由D合成E时,若温度较高时,会产生一种分子式为的副产物,该副产物的结构简式是。 -
15、用作有机合成催化剂等工业。露置于潮湿的空气中易被氧化和水解,酸性条件下易歧化,难溶于水,易溶于浓盐酸并生成。(1)、基态核外电子排布式是。(2)、实验测得:属于共价化合物,气态分子的相对分子质量为199,该分子中含有配位键,则气态分子的结构式可能为。(3)、工业上有多种制备的方法,其中之一为:将废铜粉与食盐水、浓盐酸料液混合,在60~70℃缓慢通入空气进行氧化。静置,取上层清液加水稀释,生成沉淀,过滤,沉淀经洗涤、干燥得产品并真空保存。
①反应温度控制在60~70℃的方法是。
②加入浓盐酸的目的是。
(4)、①Cu与N两种元素组成的化合物具有良好光学性能。其晶胞结构如图所示。该物质的化学式为。
②溶液呈蓝色,蓝色物质为水合铜离子,可表示为含有键的数目为。
③的结构式可表示为。
-
16、是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12、中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素:Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。(1)、写出下列元素的名称: X、Y、Z。(2)、X—H和Y—H属于极性共价键,其中极性较强的是 (X、Y用元素符号表示)。(3)、N、O、Mg元素的前3级电离能如下表所示:A、B、C中为N元素的是。
元素
A
737.7
1450.7
7732.7
B
1313.9
3388.3
5300.5
C
1402.3
2856.0
4578.1
(4)、W的基态正二价离子的价层电子轨道表示式为。(5)、与形成的中提供孤电子对的原子是 , 配体的空间构型为。(6)、Y的简单气态氢化物极易溶于水的原因是(请回答两点)。(7)、琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,建议服用维生素C促进“亚铁”的吸收,避免生成 , 从结构角度看,易被氧化成的原因是。(8)、具有良好的半导体性能。的一种晶体与晶体的结构相似,如下图给出了晶胞中的和位于晶胞体心的(中的S—S键位于晶胞体对角线上,晶胞中的其他已省略),该晶体的1个晶胞中的数目为。
-
17、某烯烃分子中含有一个碳碳双键,一定条件下与氢气加成所得产 物的键线式如图所示,此烯烃可能的结构(不考虑顺反异构)有
 A、3种 B、4种 C、5种 D、6种
A、3种 B、4种 C、5种 D、6种 -
18、将的X完全燃烧生成的和 (标准状况)的 , X分子中只含一个苯环且苯环上只有一个取代基,其质谱图、核磁共振氢谱与红外光谱如图,关于X的下列叙述正确的是
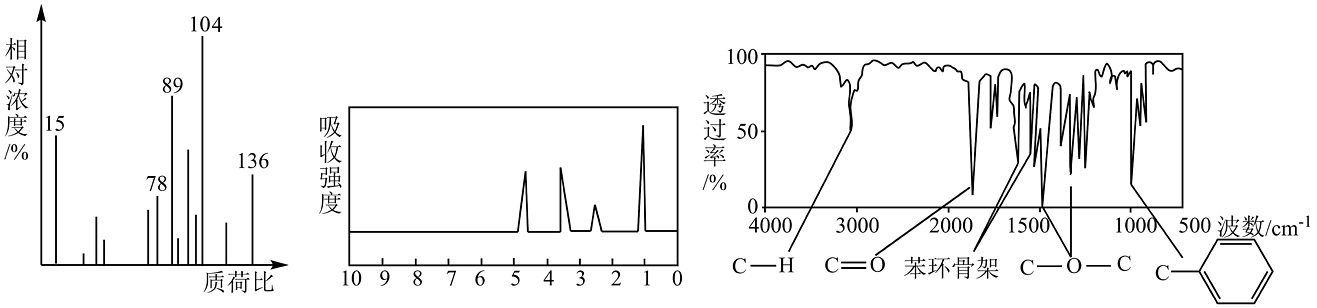 A、化合物X的分子式为 B、由核磁共振氢谱可知,X分子中有3种不同化学环境的氢原子 C、符合题中X分子核磁共振氢谱、红外光谱的有机物有1种 D、X分子中所有的原子在同一个平面上
A、化合物X的分子式为 B、由核磁共振氢谱可知,X分子中有3种不同化学环境的氢原子 C、符合题中X分子核磁共振氢谱、红外光谱的有机物有1种 D、X分子中所有的原子在同一个平面上 -
19、某有机物结构简式为
 , 下列叙述不正确的是 A、该有机物在加热和催化剂作用下,最多能和反应 B、该有机物能使溴水褪色,也能使酸性溶液褪色 C、该有机物在一定条件下能发生加成反应或取代反应 D、该有机物遇硝酸银溶液产生白色沉淀
, 下列叙述不正确的是 A、该有机物在加热和催化剂作用下,最多能和反应 B、该有机物能使溴水褪色,也能使酸性溶液褪色 C、该有机物在一定条件下能发生加成反应或取代反应 D、该有机物遇硝酸银溶液产生白色沉淀 -
20、科学家艾哈迈德·泽维尔使“运用激光技术观察化学反应时分子中原子的运动”成为可能,在他的研究中证实了光可诱发下列变化:

这一事实可用于解释人眼的夜视功能,有关X、Y的叙述不正确的是
A、X和Y与氢气加成后生成同一种物质 B、上述变化是一个物理过程 C、X和Y都可以发生加聚反应 D、X和Y物理性质有差异