相关试卷
-
1、下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去
2min后,试管里出现凝胶
非金属性:
B
向溶液中通入和气体X
出现白色沉淀
气体X一定具有氧化性
C
在溶液中加入KI溶液,再加入苯,振荡
有白色沉淀生成,苯层呈紫红色
白色沉淀可能为CuI
D
分别测量溶液和溶液的pH
后者pH更大
比更容易结合
A、A B、B C、C D、D -
2、多巴胺的一种合成路线如下图所示:

下列说法正确的是
A、1mol甲最多可以和发生取代反应 B、乙与足量的完全加成后的产物中含有4个手性碳原子 C、丙分子中所有原子可能在同一个平面上 D、多巴胺可与碳酸钠溶液反应,产生气泡 -
3、下列关于电化学腐蚀、防护与利用的说法正确的是




A.铜板打上铁铆钉后,铜板更易被腐蚀
B.牺牲阳极防护输水管腐蚀
C.连接锌棒后,电子由铁管道流向锌
D.外加电流保护
A、A B、B C、C D、D -
4、反应的能量变化如图所示,下列说法正确的是
 A、其它条件不变,和在表面接触反应,可加快该反应速率 B、 C、反应达到限度时,增大容器容积能增大正反应速率 D、每转移电子2mol,有11.2L的被还原
A、其它条件不变,和在表面接触反应,可加快该反应速率 B、 C、反应达到限度时,增大容器容积能增大正反应速率 D、每转移电子2mol,有11.2L的被还原 -
5、下列有关SO2、SO3、、的说法正确的是A、SO2的空间构型为四面体 B、SO3分子中S采取杂化方式 C、中的键角大于SO3中的键角 D、浓H2SO4中H2SO4分子间能形成氢键
-
6、阅读下列材料,完成下列小题。
碱金属和碱土金属元素分别位于元素周期表的ⅠA族和ⅡA族,它们的化合物应用广泛。历史上曾以NaCl为原料生产NaOH作为化学工业开端的标志。是强氧化剂,熔融条件下可将氧化为。格氏试剂(如)在有机化学中有重要用途。受热分解最终生成MgO。
(1)、下列物质性质与用途不具有对应关系的是A、能与水和反应生成 , 可用作供氧剂 B、溶液能导电,可用来冶炼金属镁 C、能跟盐酸反应,可用于治疗胃酸过多 D、MgO是碱性氧化物,可用于吸收燃煤烟气中的(2)、下列说法不正确的是A、电解饱和NaCl溶液的阴极反应: B、甲醛和的反应: C、钠与硫酸铜溶液的反应: D、与共熔的反应: -
7、《新修本草》中描述“青矾”为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”。下列由废铁屑制取的实验原理与装置不能达到实验目的的是
 A、用装置甲除去废铁屑表面的油污 B、用装置乙加快废铁屑的溶解 C、用装置丙过滤得到溶液 D、用装置丁蒸干溶液获得
A、用装置甲除去废铁屑表面的油污 B、用装置乙加快废铁屑的溶解 C、用装置丙过滤得到溶液 D、用装置丁蒸干溶液获得 -
8、三氯化六氨合钴是一种重要的化工产品,实验室可用反应制备。下列有关说法正确的是A、是非极性分子 B、中子数为18的氯原子可表示为 C、O原子的基态原子电子排布图:
 D、1mol中含有24mol共价键
D、1mol中含有24mol共价键
-
9、化学与生产、生活、科技等方面密切相关,下列说法正确的是A、德尔塔新冠病毒有可能在空气中以气溶胶的形式传播,气溶胶属于胶体 B、中科院首次实现了CO2合成淀粉,淀粉、蛋白质和油脂是人体必需的高分子营养物质 C、光化学烟雾、臭氧层空洞、温室效应的形成都与二氧化碳有关 D、乙醇常用于医疗消毒,浓度越高消毒效果越好
-
10、明矾是一种常用的净水剂,以废易拉罐(主要成分为铝和少量不溶于碱性溶液的物质)为原料制取明矾的实验流程如图。

已知:“沉铝”步骤在煮沸条件下进行,生成、和。
下列说法错误的是
A、“碱溶”步骤中发生反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ B、可通过焰色试验检验“沉铝"所得滤液中的主要阳离子 C、用浓硫酸配制9mol/L H2SO4溶液,需要将水缓慢加入到浓硫酸中 D、“一系列操作”中还需要加入的试剂是K2SO4 -
11、富马酸伏诺拉生(K)可用于根除幽门螺杆菌和反流性食管炎的治疗,其一种常见的合成路线下所示:

回答下列问题:
(1)、C中含有氰基(-CN),其结构简式为。(2)、D中含氧官能团的名称为和。(3)、F与CuO在加热条件下也能生成G,其化学方程式为。(4)、下列说法正确的是。a.A中最多有16个原子共平面 b.在水中的溶解度:E<F
c.G→H的反应类型为取代反应 d.J的名称为顺丁烯二酸
(5)、A的同分异构体中,含有苯环,且能发生银镜反应的有种(不考虑立体异构)。(6)、H→I的反应可能分为三步(已知第一步为加成反应):H中间产物1中间产物2I
写出中间产物1和2的结构简式分别为和。
-
12、工业合成氨反应是在催化剂表面上进行的,其反应历程如下(*表示吸附态):
化学吸附:
表面反应:
脱附:其中,的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
回答下列问题:
(1)、①催化剂的选择是合成氨的核心技术之一,使用催化剂1或催化剂2合成氨,产氨速率与温度的关系如图。
根据由图判断,活化能(填“>”“=”“<”)。
②分析说明原料气中过量的理由
(2)、反应到平衡时,正、逆反应的速率方程分别为: , 为速率常数,已知 , 据此计算(3)、合成氨中所使用的原料氢气可将二氧化碳转化为高附加值化学品 , 在催化剂作用下主要发生以下反应。甲醇的选择性。I.
II.
①在恒容容器中温度升高甲醇的选择性(填:“增大”“减小”或“不变”)
②恒温恒容条件下,原料气以物质的量投料在初始压强为下进行反应。达到平衡时的选择性为 , 转化率为。则该条件下反应II的分压平衡常数。(对于气相反应,用组分B的平衡代替 , 记作。 , p为平衡总压,为平衡系统中B的物质的量分数。)
(4)、研究表明,对催化加氢也有一定催化效果,取干燥在气条件下加热,热重分析显示样品一直处于质量损失状态;X射线衍射分析结果表明随着温度升高,该晶胞边长变长,但铈离子空间排列没有发生变化。
加热后,当失重率(损失的质量/总质量)为时,每个晶胞拥有的的个数为。
-
13、
某化学兴趣小组利用邻二氮菲
 分光光度法测定水中微量铁。
分光光度法测定水中微量铁。已知:
i.在为溶液中,邻二氮菲与生成稳定的橙红色配合物,显色反应为
ii.根据朗伯比耳定律: , 当入射光波长及光程L(比色皿厚度)一定时,在一定浓度范围内,有色物质的吸光度A与该物质的浓度c成正比。
I.溶液配制
(1)用滴定管量取铁储备液 , 置于棕色容量瓶中加入溶液,用蒸馏水稀释至刻度,摇匀,得到铁标准溶液。此过程中除了用到容量瓶、滴定管和玻璃棒外,还需要的仪器有(填字母)。洁净的容量瓶在使用之前需要进行的操作是。
Ⅱ.邻二氮菲吸收曲线的绘制
(2)用滴定管量取铁标准溶液 , 经试剂处理后采用不同的波长为横坐标,由计算机绘制A与的吸收曲线如图,确定最大吸收波长。
在显色前,首先用盐酸羟胺( , 强电解质)将还原成。其反应离子方程式为。试剂处理时需要加入缓冲溶液使溶液的保持在合适范围,若过高,会造成;若过低,会造成。
(3)邻二氮菲配合物中配位原子个数为。(4)从吸收曲线可知,邻二氮菲配合物最大吸收波长 , 在此波长下,该配合物的摩尔吸光系数 , 若某次测量时溶液的吸光度 , 比色皿厚度 , 则溶液中的浓度为(保留两位有效数字)。 -
14、用钒铬矿(主要成分是制备和的流程如下:

已知:①“酸浸”后转化为;②的近似为;
(1)、基态原子的核外电子有种空间运动状态。(2)、“氧化”后溶液中大量存在 , 请写出相应的离子方程式:。(3)、氧化所得溶液中含有一种复杂的含钒阴离子结构如图所示,由4个四面体(位于体心的V为+5价),通过共用顶点氧原子构成八元环,其化学式为。 (4)、调时使用的是氨水和氯化铵的混合溶液,沉钒率受温度影响的关系如图所示。温度高于沉钒率降低的主要原因是(5)、常温下,若“含溶液”中 , 则“沉钒”调的范围是。(6)、请写出煅烧生成的化学方程式:(7)、可用于测定水体的(是指每升水样中还原性物质被氧化所需要的质量)。现有某水样 , 酸化后加入的溶液 , 使水样中的还原性物质完全被氧化,再用的溶液滴定剩余的 , 被还原为 , 消耗溶液 , 则该水样的为。
(4)、调时使用的是氨水和氯化铵的混合溶液,沉钒率受温度影响的关系如图所示。温度高于沉钒率降低的主要原因是(5)、常温下,若“含溶液”中 , 则“沉钒”调的范围是。(6)、请写出煅烧生成的化学方程式:(7)、可用于测定水体的(是指每升水样中还原性物质被氧化所需要的质量)。现有某水样 , 酸化后加入的溶液 , 使水样中的还原性物质完全被氧化,再用的溶液滴定剩余的 , 被还原为 , 消耗溶液 , 则该水样的为。 -
15、菠萝中含有一种难溶于水的草酸钙针晶,这是菠萝“扎嘴”的原因之一。常温下,草酸钙在不同下,体系中与关系如下图所示(M代表),已知。下列有关说法正确的是
 A、①表示的浓度变化 B、A点时,溶液 C、将等浓度的草酸溶液和澄清石灰水按体积比混合,可得到B点溶液 D、时,曲线④呈下降趋势的原因是生成了沉淀
A、①表示的浓度变化 B、A点时,溶液 C、将等浓度的草酸溶液和澄清石灰水按体积比混合,可得到B点溶液 D、时,曲线④呈下降趋势的原因是生成了沉淀 -
16、一定条件下,丙烯与反应生成和的反应历程如图所示。下列说法错误的是
 A、比更稳定 B、合成的反应中,第I步为反应的决速步骤 C、反应中既有极性键的断裂和形成,又有非极性键的断裂和形成 D、其他条件不变,适当升高温度可以提高加成产物中的比例
A、比更稳定 B、合成的反应中,第I步为反应的决速步骤 C、反应中既有极性键的断裂和形成,又有非极性键的断裂和形成 D、其他条件不变,适当升高温度可以提高加成产物中的比例 -
17、自由基电解法可将有机物自由基和反应转化为羧酸,已知芳香烃
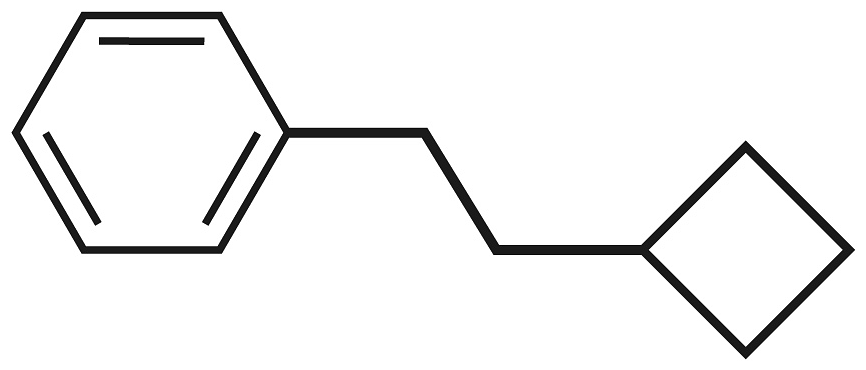 可断裂成
可断裂成 和
和 两个自由基,其电解装置如下图所示。下列说法正确的是
两个自由基,其电解装置如下图所示。下列说法正确的是 A、
A、 分子中有1个手性碳原子
B、电源a端电势高于b端
C、当电路中通过电子时,右侧电极室溶液的质量减少
D、左侧电极室的电极反应方程式之一为
分子中有1个手性碳原子
B、电源a端电势高于b端
C、当电路中通过电子时,右侧电极室溶液的质量减少
D、左侧电极室的电极反应方程式之一为

-
18、向溶液中滴入混合液,得到晶体M,其每个晶胞由两个小立方体构成,中N位于小立方体的体心,小立方体的边长为 , 晶胞结构如图。下列说法错误的是
 A、在元素周期表第六周期ⅡB族 B、该晶体类型为离子晶体 C、中,距离为 D、1个晶胞中含有的质量为
A、在元素周期表第六周期ⅡB族 B、该晶体类型为离子晶体 C、中,距离为 D、1个晶胞中含有的质量为 -
19、为研究反应在不同条件下的转化率,向恒压反应器中通入含一定浓度与的气体,在无催化剂和有催化剂在时,分别测得不同温度下反应器出口处的转化率如图中曲线a、b所示(图中虚线表示相同条件的平衡转化率随温度的变化),下列说法不正确的是
 A、反应的 B、曲线a中转化率随温度升高而增大,是由于反应速率变快 C、曲线b中从M点到N点,转化率随温度升高而减小是由于催化剂活性减弱 D、催化剂存在时,其他条件不变,增大气体 , 转化率随温度的变化为曲线c
A、反应的 B、曲线a中转化率随温度升高而增大,是由于反应速率变快 C、曲线b中从M点到N点,转化率随温度升高而减小是由于催化剂活性减弱 D、催化剂存在时,其他条件不变,增大气体 , 转化率随温度的变化为曲线c -
20、已知X、Y、Z、W为原子序数依次增大的前20号主族元素,四种元素均位于不同周期。其中X、Y、Z三种元素原子序数为等差数列,基态Y原子s轨道电子数与p轨道电子数相等,基态W原子核外无未成对电子。下列说法正确的是A、电负性: B、X与Y、Z、W均可形成化合物,且晶体类型相同 C、Z的氧化物的水化物是强酸 D、W与Y形成的化合物能与水反应,反应类型一定为化合反应