相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、下列物质中,属于电解质的是A、Cu B、熔融BaSO4 C、KOH溶液 D、盐酸
-
2、当光束通过下列分散系时,能出现丁达尔效应的是A、盐酸 B、淀粉溶液 C、石灰乳 D、CuSO4溶液
-
3、化学源自古代的生活和生产实践,下列生产过程不涉及化学变化的是A、烧制陶器 B、酿造米酒 C、琢磨玉器 D、冶炼金属
-
4、实施人工增雨作业对缓解旱情、助力春耕春播发挥了积极作用。人工增雨火箭弹使用的AgI所属的物质类别是A、酸 B、碱 C、盐 D、氧化物
-
5、第24届冬季奥林匹克运动会将在北京举行,其金牌如下图所示。下列说法不正确的是。
 A、金牌的主要成分属于无机物 B、金牌挂带由桑蚕丝制成,桑蚕丝属于有机物 C、金牌上有祥云花纹,自然界云、雾不属于胶体 D、金牌上有冰、雪图案,冰和雪的主要成分相同
A、金牌的主要成分属于无机物 B、金牌挂带由桑蚕丝制成,桑蚕丝属于有机物 C、金牌上有祥云花纹,自然界云、雾不属于胶体 D、金牌上有冰、雪图案,冰和雪的主要成分相同 -
6、已知: , 向一恒温恒容的密闭容器中充入1molA和3molB发生反应,时达到平衡状态Ⅰ,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
 A、容器内压强不变,表明反应达到平衡 B、时改变的条件:从容器中转移C C、平衡常数K: D、平衡时A的体积分数:
A、容器内压强不变,表明反应达到平衡 B、时改变的条件:从容器中转移C C、平衡常数K: D、平衡时A的体积分数: -
7、已知如下热化学方程式:
①
②
③
则下列判断正确的是
A、 B、 C、 D、反应③是吸热反应 -
8、下列各组物质不互为同素异形体的是A、臭氧和氧气 B、红磷和白磷 C、金刚石和石墨 D、冰和干冰
-
9、含氮杂环化合物的合成在生命科学领域具有重大意义。一种以正丁胺、丙烯醛和苯酚为主要有机原料合成ⅸ的路线如下(加料顺序、反应条件略):
 (1)、化合物ⅱ的分子式为;其分子中所含官能团的名称为。(2)、反应④中,在催化剂条件下,化合物V可以与M直接反应生成化合物ⅵ,该反应原子利用率为100%。则M为(填化学式)。(3)、根据化合物ⅰ的结构特征,分析预测其可能的化学性质,完成下表。
(1)、化合物ⅱ的分子式为;其分子中所含官能团的名称为。(2)、反应④中,在催化剂条件下,化合物V可以与M直接反应生成化合物ⅵ,该反应原子利用率为100%。则M为(填化学式)。(3)、根据化合物ⅰ的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂和条件
反应形成的新结构
反应类型
a
新制碱性悬浊液,加热
b
HBr,加热
加成反应
(4)、化合物ⅷ的芳香族同分异构体中,满足下列条件且核磁共振氢谱显示为4组峰,峰面积之比为的结构简式为。a.能发生水解反应; b.能发生银镜反应; c.苯环上只有两个取代基。
(5)、关于反应⑦的说法中,正确的有_______(填序号)。A、反应物ⅳ中碳原子杂化方式相同 B、反应过程中,有C—O键和C=O键断裂 C、正丁胺中的N原子上有孤电子对显碱性 D、产物ⅸ中新形成的五元杂环不能发生水解反应(6)、以丙烯醛和苯酚为有机含碳原料,利用题目中的信息,合成化合物X。基于你设计的合成路线,回答下列问题:
i.最后一步反应中,含有苯环的反应物为(写结构简式)。
ii.相关步骤涉及羧基与甲醇的酯化反应,其化学方程式为。
-
10、具有还原性、碱性,而且能提供孤电子对形成配合物,在多种反应中具有广泛应用。(1)、选择性催化还原技术可以用来减少柴油车尾气中氮氧化物的排放,其主要反应如下:
(标准SCR反应)
(快速SCR反应)
①有存在条件下,反应中可能发生的催化氧化生成NO的副反应,其化学方程式为。
②为了更高效除去柴油车尾气中的 , 在SCR反应前将部分NO氧化为至关重要,反应的(用和列式表达)。
③某催化剂可加快NO催化氧化的反应速率,当温度和NO的浓度恒定时,初始反应速率与浓度的关系如图1所示,催化剂表面的活性位点用*标示,首先会吸附在催化剂表面分解为O原子形成O—*结构,则该催化机理可能是(选“A”或“B”)。

A. B.
(2)、我国科研人员开发了一种全新电化学方法,设计一种钉配合物催化的氧化直接高效选择性合成 , 其合成原理如图2所示。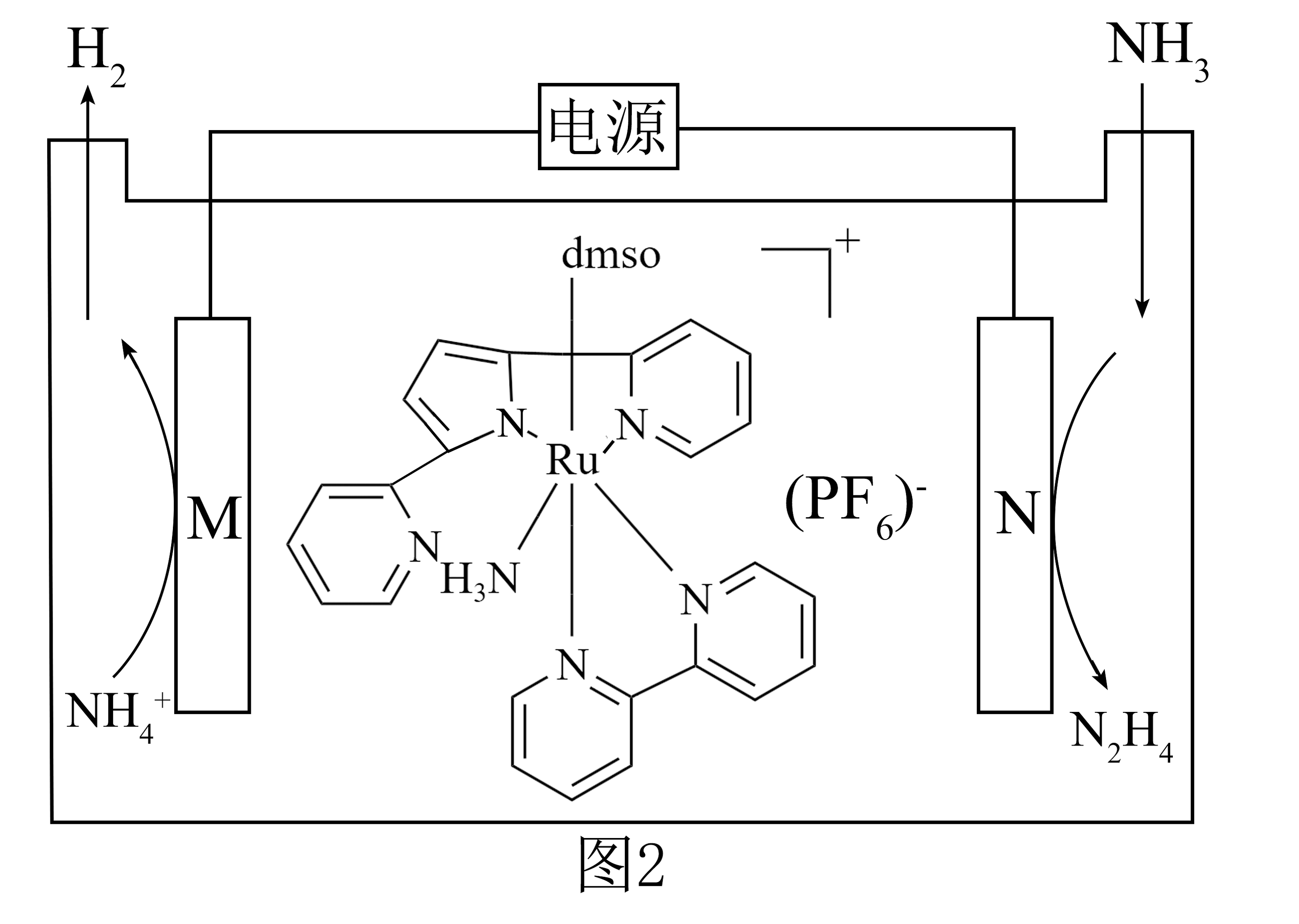
①电极N是电解池的极。
②该电解池的总反应方程式为。
③在电化学领域还有很多应用,请写出一种在原电池中的可能用途:。
(3)、溶液中能与很多金属阳离子形成配合物,配合物稳定常数可以用来描述配体与配离子之间相互作用的强度,其定义如下(M代表中心金属原子或金属离子,L代表配体,n代表配体数量):①银氨溶液中,(填写表达式)。
②通过计算说明0.05molAgCl能否完全溶解于体积为1L、浓度为的氨水中:。(已知: , , 忽略的电离)
-
11、铋(Bi)及其化合物在医药、电子、量子材料等高精尖领域有重要的应用。一种从电解铜的副产物阳极泥熔炼渣(主要含、Ag、As、Au和少量的Pb、Ca等元素)中提取铋及贵金属银和金的工艺如图。已知:的氧化性强于。
 (1)、Bi位于元素周期表第六周期第ⅤA族,其基态原子的价层电子排布式为。(2)、“酸溶”时,以形式进入浸出液中,反应的离子方程式为。(3)、在溶液中会发生水解反应 , 结合平衡移动原理,解释“沉铋”时NaOH的作用:。(4)、经过“酸溶”后,Au和Ag在滤渣中进一步富集,“溶金”的过程中Au转化为 , “操作I”之后可以重新得到金粉,则X可能是_______。A、 B、 C、NaOH D、NaCl(5)、“脱砷”时,会转化为可溶的 , 该过程发生反应的化学方程式为。(6)、用Fe“还原”时,并没有隔绝空气。一定温度下,Bi的沉淀率随反应进行会先增大后减小。解释一段时间后Bi的沉淀率逐渐减小的原因:。(7)、合金化合物是一种优异的半金属量子材料,其一种晶胞结构以及晶胞参数如图所示(部分金属键省略)。该晶胞中含Na原子个,该晶胞的密度为(列出表达式即可)。
(1)、Bi位于元素周期表第六周期第ⅤA族,其基态原子的价层电子排布式为。(2)、“酸溶”时,以形式进入浸出液中,反应的离子方程式为。(3)、在溶液中会发生水解反应 , 结合平衡移动原理,解释“沉铋”时NaOH的作用:。(4)、经过“酸溶”后,Au和Ag在滤渣中进一步富集,“溶金”的过程中Au转化为 , “操作I”之后可以重新得到金粉,则X可能是_______。A、 B、 C、NaOH D、NaCl(5)、“脱砷”时,会转化为可溶的 , 该过程发生反应的化学方程式为。(6)、用Fe“还原”时,并没有隔绝空气。一定温度下,Bi的沉淀率随反应进行会先增大后减小。解释一段时间后Bi的沉淀率逐渐减小的原因:。(7)、合金化合物是一种优异的半金属量子材料,其一种晶胞结构以及晶胞参数如图所示(部分金属键省略)。该晶胞中含Na原子个,该晶胞的密度为(列出表达式即可)。
-
12、
过硫酸钾中因含有过氧键而具有强氧化性,某小组设计实验探究和NaI反应的化学反应速率与反应物物质的量浓度之间的定量关系。
(1)配制250mL的NaI溶液,需要称取NaI固体g,该过程中用到的玻璃仪器除了玻璃棒、量筒和烧杯外,还需要下图中的(填写仪器编号)。
A.
 B.
B. C.
C. D.
D.
(2)与NaI在水溶液中反应的离子方程式为①,该过程中,(填元素符号)被还原。
【查阅资料】反应①的速率方程为 , 其中v为化学反应速率,k为反应速率常数(仅仅与温度有关),a和b为对应反应物的反应级数,反应级数越大表示该反应物浓度对反应速率的影响越大。为了测出一定时间内反应①的平均反应速率,反应体系中加入少量已知浓度的溶液和淀粉溶液,在反应①进行的同时,也会发生反应:(反应速率极快)②。
(3)反应体系中加入淀粉溶液的目的是。
(4)若反应体系中溶液的初始物质的量浓度为 , 记录淀粉变蓝的时间为 , 则反应①中以表示的平均化学反应速率(用含c和t的式子表示)。
【实验内容】室温下,用浓度均为的、NaI、和 , 的以及0.2%的淀粉溶液,按下表配制一系列溶液,全部加入烧杯中并混合均匀,当最后加入溶液时立即计时,记录淀粉溶液变蓝的时间,并计算对应的。已知和对上述反应没有影响。
序号
/mL
/mL
/mL
/mL
/mL
/mL
/
I
20
20
0
0
8
2
II
10
m
10
0
8
2
III
5
20
15
0
8
2
IV
20
10
0
n
8
2
V
20
5
0
15
8
2
(5)根据表中信息,补充数据:m= , n=。
(6)上述实验(填序号)是探究NaI物质的量浓度对该化学反应速率的影响。
【数据处理并得出结论】
(7)若反应级数多为正整数,请在表中选取合适数据,将下图补充完整(若描点,需在旁边写出该点纵坐标的值)并根据选定的数据计算出该反应中反应级数b的数值。

(8)通过数据分析,该反应中对该化学反应速率的影响(请填写“>”“<”或“=”)。
-
13、多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现时(各物质均为气态),甲醇与水在铜催化剂上的反应机理和能量图如图,下列说法不正确的是
 A、反应Ⅰ和反应Ⅱ相比,反应Ⅱ速率更快 B、反应Ⅱ是放热反应,但是反应Ⅰ和Ⅱ总的反应过程是吸热的 C、铜催化剂不参与反应过程,但是会影响反应速率 D、CO在反应中生成又消耗,但CO并不是催化剂
A、反应Ⅰ和反应Ⅱ相比,反应Ⅱ速率更快 B、反应Ⅱ是放热反应,但是反应Ⅰ和Ⅱ总的反应过程是吸热的 C、铜催化剂不参与反应过程,但是会影响反应速率 D、CO在反应中生成又消耗,但CO并不是催化剂 -
14、前四周期元素W、X、Y、Z的原子序数依次增大,且都不在同一周期。X的价电子排布式为 , Y的最高能级单电子数是W的3倍,Z与W的单电子数、最外层电子数均相同,但两者族序数不同。下列说法不正确的是A、X元素的第一电离能高于其相邻元素 B、X和Y与氯原子都可以结合成五氯化物 C、Y原子核外电子有9种空间运动状态 D、Z在元素周期表中的第四周期第ⅠB族
-
15、球磨-点击化学在氧化铝负载铜表面高效进行,具有缩短时间、降温并减少催化剂的作用,产率高达96%。下列说法正确的是
 A、a、b、c均可以发生加成反应 B、a通过水解反应得苯酚 C、b的名称是苯乙烯 D、c中有2个碳原子具有手性
A、a、b、c均可以发生加成反应 B、a通过水解反应得苯酚 C、b的名称是苯乙烯 D、c中有2个碳原子具有手性 -
16、某班级同学在学习金属元素的性质和应用时,进行了一系列实验和讨论。结合他们的学习成果,下列说法不正确的是A、镁条在空气中燃烧会发出刺眼的白光,可应用于照明弹和烟火制造 B、钠和钾与水的反应非常剧烈,在日常生活中很少被直接应用 C、钙是建筑材料水泥和玻璃的主要成分,且钙离子对人体健康有重要作用 D、铜因其优良的导电性和导热性,在电力、电子、建筑等领域有广泛的应用
-
17、尘埃落在平整的铁制品的表面上,水蒸气在尘粒下形成薄水层,尘粒覆盖的中心部分供氧较少,而在尘粒的边缘有较多的 , 实际腐蚀情况如图。下列说法不正确的是
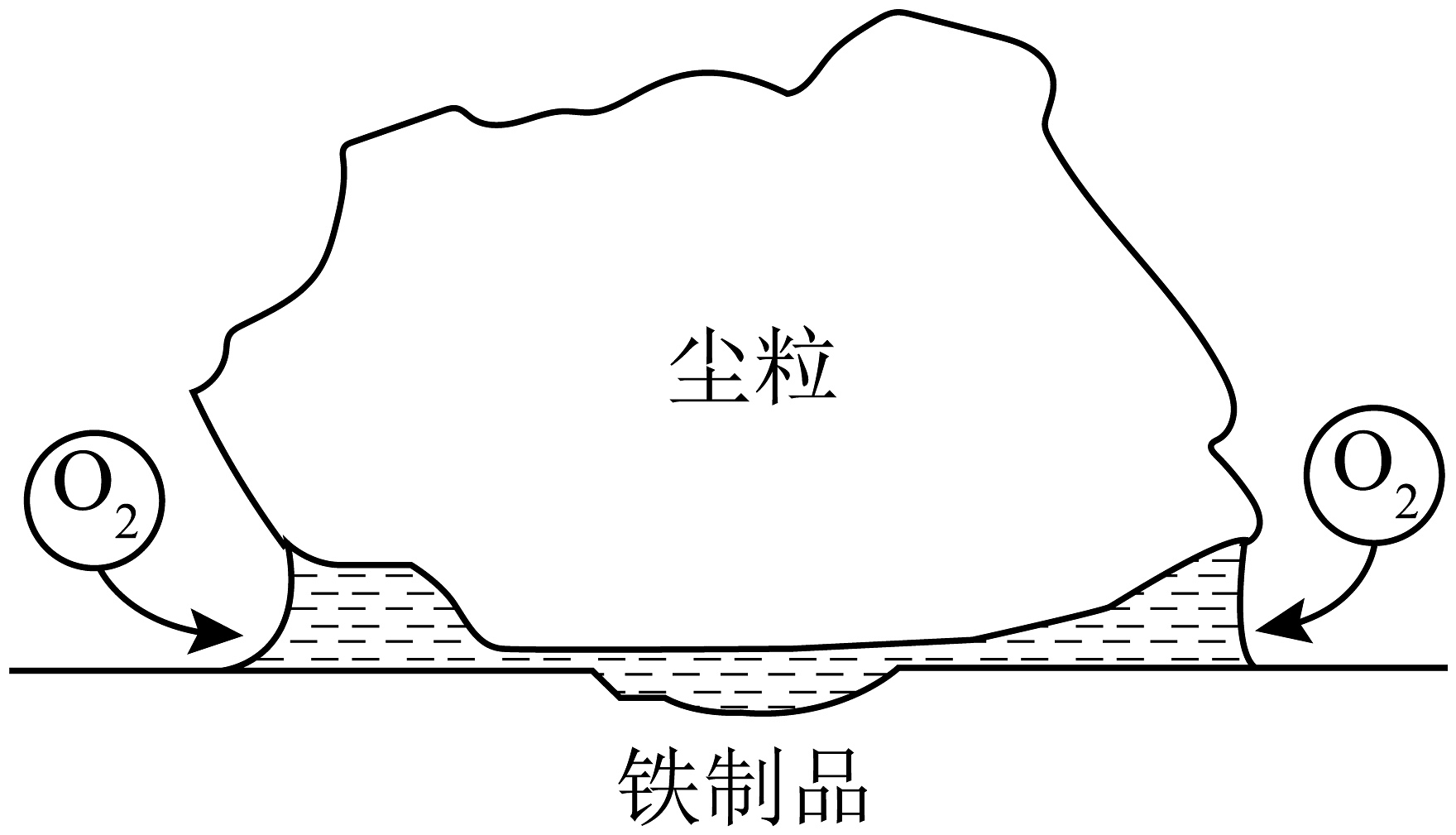 A、空气中含有、会加快腐蚀 B、铁制品被腐蚀的最终产物是FeO C、铁制品的溶解主要发生在尘粒的中部 D、边缘区反应为
A、空气中含有、会加快腐蚀 B、铁制品被腐蚀的最终产物是FeO C、铁制品的溶解主要发生在尘粒的中部 D、边缘区反应为 -
18、以下关于物质结构与性质的描述,正确的是A、分子呈三角锥形结构,其中的N原子采用杂化 B、NaCl晶体中,和以分子形式存在于晶胞中 C、金刚石和石墨的不同性质源于它们有相同的原子排列方式 D、分子呈V形,分子间有氢键,沸点比的低
-
19、在日常生活中,下列应用与高分子化学密切相关的是A、利用太阳能电池发电 B、人工合成塑料材料 C、金属氧化物制作电子元件 D、普通玻璃的制造
-
20、“嫦娥五号”探测器从月球采集的样品中发现了一种新的水合矿物,其化学式可表示为。关于这种矿物,下列说法正确的是A、该矿物中的水分子与地球上的液态水形态相同 B、该矿物属于碱式盐 C、该矿物中阳离子与阴离子的数目之比为 D、该矿物中和的质子数相同但中子数不同