相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、柠檬酸加热时可发生如下的转化:

下列说法正确的是
A、柠檬酸、顺乌头酸、异柠檬酸互为同分异构体 B、柠檬酸可以在Cu作催化剂、加热的条件下与O2发生催化氧化反应 C、1mol柠檬酸与足量NaOH溶液反应,最多可以消耗4molNaOH D、顺乌头酸转化为异柠檬酸的反应属于加成反应 -
2、工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下图所示:

对上述流程的判断正确的是
A、试剂X可以为NaOH溶液,“沉淀”中含有铁的化合物 B、CO2可以用稀硫酸或稀盐酸代替 C、Y为Na2CO3溶液 D、工业上还可采用Fe高温还原Al2O3的方法制Al -
3、工业上从含硒的废液中提取硒的方法之一是用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸 , 再与盐酸共热,硒酸转化为亚硒酸,反应方程式为。在亚硒酸溶液中通入 , 有单质硒析出。下列说法错误的是A、氧化性: B、亚硒酸与生成单质硒的反应可能生成 C、析出硒需要消耗标准状况下 D、亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸
-
4、W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体:Y是短周期主族元素中金属性最强的元素;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是A、X与W元素、X与Y元素都可形成不止一种二元化合物 B、W的氧化物对应的水化物是氧化性强酸 C、最简单氢化物的稳定性: D、最简单氢化物的沸点:
-
5、下图是实验室进行制备与性质实验的组合装置,部分固定装置和装置B前后的干燥装置未画出。下列有关说法确的是
 A、为防止环境污染,装置C和E中的试剂均取用饱和的石灰水 B、关闭 , 打开 , 滴加硫酸,则装置B中每消耗 , 转移电子 C、关闭 , 打开 , 试剂X是酸性溶液或溶液,均可证明有还原性 D、实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
A、为防止环境污染,装置C和E中的试剂均取用饱和的石灰水 B、关闭 , 打开 , 滴加硫酸,则装置B中每消耗 , 转移电子 C、关闭 , 打开 , 试剂X是酸性溶液或溶液,均可证明有还原性 D、实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性 -
6、某温度下,化学反应的能量变化如下图所示,分子内原子均以单键结合。则下列说法正确的是
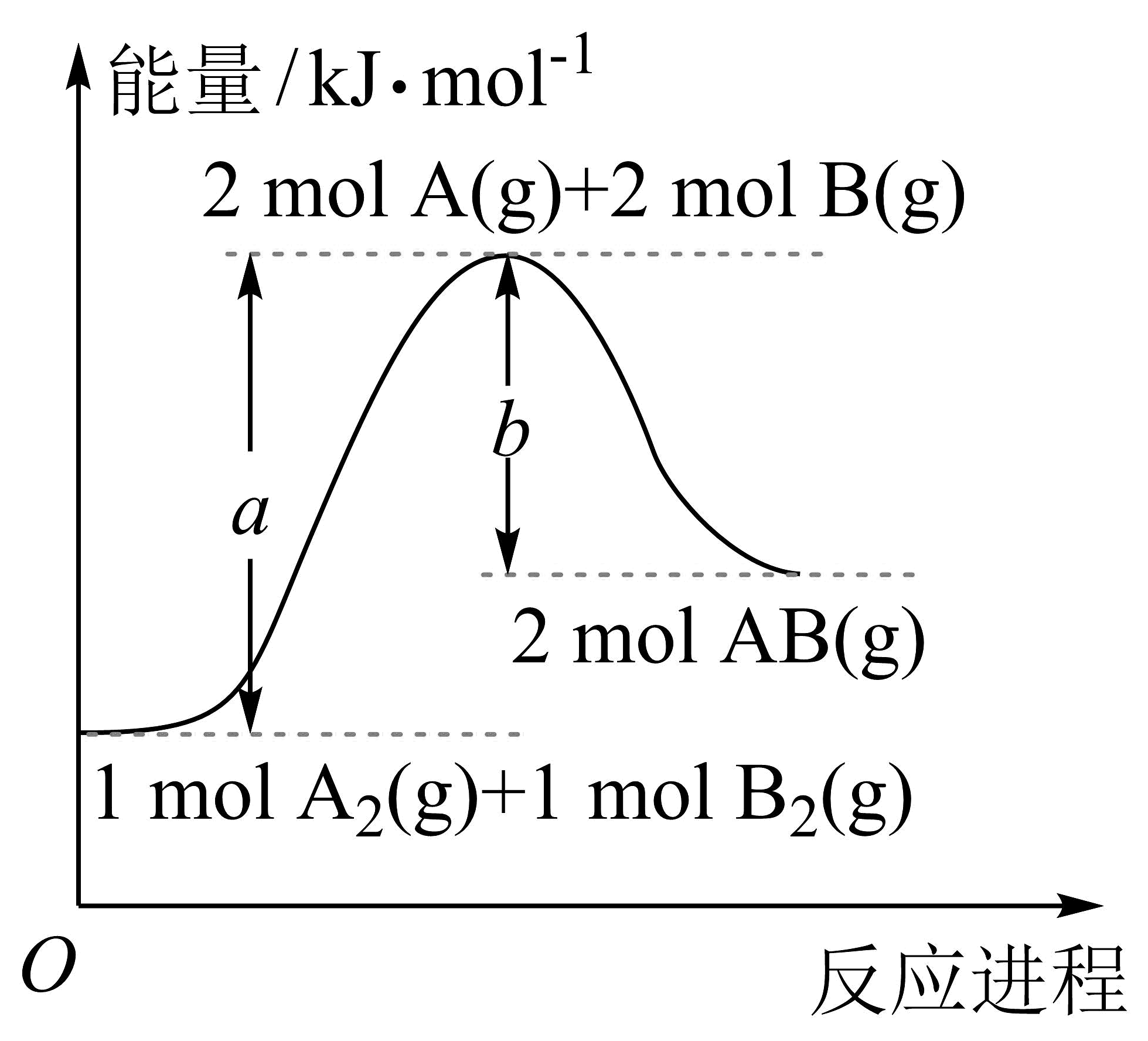 A、该反应是放热反应 B、加入催化剂可以改变反应的热效应 C、断裂需要吸收的能量 D、和具有的能量为
A、该反应是放热反应 B、加入催化剂可以改变反应的热效应 C、断裂需要吸收的能量 D、和具有的能量为 -
7、一种锌-溴电池原理示意图如下图所示,隔膜为阳离子交换膜(只允许阳离子通过)。下列说法错误的是
 A、电子从电极a经导线流向电极b B、在电池内部,阳离子由电极a往电极b方向移动 C、电极b为负极,发生的电极反应为 D、每消耗 , 理论上转移电子
A、电子从电极a经导线流向电极b B、在电池内部,阳离子由电极a往电极b方向移动 C、电极b为负极,发生的电极反应为 D、每消耗 , 理论上转移电子 -
8、反应在一可变容积的容器中进行反应,下列条件的改变对其反应速率几乎无影响的是A、将容器的体积缩小一半 B、保持体积不变,充入N2 C、保持体积不变,升高温度 D、压强不变,充入N2使体积增大
-
9、下列离子能大量共存的是A、 B、 C、 D、
-
10、下列有关电极方程式或离子方程式书写正确的是A、过量NaHSO3溶液与澄清石灰水混合: B、氯气与水反应: C、锌、铜和稀硫酸组成的原电池正极发生的反应: D、硝酸亚铁稀溶液中加入稀硫酸:
-
11、下列实验装置或操作正确且能达到实验目的的是(部分夹持装置已略去)


A.制取并收集NH3
B.除去Cl2气体中混有的少量HCl气体


C.分离粗盐中的不溶物
D.灼烧碎海带
A、A B、B C、C D、D -
12、下列说法不正确的是A、食用油在空气中放置过久产生“哈喇”味,是因为其中的某些有机物发生了氧化反应 B、糖类都能在加热条件下与新制氢氧化铜反应生成砖红色沉淀 C、聚乙烯不能使酸性高锰酸钾溶液褪色 D、医用酒精消毒的原理是使蛋白质变性
-
13、下列化学用语表达错误的是A、HClO的电子式:
 B、质量数为195、中子数为117的铂原子:
C、乙醇的球棍模型:
B、质量数为195、中子数为117的铂原子:
C、乙醇的球棍模型: D、乙醛的结构简式:CH3COH
D、乙醛的结构简式:CH3COH
-
14、日常生活中经常用到各类材料,下列说法正确的是A、铝制餐具不宜长时间存放酸性食物,适合长时间存放碱性食物 B、新能源汽车上使用的半导体材料是一种新型陶瓷 C、与石墨互为同分异构体 D、天然橡胶、聚丙烯纤维、玻璃纤维都属于有机高分子材料
-
15、下列过程中的化学反应,相应的离子方程式正确的是A、稀盐酸中加入碳酸镁浊液: B、少量溶液与澄清石灰水反应: C、稀硫酸中加入氢氧化钡溶液: D、次氯酸钙溶液中通入少量:
-
16、关于反应:的叙述不正确的是A、既是氧化剂又是还原剂 B、发生了分解反应 C、只有氮元素价态变化了 D、氧化产物和还原产物质量比为9∶7
-
17、氢硫酸()是二元弱酸,常温下,某同学做了如下三组实验:
实验I:向溶液中滴加溶液
实验II:向溶液中滴加溶液
实验III:向溶液中滴加溶液
已知:的电离平衡常数 , , , 。忽略溶液混合后体积变化。
下列说法不正确的是
A、实验I中溶液体积为时,溶液中 B、实验I中溶液体积小于时,会发生反应 C、实验II不可以选用甲基橙作为指示剂 D、实验III中溶液体积为时,溶液等于1 -
18、托伐普坦是一种治疗心血管疾病的药物,其前体(L)合成步骤如图(部分试剂和条件略去)。
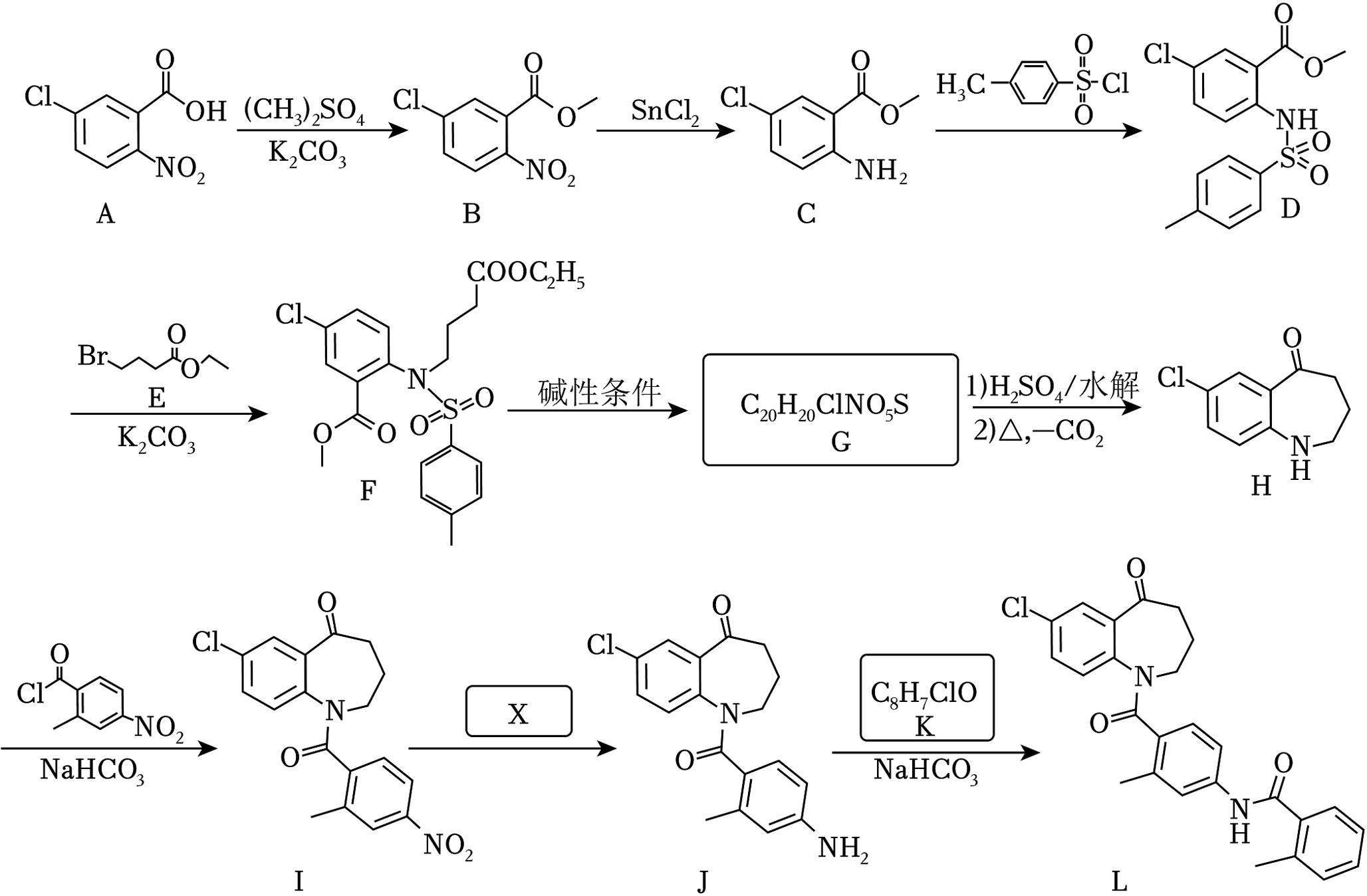
已知:

回答下列问题:
(1)、化合物A(填“能”或“不能”)形成分子内氢键。(2)、写出由C生成D的化学反应方程式。(3)、写出G的结构简式。(4)、H到I的反应类型是。(5)、参照上述合成路线,试剂X的化学式是。(6)、K完全水解后,有机产物的名称是。(7)、E的消去产物(C6H10O2)的同分异构体中,同时满足下列条件a、b和c的可能结构有种(立体异构中只考虑顺反异构);写出只满足下列条件a和c,不满足条件b的结构简式(不考虑立体异构)。a)能与饱和碳酸氢钠溶液反应产生CO2;
b)红外光谱中有碳碳双键特征吸收峰;
c)核磁共振氢谱峰面积比例为3∶3∶2∶1∶1。
-
19、氯及其化合物的“价-类”二维图。d、e属于钾盐。下列说法不正确的是
 A、b溶液久置后会转化为c B、电解饱和e溶液可以制取a C、往冷的溶液通入a可得到d和e D、d→e的转化可以用于制取氧气
A、b溶液久置后会转化为c B、电解饱和e溶液可以制取a C、往冷的溶液通入a可得到d和e D、d→e的转化可以用于制取氧气 -
20、回答下列问题:(1)、某同学进行了硫代硫酸钠与硫酸反应的有关实验,反应原理:Na2S2O3+H2SO4=S↓+SO2↑+H2O+Na2SO4 , 实验过程的数据记录如表:
实验编号
实验温度/℃
参加反应的物质
Na2S2O3
H2SO4
H2O
V/mL
c/(mol•L-1)
V/mL
c/(mol•L-1)
V/mL
1
20
10
0.1
10
0.1
0
2
20
5
0.1
10
0.1
5
3
20
10
0.1
5
0.1
5
4
40
5
0.1
10
0.1
5
①根据你所掌握的知识判断,在上述实验中,反应速率最快的可能是(填实验编号)。
②在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:1和2、1和3的组合比较,所研究的问题是。
③教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:。
(2)、现在实验室中模拟甲醇合成反应,在2L的恒容密闭容器中充入1molCO和2molH2 , 一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g)。测得CO和CH3OH(g)物质的量的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=。
②能够判断该反应达到平衡的是(填标号)。
A.CO、H2和CH3OH三种物质的浓度之比为1:2:1
B.密闭容器中混合气体的密度不再改变
C.CO的体积分数保持不变
D.相同时间内消耗1molCO,同时消耗1molCH3OH
E.每生成1molCH3OH,同时有2molH-H键断裂
(3)、一定温度,在催化剂作用下,可发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在2L恒容密闭容器中充入反应物[起始时:n(CO2):n(H2)=1:3]。某时刻,测得H2的转化率为60%。此时,H2的体积分数为%(保留三位有效数字)。(已知某物质的体积分数= , 列三段式求解,要求写出计算过程。)