相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、如图所示的电解装置可实现低电位下高效催化还原CO2。下列说法不正确的是( )
 A、a极连接外接电源的负极 B、电解过程中Na+从右池移向左池 C、b极的电极反应式为Cl--2e-+H2O=ClO-+2H+ D、外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L
A、a极连接外接电源的负极 B、电解过程中Na+从右池移向左池 C、b极的电极反应式为Cl--2e-+H2O=ClO-+2H+ D、外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L -
2、某小组实验验证“”为可逆反应,并通过测定浓度计算其平衡常数。
实验Ⅰ.将溶液和溶液等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ.将少量粉中与溶液混合,固体完全溶解。
下列说法错误的是
A、Ⅰ中反应的平衡常数 B、实验Ⅰ、Ⅱ说明为可逆反应 C、通过测定实验Ⅱ清液中的浓度计算其平衡常数 D、实验Ⅱ中,不宜用溶液代替溶液 -
3、微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法正确的是
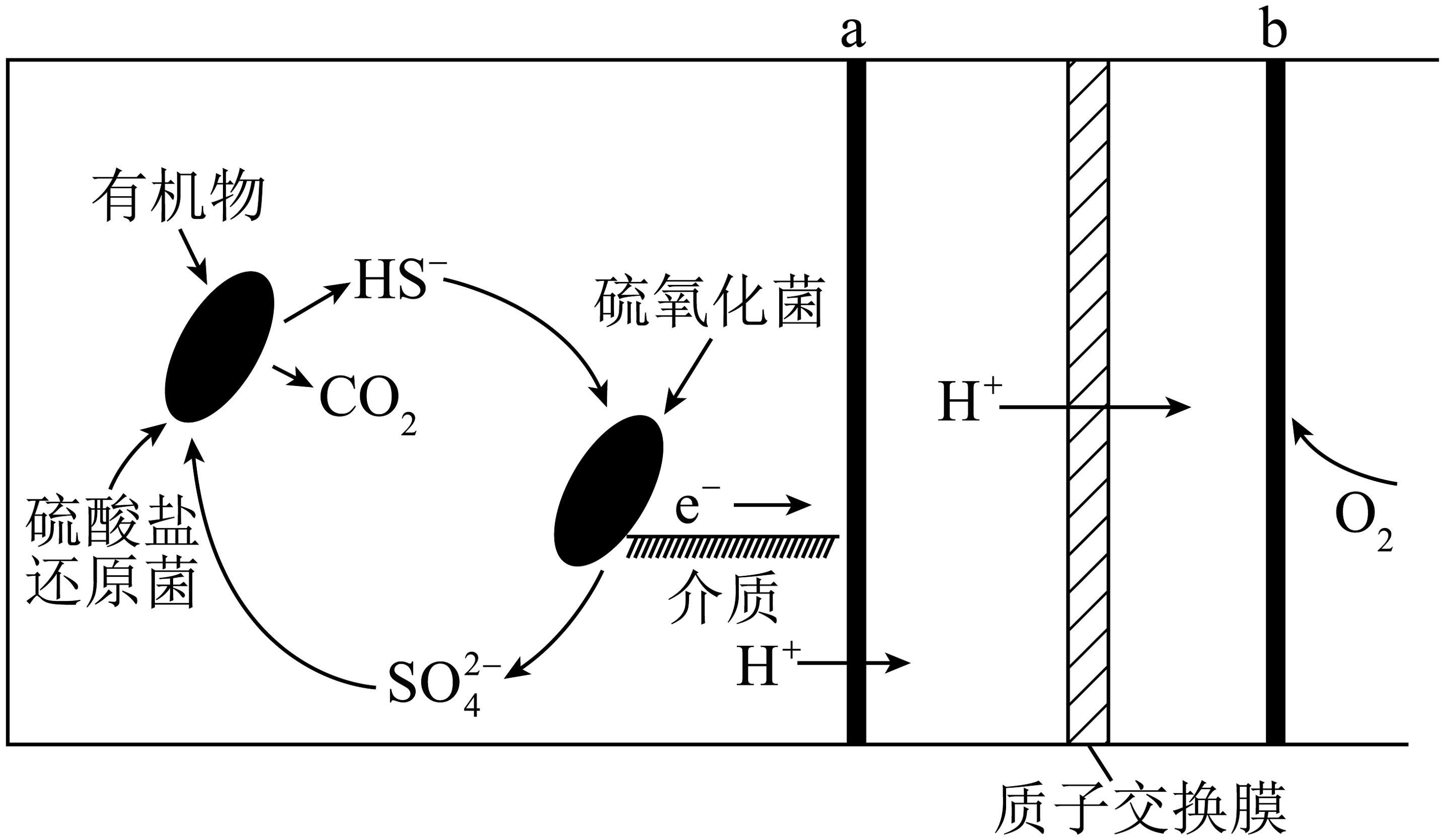 A、若该电池电路中有0.4mol电子发生转移,则有通过质子交换膜 B、该电池在高温条件下效率更高 C、如果将反应物直接燃烧,能量的利用率不会变化 D、在硫氧化菌作用下转化为的反应式:
A、若该电池电路中有0.4mol电子发生转移,则有通过质子交换膜 B、该电池在高温条件下效率更高 C、如果将反应物直接燃烧,能量的利用率不会变化 D、在硫氧化菌作用下转化为的反应式: -
4、时,下列说法不正确的是A、氢硫酸的电离平衡常数为: , 。氢硫酸中: B、pH相等的盐酸、溶液, , C、的番茄汁中是的牛奶中的倍 D、的溶液加水稀释至 , 稀释后溶液体积大于原溶液体积的10倍
-
5、普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜( 阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是
 A、电极a为粗铜,电极b为精铜 B、甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区 C、乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区 D、当电路中通过1mol电子时,可生成32g精铜
A、电极a为粗铜,电极b为精铜 B、甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区 C、乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区 D、当电路中通过1mol电子时,可生成32g精铜 -
6、受热分解是实验室制取氧气的一种方法。受热分解的能量变化如图所示。实验测得第一放热峰温度为 , 第二放热峰温度为。下列说法正确的是
 A、 B、时热分解的产物是KCl和 C、若用作催化剂热分解温度大于 D、曲线Ⅰ的活化能大于曲线Ⅱ,所以比稳定
A、 B、时热分解的产物是KCl和 C、若用作催化剂热分解温度大于 D、曲线Ⅰ的活化能大于曲线Ⅱ,所以比稳定 -
7、我国科研工作者研究与作用最终生成与的物质相对能量-反应进程曲线如下图,下列叙述不正确的是
 A、该反应过程中是催化剂 B、中间体比更稳定 C、该反应进程中的最大能垒(活化能)为 D、总反应的热化学方程式:
A、该反应过程中是催化剂 B、中间体比更稳定 C、该反应进程中的最大能垒(活化能)为 D、总反应的热化学方程式: -
8、铅蓄电池、镍镉碱性充电电池都是重要的二次电池。已知:铅蓄电池总的化学方程式为:;镍镉碱性充电电池放电时,正极反应为: , 负极反应式:。下列有关说法不正确的是A、放电时,在两个电极上生成 B、若用铅蓄电池为镍镉电池充电,则电极与电极相连接且两者的值均增大 C、镍镉碱性充电电池在充电时的反应为 D、放电一段时间后铅蓄电池其内阻明显增大,镍镉碱性电池内阻几乎不变
-
9、“中国芯”的主要原料是单晶硅,“精炼硅”反应历程中的能量变化如下图所示。下列有关描述正确的是
 A、历程Ⅰ,Ⅲ都是放热反应 B、历程Ⅱ的热化学方程式是: C、历程Ⅲ的热化学方程式是: D、实际工业生产中,粗硅变为精硅的过程中能量不损耗
A、历程Ⅰ,Ⅲ都是放热反应 B、历程Ⅱ的热化学方程式是: C、历程Ⅲ的热化学方程式是: D、实际工业生产中,粗硅变为精硅的过程中能量不损耗 -
10、下列有关电化学的装置与阐述正确的是
 A、图甲:负极的电极反应式为 B、图乙中A极为阳极,B极为阴极 C、图丙中高硅铸铁作为耗损阳极材料发挥作用 D、图丁是模仿氯碱工业验证溶液(含酚酞)的电解产物
A、图甲:负极的电极反应式为 B、图乙中A极为阳极,B极为阴极 C、图丙中高硅铸铁作为耗损阳极材料发挥作用 D、图丁是模仿氯碱工业验证溶液(含酚酞)的电解产物 -
11、下列事实不能用勒夏特列原理解释的有
①新制的氯水放置一段时间,溶液的pH会减小
②在配制硫酸亚铁溶液时往往要加入少量铁粉
③恒容容器中反应 达到平衡后,升高温度,气体颜色变深
④增大压强,有利于与反应生成
⑤检验:取少量待测液于试管中,加入浓溶液,加热,将湿润的红色石蕊试纸放在试管口
⑥除去中的:用酸性溶液洗气
⑦将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
⑧乙醇与乙酸反应制备乙酸乙酯时常加入稍过量的乙醇
A、3个 B、4个 C、5个 D、6个 -
12、明代诗人于谦的《石灰吟》是一首托物言志诗。下列反应类型与诗句“千锤万凿出深山,烈火焚烧若等闲”没有关联的是A、吸热反应 B、复分解反应 C、分解反应 D、熵增反应
-
13、某化学学习小组测定草酸晶体()的纯度,方法如下:
步骤I:用托盘天平称取草酸晶体样品10.0g,配制成250mL溶液;
步骤Ⅱ:每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定。
数据记录如下:
(已知:①在酸性环境下的还原产物是;②草酸是二元弱酸)
滴定次数
溶液起始读数/mL
溶液终点读数/mL
消耗溶液/mL
第一次
0.00
24.03
第二次
1.00
24.97
第三次
a
(1)、上述溶液与酸性溶液反应的离子方程式为。(2)、滴定时,将酸性标准液装在如图中的中(填“甲”或“乙”)滴定管中;第三次滴定时,若滴定开始和结束时,滴定管中的液面如图所示,则。
 (3)、滴定终点的现象为。(4)、草酸晶体的纯度为。(5)、标准溶液滴定样品溶液前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→___→___→排除滴定管中气泡→___→___→开始滴定;。
(3)、滴定终点的现象为。(4)、草酸晶体的纯度为。(5)、标准溶液滴定样品溶液前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→___→___→排除滴定管中气泡→___→___→开始滴定;。a.用标准溶液润洗2至3次 b.记录起始读数
c.调整标准液液面至零刻度或零刻度以下 d.装入标准液至碱式滴定管零刻度以上
e.装入标准液至酸式滴定管零刻度以上 f.用草酸溶液润洗2至3次
(6)、下列操作中可能使所测草酸晶体纯度偏低的是___________(填字母)。A、滴定管未用标准液润洗就直接注入标准液 B、读取标准液时,开始仰视读数,滴定结束时俯视读数 C、滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡 D、滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 -
14、研究之间的转化具有重要意义。(1)、已知: , 将一定量气体充入恒容的密闭容器中,控制反应温度为。
①该反应自发的条件是。
②下列可以作为反应达到平衡的判据是。
A.气体的压强不变 B. C.K不变
D.容器内气体的密度不变 E.容器内颜色不变
③在恒温恒压(压强为p)容器中加入 , 经过t min反应达到平衡,气体的平衡转化率为75%,则该反应的平衡常数(无需带单位,用含p的式子表示)。
已知:对于气相反应,用组分B的平衡压强p(B)代替物质的量浓度c(B)也可以表示平衡常数作 , 如 , p为平衡压强,为平衡系统中B的物质的量分数。
④在温度为、时,平衡体系中的体积分数随压强变化曲线如图所示。

由状态B到状态A,可以选择方法是(填“升高”或“降低”)温度。比较A、C两点气体的颜色,A比C(填“深”、“浅”或“一样”)。
(2)、NO氧化反应:分两步进行,其反应过程能量变化示意图如图。I:
II:

在恒容的密闭容器中充入一定量的NO和气体,保持其它条件不变,控制反应温度分别为和(),测得随t(时间)的变化曲线如下图。转化相同量的NO,在温度(填“”或“”)下消耗的时间较长,试结合反应过程能量图分析其原因。

-
15、工业合成氨是20世纪的伟大成就之一,但化肥的过度使用、硝酸工业废气和动车尾气的排放,给水体和大气带来了一定程度的污染,需要进行综合处理。(1)、工业合成氨反应为: , 下列说法正确的是___________。A、采用高温以提高反应的平衡转化率 B、采用高压以加快反应速率,提高的产量 C、为提高转化率,可适当增大的浓度 D、生产过程中将液化分离,有利于氨的合成(2)、水体中氨氮处理:在微生物作用下,废水中经两步反应被氧化成:
则全部氧化成的热化学方程式是。
(3)、利用反应构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,B电极的电极反应式为。 (4)、肼()是一种二元弱碱,在水中的电离方式与相似。盐酸肼()属于离子化合物,易溶于水,溶液呈酸性,水解原理与类似。
(4)、肼()是一种二元弱碱,在水中的电离方式与相似。盐酸肼()属于离子化合物,易溶于水,溶液呈酸性,水解原理与类似。①盐酸肼第一步水解反应的离子方程式。
②盐酸肼水溶液中离子浓度的排列顺序正确的是(选填编号)
A.
B.
C.
D.
-
16、物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,根据所学知识回答下列问题:(1)、下列方法中,可以使溶液中值增大的措施是(填序号)。
a.加水稀释 b.加入少量固体 c.加少量烧碱溶液
(2)、常温下,将的某酸HA溶液和的NaOH溶液等体积混合后,混合溶液的。由此可知,酸HA是(填“强”或“弱”)酸,该混合溶液中mol/L(填数值)。(3)、25℃下,有浓度均为0.1mol/L的三种溶液;a.;b.NaClO;c.。(已知25℃时电离常数: , , HClO , )①25℃时,相同浓度的、、结合的能力由强到弱的顺序为。
②溶液a的pH大于8,则溶液中(填“”、“”或“”)。
③计算溶液c的。(已知)
-
17、根据下列实验操作,其现象和结论均正确的是
选项
实验操作
现象
结论
A
取两份新制氯水,分别滴加溶液和淀粉KI溶液
前者有白色沉淀,后者溶液变蓝色
氯气与水的反应存在限度
B
向溶液中先滴加4滴0.1mol/L KCl溶液,再滴加4滴0.1mol/L KI溶液
先产生白色沉淀,再产生黄色沉淀
C
将充满的密闭玻璃球浸泡在热水中
玻璃球中红棕色加深
反应的
D
在KSCN与的混合液中再加入KCl固体
溶液红色变浅
增大生成物浓度,平衡逆向移动
A、A B、B C、C D、D -
18、温度为T℃时,向体积不等的恒容密闭容器中均充入1mol气体X,发生反应:X(g) Y(g)+Z(g) ΔH,反应相同时间,测得各容器中X的转化率与容器体积的关系如图所示。下列说法正确的是
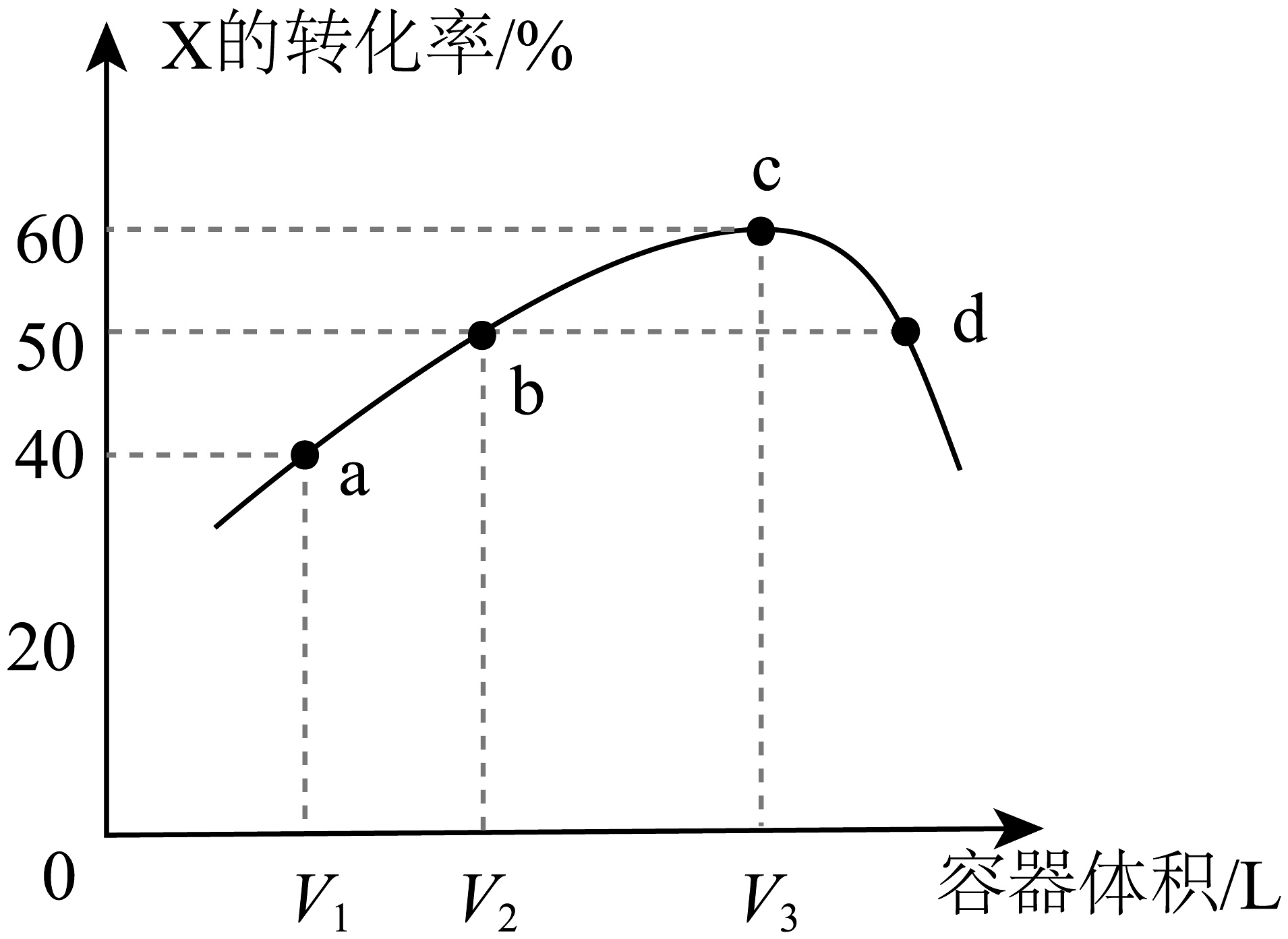 A、a点对应X的平衡转化率大于40% B、b、c两点V2:V3=5:9 C、d点有v正=v逆 D、正反应速率v(b)=v(d)
A、a点对应X的平衡转化率大于40% B、b、c两点V2:V3=5:9 C、d点有v正=v逆 D、正反应速率v(b)=v(d) -
19、常温下,乙二酸()在不同pH环境中的不同形态的粒子分布系数如图所示,下列说法错误的是
 A、该温度下,溶液的pH小于7 B、b点对应溶液的pH约为2.79 C、将等物质的量的和溶于水可得到c点溶液 D、a、b、c三点对应溶液中,水的电离程度最大的为c点
A、该温度下,溶液的pH小于7 B、b点对应溶液的pH约为2.79 C、将等物质的量的和溶于水可得到c点溶液 D、a、b、c三点对应溶液中,水的电离程度最大的为c点 -
20、常温时,某酸HA的 , 醋酸的。下列说法正确的是A、相同温度下,等pH的NaA和溶液中, B、将浓度均为0.10mol/L的NaA和NaOH溶液加热,两种溶液的pH均变大 C、常温时,HA溶液与NaOH溶液混合,测得 , 则此时溶液中 D、常温时,0.10mol/L的HA溶液中加少量NaA固体,水的电离程度变小