相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、一种新型硼氢化钠(NaBH4)燃料电池,其工作原理如图所示,下列说法中错误的是
 A、NaBH4中H为-1价 B、外电路中电子由a极移向b极 C、该电池不适宜在高温环境下工作 D、a极的电极反应式方程式为
A、NaBH4中H为-1价 B、外电路中电子由a极移向b极 C、该电池不适宜在高温环境下工作 D、a极的电极反应式方程式为 -
2、山梨酸钾(RCOOK)是常用的食品防腐剂,其水溶液呈碱性,下列叙述正确的是A、山梨酸和山梨酸钾都是强电解质 B、稀释山梨酸钾溶液时,n(OH-)、c(OH-)都减小 C、山梨酸钾溶液中 D、若山梨酸的电离常数为Ka,则RCOOK稀溶液中
-
3、100℃时,向某恒容密闭容器中加入1.6mol·L-1的Q后会发生如下反应: , 其中M的物质的量浓度随时间的变化如图所示,下列说法错误的是
 A、前60s内,平均反应速率v(Q)=0.01mol·L-1.s-1 B、a、b两时刻生成Q的速率:v(a)<v(b) C、用Q表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0 D、其他条件相同,起始时容器中加入0.8mol·L-1M,反应达平衡时,c(M)=0.6 mol·L-1
A、前60s内,平均反应速率v(Q)=0.01mol·L-1.s-1 B、a、b两时刻生成Q的速率:v(a)<v(b) C、用Q表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0 D、其他条件相同,起始时容器中加入0.8mol·L-1M,反应达平衡时,c(M)=0.6 mol·L-1 -
4、W、X、Y、Z是原子序数递增的短周期主族元素,Z原子的核外电子总数是次外层电子数的4倍,现代石油化工采用银作催化剂,可以一步完成化合物乙的制备,化合物乙常用于一次性医用口罩的消毒,下列说法正确的是
 A、原子半径:Z>Y>X B、X、Y的氢化物的沸点:Y>X C、Y的氧化物对应水化物均为强酸 D、以上四种元素能形成不止1种既能与强酸又能与强碱反应的离子化合物
A、原子半径:Z>Y>X B、X、Y的氢化物的沸点:Y>X C、Y的氧化物对应水化物均为强酸 D、以上四种元素能形成不止1种既能与强酸又能与强碱反应的离子化合物 -
5、下列微粒在所给条件下,一定可以大量共存的是A、透明溶液中:H+、、Na+、Fe2+ B、遇酚酞显红色的溶液中:Cl2、Mg2+、I-、 C、与铝反应能产生大量氢气的溶液中:、K+、Cl-、CH3COO- D、酸性溶液中:Fe2+、Al3+、、
-
6、设NA为阿伏加德罗常数的值。下列说法正确的是A、5.6L甲烷和乙烯的混合气体中含氢原子数为NA B、1L0.2mol·L-1NaHCO3溶液中含Na+数为0.2NA C、常温常压下,16gO2含有4NA个电子 D、反应 , 每生成1molN2 , 转移电子数为6NA
-
7、部分含铁物质及化合价关系如图所示,下列说法错误的是
 A、工业上用热还原法冶炼a B、b是黑色固体,在空气中加强热变为红色 C、c可以通过化合反应生成d D、e可以加快H2O2的分解
A、工业上用热还原法冶炼a B、b是黑色固体,在空气中加强热变为红色 C、c可以通过化合反应生成d D、e可以加快H2O2的分解 -
8、下列反应的离子方程式正确的是A、NaAlO2溶液与NaHCO3溶液混合: B、过量铁粉加入稀硝酸中: C、已知酸性:HClO>HCO3- , NaClO溶液中通入少量CO2: D、Mg(HCO3)2溶液中滴加过量Ca(OH)2:
-
9、下列实验内容和解释都正确的是
编号
实验内容
解释
A
在相同温度下,测得饱和CO2溶液和饱和SO2溶液的pH分别为3.9和0.9
非金属性:S>C
B
往1mL1mol·L-1的AgNO3溶液中加入2mL1mol·L-1NaCl溶液,生成白色沉淀,再加入2mL1mol·L-1NaBr溶液,生成淡黄色沉淀
Ksp(AgCl)>Ksp(AgBr)
C
向乙醇中加入适量浓硫酸制备乙烯,将产生的气体直接通过酸性高锰酸钾溶液,溶液紫红色褪去
乙烯能被酸性高锰酸钾氧化
D
取1mL蔗糖溶液,加入3滴稀H2SO4 , 水浴加热5min,冷却后加入少量新制Cu(OH)2悬浊液,加热,未产生砖红色沉淀
蔗糖水解产物中不含有葡萄糖
A、A B、B C、C D、D -
10、下列有关氯及其化合物的性质与用途具有对应关系的是A、常温下氯气显黄绿色,可用于制盐酸 B、氯气能与NaOH溶液反应,可用于制漂白液 C、次氯酸是弱电解质,可用作漂白剂 D、四氯化碳难溶于水,可用作灭火剂
-
11、伞形酮的医学和生理作用一直受到人们的重视,其可用邻羟基苯甲醛经一系列反应制得,如图所示,下面说法正确的是


 A、香豆素属于芳香烃 B、伞形酮的分子式为C9H8O3 C、伞形酮可以发生加成反应、氧化反应、还原反应和取代反应 D、邻羟基苯甲醛分子所有原子一定共平面
A、香豆素属于芳香烃 B、伞形酮的分子式为C9H8O3 C、伞形酮可以发生加成反应、氧化反应、还原反应和取代反应 D、邻羟基苯甲醛分子所有原子一定共平面 -
12、我国“奋斗者”号载人潜水器下潜深度达10909米,创造了新纪录。其载人舱球壳材料Ti62A是一种新型钛合金。下列说法错误的是A、、、、、互为同位素 B、的中子数为22 C、该钛合金的耐压性能好 D、的L层有8个电子
-
13、中国诗词、成语中还蕴含着丰富的化学知识。下列分析错误的是A、“梨花院落溶溶月,柳絮池塘淡淡风”中“柳絮”的主要成分为糖类 B、“雷雨发庄稼”中涉及自然固氮的化学变化 C、“大漠孤烟直,长河落日圆”体现了胶体的性质 D、“滴水石穿”,“铁杵成针”都只包含着物理变化
-
14、平昌冬奥会“北京8分钟”主创团队用石墨烯制作了保温效果好的智能服饰;用铝合金管材和碳纤维制作了熊猫木偶,向世界展现了新时代的中国形象。下列说法中,错误的是A、石墨烯与石墨相似,有良好的导电导热性 B、铝合金是密度较小的金属材料 C、碳纤维是耐低温的无机非金属材料 D、新型材料种类多、用途广
-
15、的资源化利用具有重要意义。(1)、的吸收和转化可减少排放,原理如图1所示。反应②中化合价发生改变的元素有(填元素符号);每吸收 , 理论上可获得mol。
 (2)、催化加氢是资源化利用的途径之一。
(2)、催化加氢是资源化利用的途径之一。①甲烷水蒸气催化重整是制取高纯氢的方法之一,反应器中主要反应为:
反应器中还存在如下反应:
i.
ii.
iii.
利用 , 可得反应的(用含、b、c的代数式表示);反应物实际投料比采用 , 其实际投料比远大于理论值的原因是。
②一定条件下,由和制备甲醇的过程中含有下列反应:
反应I:
反应Ⅱ:
反应Ⅲ:
恒压下,按照投料,测得各物质以碳元素计的物质的量分数与时间的关系如图2所示,请解释时间段内对应的曲线先增大且在时刻出现最高点的原因:。
 (3)、催化电解转化可实现资源化利用。科学家研发了一种室温下“可呼吸”的二次电池,电池的工作原理如图3所示。将溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为。
(3)、催化电解转化可实现资源化利用。科学家研发了一种室温下“可呼吸”的二次电池,电池的工作原理如图3所示。将溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为。
①放电时,移向电极(填“Na”或“Ni”)。
②充电时,阳极的电极反应式为:。
-
16、实验室以二氧化铈废渣为原料制备 , 实验过程如下:
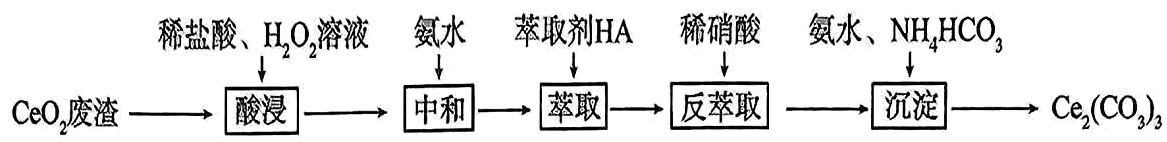 (1)、“酸浸”时与反应生成并放出 , 该反应的化学方程式为。(2)、通过中和、萃取、反萃取、沉淀等过程,可制得。已知能被有机萃取剂(简称)萃取,其萃取原理可表示为:
(1)、“酸浸”时与反应生成并放出 , 该反应的化学方程式为。(2)、通过中和、萃取、反萃取、沉淀等过程,可制得。已知能被有机萃取剂(简称)萃取,其萃取原理可表示为:①加氨水“中和”去除过量盐酸,使溶液。去除过量盐酸的目的是。
②反萃取的目的是将有机层转移到水层。使尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有。
A.适当降低硝酸浓度 B.一定量萃取剂分多次萃取 C.充分振荡
(3)、“沉淀”时,向溶液加入约为8的溶液,反应可生成沉淀,写出该反应的离子方程式。(4)、实验中需要测定溶液中的含量。已知水溶液中可用准确浓度的溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为。请补充完整实验方案:①准确量取溶液约为 , 加氧化剂将完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到容量瓶后定容。
②按规定操作分别将溶液和待测溶液装入如图所示的滴定管中。
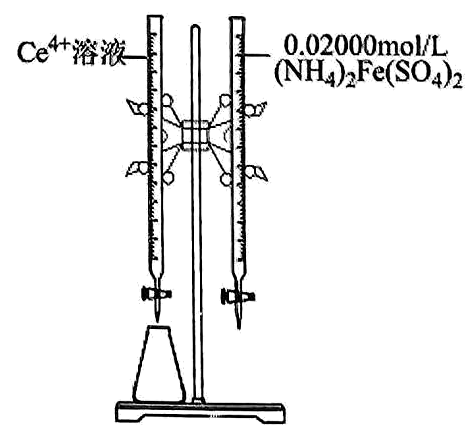
③向锥形瓶中 , 再向其中滴加 , 用滴定,边滴边摇动锥形瓶,直到 , 记录相关数据。
④。
-
17、吸收工厂烟气中的 , 能有效减少对空气的污染。氨水、水悬浊液吸收烟气中后经催化氧化,可得到硫酸盐。
已知:室温下,微溶于水,易溶于水;溶液中的物质的量分数随的分布如图-1所示。
 (1)、氨水吸收。向氨水中通入少量 , 该反应的离子方程式为;当通入至溶液时,溶液中浓度最大的阴离子是(填化学式)。(2)、水悬浊液吸收。向水悬浊液中匀速缓慢通入 , 在开始吸收的内,吸收率、溶液均经历了从几乎不变到迅速降低的变化(见图-2)。溶液几乎不变阶段,主要产物是(填化学式);吸收率迅速降低阶段,主要反应的化学方程式为。
(1)、氨水吸收。向氨水中通入少量 , 该反应的离子方程式为;当通入至溶液时,溶液中浓度最大的阴离子是(填化学式)。(2)、水悬浊液吸收。向水悬浊液中匀速缓慢通入 , 在开始吸收的内,吸收率、溶液均经历了从几乎不变到迅速降低的变化(见图-2)。溶液几乎不变阶段,主要产物是(填化学式);吸收率迅速降低阶段,主要反应的化学方程式为。 (3)、催化氧化。其他条件相同时,调节吸收得到溶液的在范围内,越低生成速率越大,其主要原因是;随着氧化的进行,溶液的将(填“增大”、“减小”或“不变”)。
(3)、催化氧化。其他条件相同时,调节吸收得到溶液的在范围内,越低生成速率越大,其主要原因是;随着氧化的进行,溶液的将(填“增大”、“减小”或“不变”)。 -
18、工业合成的反应为 。(1)、已知:时,部分物质的相对能量如表所示。
物质
相对能量/()
0
, 此条件下的燃烧热的燃烧热(填“>”“<”或“=”)。
(2)、催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是___________(填选项字母)。A、 B、
B、 C、
C、 D、
D、 (3)、恒容密闭容器中充入一定量的和合成 , 下列示意图正确且能说明该反应进行到时刻达到平衡状态的是___________(填选项字母)。A、
(3)、恒容密闭容器中充入一定量的和合成 , 下列示意图正确且能说明该反应进行到时刻达到平衡状态的是___________(填选项字母)。A、 B、
B、 C、
C、 D、
D、 (4)、恒温、恒容的密闭容器中充入和(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(4)、恒温、恒容的密闭容器中充入和(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
①用表示的化学反应速率为(用单位时间内压强变化量表示)。
②反应达到平衡时的转化率为。
③此反应的分压平衡常数为以分压表示的平衡常数,物质的量分数;用含的式子表示)。
-
19、二氧化碳加氢制甲烷过程中的主要反应:
反应Ⅰ
反应Ⅱ
压强为101kPa下,在密闭容器中投入1mol和4mol在催化剂作用下发生反应。平衡时,转化率、产率及另外2种含氢气体的物质的量随温度的变化如题图所示。CO选择性可表示为。下列说法正确的是
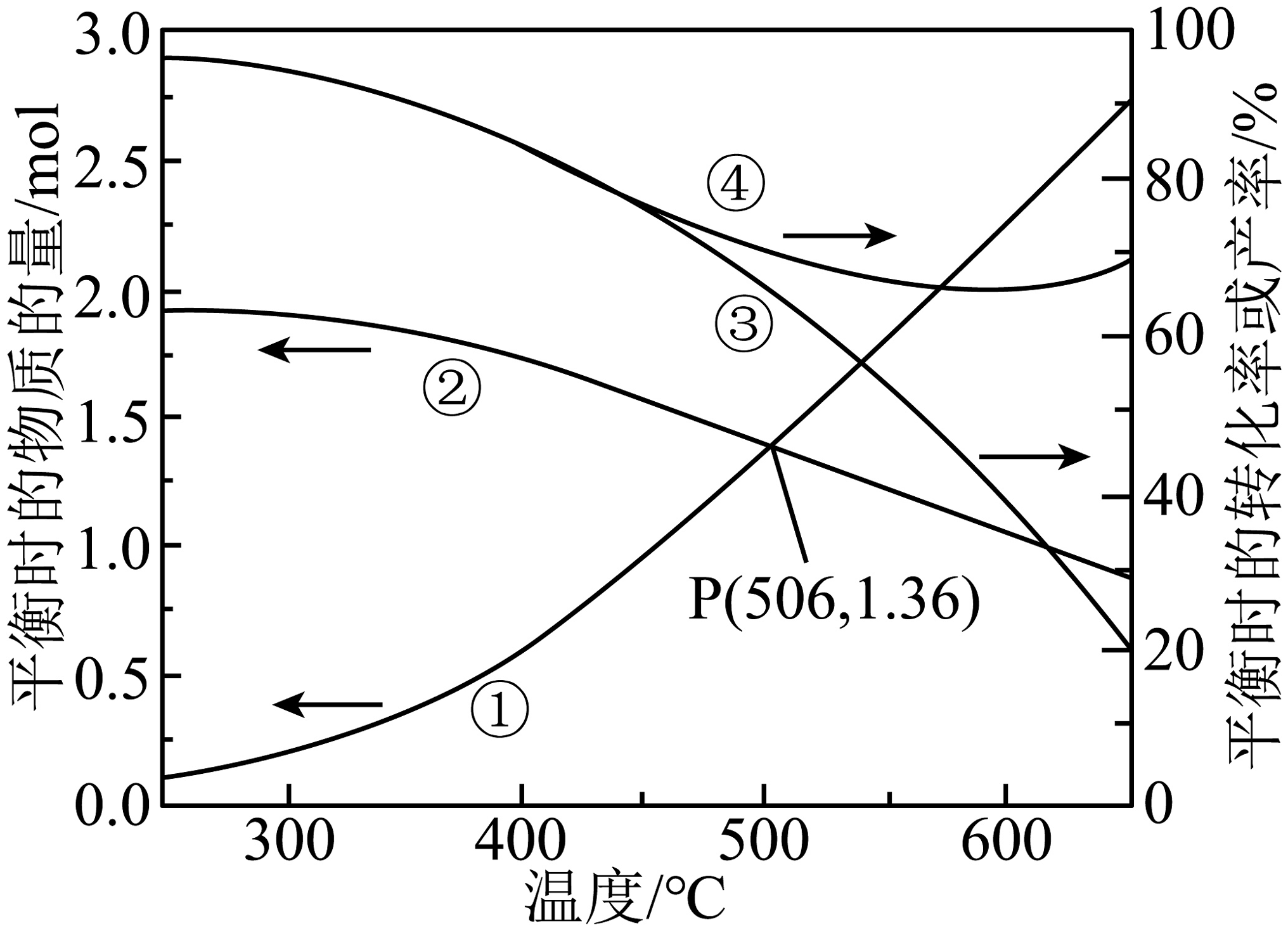 A、图中曲线②、曲线④分别表示平衡时物质的量、转化率随温度的变化 B、反应Ⅰ的、反应Ⅱ的 C、图中P点对应温度下,平衡时CO选择性为11.1% D、450℃之后,温度升高导致催化剂活性降低,从而导致甲烷平衡产率减小
A、图中曲线②、曲线④分别表示平衡时物质的量、转化率随温度的变化 B、反应Ⅰ的、反应Ⅱ的 C、图中P点对应温度下,平衡时CO选择性为11.1% D、450℃之后,温度升高导致催化剂活性降低,从而导致甲烷平衡产率减小 -
20、室温下,通过下列实验探究SO2的性质。
已知。
实验1:将SO2气体通入水中,测得溶液pH=3。
实验2:将SO2气体通入0.1mol∙L-1NaOH溶液中,当溶液pH=3时停止通气。
实验3:将SO2气体通入0.1mol∙L-1酸性KMnO4溶液中,当溶液恰好褪色时停止通气。
下列说法不正确的是
A、实验1所得溶液中: B、实验2所得溶液中: C、实验2所得溶液经蒸干、灼烧会产生Na2SO4固体 D、实验3所得溶液中: