相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、高铁酸钾(K2FeO4)为新型净水剂,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法,制备流程如图所示:

已知:反应②为:Na2FeO4+2KOH=K2FeO4↓+2NaOH
(1)、从2L1mol/LFeCl3溶液中取出200mL稀释至1L,则稀释后的FeCl3溶液的物质的量浓度为。(2)、反应①的产物为Na2FeO4和NaCl,请写出该反应的化学方程式。(3)、质量分数为14.9%,密度为1.25g/cm3NaClO溶液的物质的量浓度为。(4)、反应②的基本反应类型。(填四大基本反应类型)(5)、操作Ⅰ的分离方法为。(6)、将得到的K2FeO4晶体需洗涤,设计实验证明:K2FeO4晶体已洗涤干净:。 -
2、加碘食盐中加入的KIO3是一种白色晶体,常温下很稳定,加热至560℃才开始分解。工业生产碘酸钾的流程如下:

已知①“反应”的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
②淀粉溶液遇I2变蓝色。
(1)、由KClO3固体配制0.050mol·L-1KClO3溶液,下列操作可能使所配KClO3溶液浓度偏小的是(填写字母)。
a.稀释和转移用的烧杯、玻璃棒未洗涤
b.如图所示,定容时俯视容量瓶的刻度线
c.配溶液前容量瓶中有少量蒸馏水
d.加水时超过刻度线,用胶头滴管吸出多余的液体
(2)、某加碘盐用KI代替KIO3 , 请设计检验加碘盐中含有I-的实验方案:。(实验中可供选择的试剂:淀粉溶液、FeCl3溶液,已知:2I-+2Fe3+=I2+2Fe2+)(3)、标准状况下,33.6LCO2的氧原子数目与gKClO3中的氧原子与相同。 -
3、按要求填空。(1)、标准状况下,中有个氯原子。(2)、含的中所含的的物质的量是。(3)、阻燃剂碱式碳酸铝镁中与质量之比为51:300,则这两种离子的物质的量之比为。(4)、质量相同的、、、四种气体中,含有分子数目最少的是。(5)、标准状况下,的体积为。
-
4、下列指定反应的离子方程式或化学方程式正确的是A、向溶液中通入: B、同物质的量浓度同体积溶液与溶液混合: C、常温下澄清石灰水久置后出现白色固体: D、往碳酸氢钠溶液中滴入醋酸:
-
5、酸性条件下,脱除的原理如图所示,下列说法中正确的是
 A、发生反应1时,作为氧化剂 B、发生反应2时,溶液的酸性减弱 C、反应过程中需要随时补充 D、反应中消耗 , 理论上可脱去
A、发生反应1时,作为氧化剂 B、发生反应2时,溶液的酸性减弱 C、反应过程中需要随时补充 D、反应中消耗 , 理论上可脱去 -
6、某电解质溶液中含有Na+、Mg2+、Cl-、SO , 且Na+、Mg2+、Cl-的物质的量浓度分别为0.2mol/L、0.4mol/L、0.4mol/L,则SO的物质的量浓度为( )A、0.1mol/L B、0.2mol/L C、0.3mol/L D、0.4mol/L
-
7、是优良的饮用水消毒剂和絮凝剂,一种制备方法是将、、混合共熔,反应为。下列说法不正确的是A、具有杀菌作用 B、每生成转移 C、该反应条件下,氧化性: D、铁元素被氧化,氮元素被还原
-
8、反应NH4Cl+NaNO2=NaCl+N2↑+2H2O应用于石油开采。下列说法正确的是A、NaCl溶液能导电,NaCl溶液属于电解质 B、NO中N元素的化合价为+5 C、金属钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑ D、Na+的结构示意图:

-
9、在水溶液中,下列电离方程式正确的是A、Ca(OH)2===Ca2++2(OH-) B、FeCl3===Fe2++3Cl- C、H2SO4===H++ D、Fe2(SO4)3===2Fe3++3
-
10、胶体区别于其他分散系的本质特征是A、稳定透明 B、产生丁达尔现象 C、胶体微粒不能穿透半透膜 D、分散质直径在10-7~10-9m之间
-
11、下列物质间转化关系不能一步实现的是A、CaO→Ca(OH)2→CaCl2 B、Cu→CuO→Cu(OH)2 C、CO2→CaCO3→CaCl2 D、H2SO4→H2→H2O
-
12、实验室常用加热的方法制取少量。下列说法正确的是A、该反应属于氧化还原反应 B、属于非电解质 C、属于酸性氧化物 D、制取后剩余的固体物质为纯净物
-
13、下列有关原电池的说法不正确的是
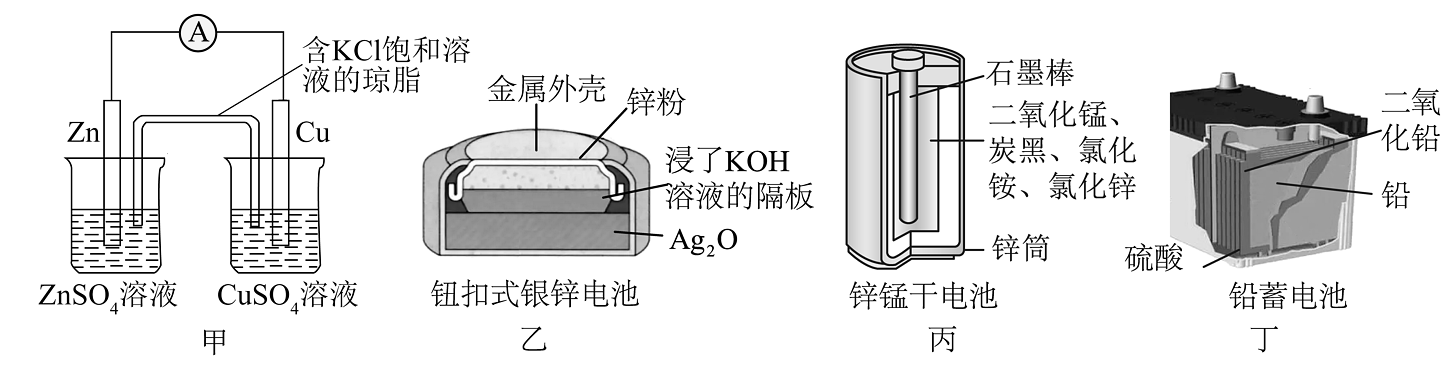 A、图甲所示装置中,盐桥中的向盛有溶液的烧杯中移动 B、图乙所示装置中,正极的电极反应式为 C、图丙所示装置中,使用一段时间后,锌筒会变薄 D、图丁所示装置中,使用一段时间后,电解质溶液的酸性减弱,导电能力下降
A、图甲所示装置中,盐桥中的向盛有溶液的烧杯中移动 B、图乙所示装置中,正极的电极反应式为 C、图丙所示装置中,使用一段时间后,锌筒会变薄 D、图丁所示装置中,使用一段时间后,电解质溶液的酸性减弱,导电能力下降 -
14、
氧化还原反应在工农业生产、日常生活中具有广泛用途。
(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中不易吸收的Fe3+转变为易吸收的Fe2+ , 故维生素C具有性(填“氧化”或“还原”,下同),在反应过程中维生素C发生反应。
某小组同学学习了氧化还原反应的知识后,欲探究H2O2的性质。
[预测]
(2)聚焦H2O2中的核心元素O,O元素的化合价为 , 预测H2O2既具有氧化性,也具有还原性,理由是。
[实验和观察]

(3)(a)实验①中,观察到KMnO4溶液与H2O2发生了反应,紫红色褪去同时有无色气体产生,经分析知紫红色MnO转变为无色Mn2+ , 该实验证明H2O2具有(填“氧化”或“还原”)性。
(b)实验②,在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,是为了验证H2O2的(“氧化”或“还原”)性(已知:淀粉溶液遇I2会变蓝)。
(4)实验室常用MnO2催化H2O2分解制备氧气,写出其化学方程式,并用双线桥标明电子转移:。
[结论]以上实验可得出的结论是:H2O2既具有氧化性,也具有还原性。
(5)该实验也能说明H2O2、KMnO4和I2三者的氧化性由强到弱的顺序为 。
-
15、有一瓶透明澄清的溶液,其中可能含有Na+、H+、NO、Mg2+、CO , 取该溶液进行以下实验:
①取pH试纸检验,测得溶液呈强酸性。
②另取部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,有白色沉淀产生。
请回答下列问题:
(1)、用pH试纸检验,表明溶液呈强酸性,可以排除的存在。(2)、步骤②中产生白色沉淀的离子方程式为。(3)、该溶液中可能存在的离子为。(4)、根据上述实验事实能确定溶液中肯定存在的离子是。 -
16、按要求写出与下列过程或反应相对应的一个化学表达式。(1)、的化学方程式:;(2)、醋酸溶解于水的电离方程式:;(3)、配平以下反应方程式并用单线桥标出电子转移的方向和数目:。
-
(4)、化工生产中常用到“三酸(硝酸、硫酸和盐酸),两碱(烧碱和纯碱)”。①从物质的分类角度看,不恰当的一种物质是。
②上述物质中,可以确定既不是电解质也不是非电解质的是 , 依据是。
-
17、现有下列物质:①KCl晶体 ②液态HCl ③ ④汞 ⑤CaCO3固体 ⑥稀硫酸 ⑦酒精C2H5OH ⑧熔融的NaCl ⑨浓氨水
其中属于混合物的是(填序号,下同);属于电解质的是;属于非电解质的是;能导电的有。
-
18、对于离子反应,下列说法正确的是( )A、参加离子反应的一定都是电解质 B、任何一种离子的浓度在离子反应中一定变小 C、自由离子之间的反应不能在固态中进行 D、没有沉淀、气体、水生成的反应就不是离子反应
-
19、物质M在水中发生电离:M=X2++2Y- , 则下列判断正确的是A、M可能是酸 B、X2+一定是金属离子 C、Y-是OH- D、M一定属于盐
-
20、下列分散系中最不稳定的是A、向NaOH溶液中通入CO2得到的无色溶液 B、向CuSO4溶液中加入NaOH溶液得到的分散系 C、向沸水中逐滴滴入FeCl3饱和溶液得到的红褐色液体 D、向Fe(OH)3固体中加入盐酸得到的棕黄色液体