相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、侯德榜是我国近代化学工业的奠基人之一,他将氨碱法和合成氨工艺联合起来,发明了“联合制碱法”。氨碱法中涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
下列制取少量相关的实验原理和装置能达到实验目的的是
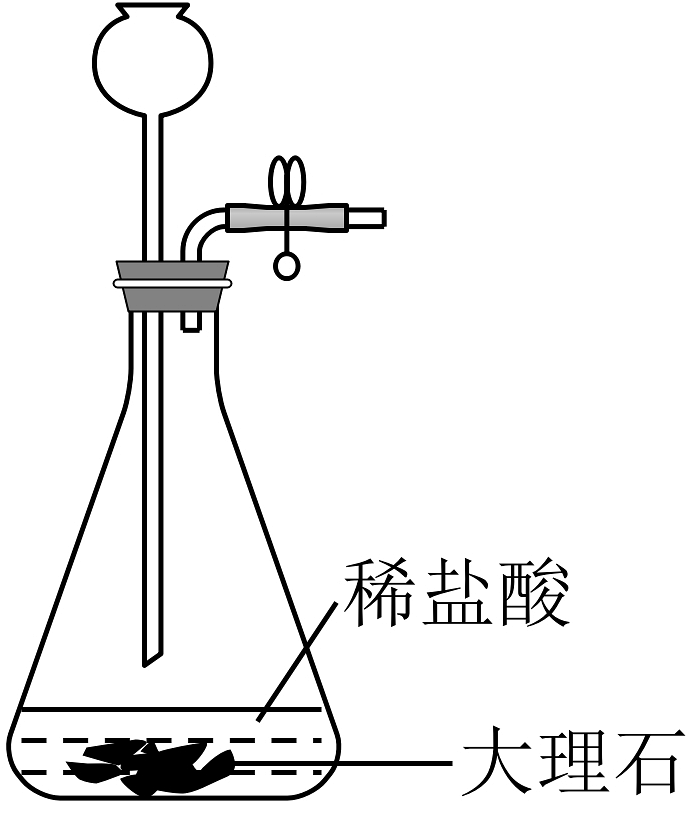
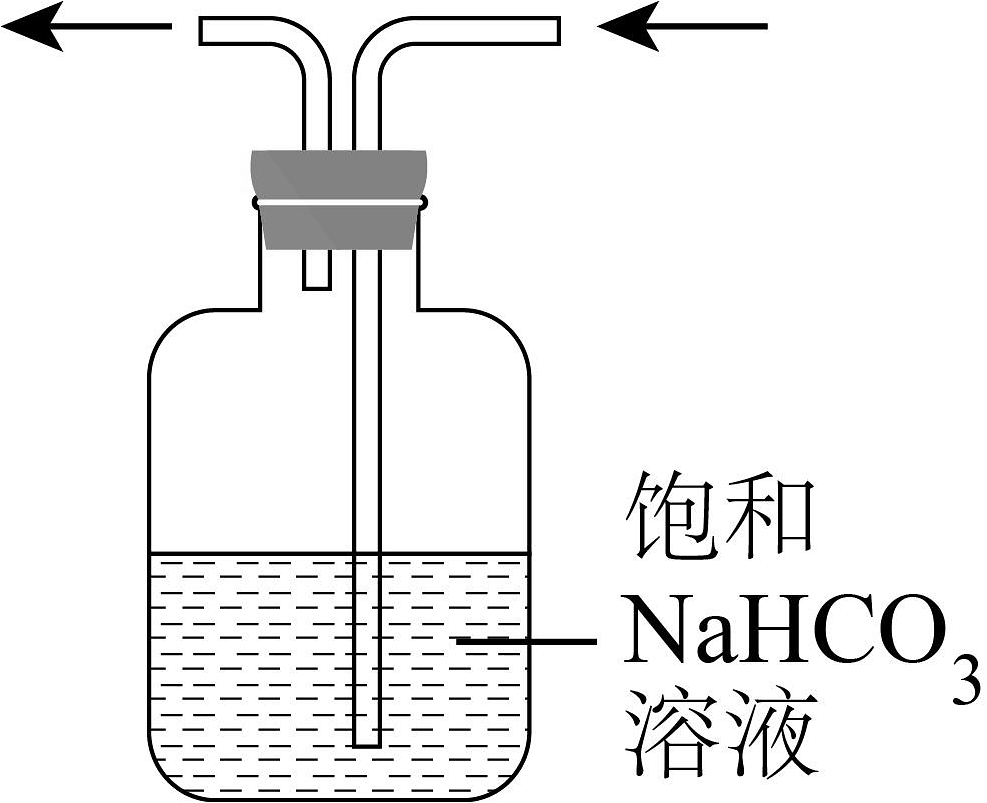
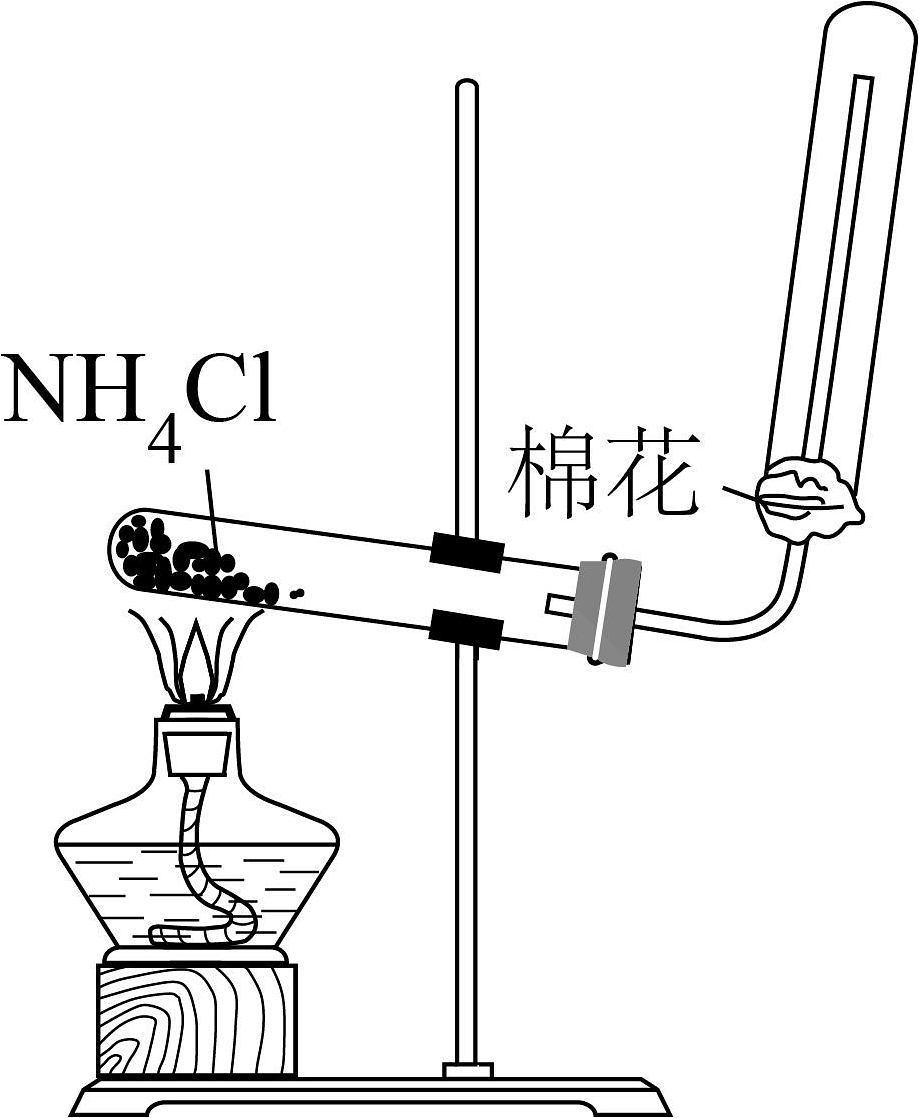
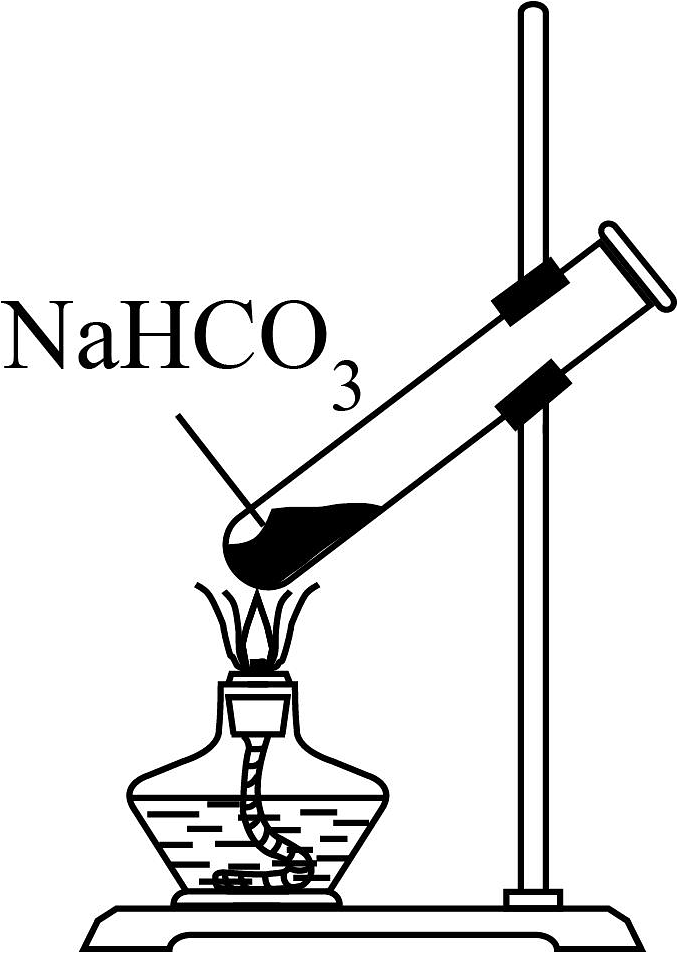
A.制取
B.除去中HCl
C.制取并收集氨气
D.制取
A、A B、B C、C D、D -
2、草酸易被NaClO氧化: , 下列说法不正确的是A、CO2分子中有极性共价键 B、NaClO属于离子化合物 C、H2O的电子式为
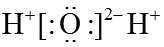 D、Cl的结构示意图为
D、Cl的结构示意图为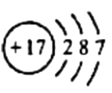
-
3、水中的溶解氧是水生生物生存不可缺少的条件。某课外小组设计如图所示的实验装置(夹持装置略),采用碘量法测定学校周边河水中的溶解氧的含量。

实验步骤及测定原理如下:
I.取样、氧的固定
a.用溶解氧瓶采集水样,记录大气压及水体温度。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成 , 实现氧的固定。
II.酸化、滴定
d.搅拌,并向烧瓶中加入2mL硫酸无氧溶液至被还原为 , 溶液为中性或弱酸性。
e.在暗处静置5min后,取一定量溶液,用标准溶液滴定生成的 , 记录数据。
f.重复e中滴定操作2~3次。
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)、配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为。(2)、取水样时应尽量避免扰动水体表面,这样操作的主要目的是。(3)、“氧的固定”中发生主要反应的化学方程式为。(4)、“步骤e”中,用a标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为;若200mL水样经处理后,共消耗标准溶液的体积为b mL,则水样中溶解氧的含量为(用含字母的式子表示)。 -
4、实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
 (1)、为提高溶解速率,还可以采取的措施有(写一种)。(2)、加入H2O2的目的是。(3)、加入锌粉发生主要反应的离子方程式为。
(1)、为提高溶解速率,还可以采取的措施有(写一种)。(2)、加入H2O2的目的是。(3)、加入锌粉发生主要反应的离子方程式为。 -
5、侯氏制碱法的基本过程如下图所示。下列说法错误的是
 A、食盐水精制时一般加入BaCl2后,再加入Na2CO3 B、为提高原料利用率,先通入CO2再通入NH3 C、若沉淀结块,煅烧前需将沉淀研磨成粉末状 D、生产中将X和母液循环利用,可以提高原料利用率和产率
A、食盐水精制时一般加入BaCl2后,再加入Na2CO3 B、为提高原料利用率,先通入CO2再通入NH3 C、若沉淀结块,煅烧前需将沉淀研磨成粉末状 D、生产中将X和母液循环利用,可以提高原料利用率和产率 -
6、下列关于的说法中不正确的是A、有刺激性气味,有毒 B、既有氧化性又有还原性 C、能使酸性高锰酸钾溶液褪色,体现漂白性 D、可按照食品添加剂使用标准用作食品的添加剂
-
7、请阅读下列材料,2019年是门捷列夫发现周期律150周年,联合国大会指定这一年为“化学元素周期表国际年”,在纪念门捷列夫先生的同时,以表彰其元素周期表对人类进步的推动作用。回答下列问题。(1)、可用核素测定文物的年代,该核素的中子数为A、6 B、14 C、8 D、20(2)、Mg和Si都属于元素周期表第三周期元素,它们原子结构中相同的是A、质子数 B、核外电子数 C、电子层数 D、最外层电子数(3)、判断Na的金属性比Mg的强,可依据的事实是A、钠与水反应比镁反应更剧烈 B、钠的密度小于镁的密度 C、相同物质的量钠失电子比镁少 D、Mg(OH)2的碱性比NaOH的碱性强(4)、氟是第二周期ⅦA族元素,下列有关氟元素性质推测正确的是A、最高化合价为+7 B、原子半径比氯的大 C、单质与氢气的反应比氯气更剧烈 D、HCl的稳定性比HF强
-
8、如图为某原电池装置,下列关于该装置的说法正确的是
 A、碳棒是正极 B、该装置能将电能转化为化学能 C、外电路中电子由碳棒流向铁片 D、该装置的总反应为2Fe+3Cu2+=2Fe3++3Cu
A、碳棒是正极 B、该装置能将电能转化为化学能 C、外电路中电子由碳棒流向铁片 D、该装置的总反应为2Fe+3Cu2+=2Fe3++3Cu -
9、下列反应条件的改变对3CO+Fe2O33CO2+2Fe反应速率的影响正确的是A、增加Fe2O3的物质的量能加快反应速率 B、减小CO2的浓度能加快反应速率 C、升高温度能加快反应速率 D、添加催化剂对反应速率无影响
-
10、下列反应过程中的能量变化情况符合下图的是
 A、NaOH与H2SO4发生中和反应 B、氧化钙和水反应 C、红热的炭和水蒸气反应 D、一氧化碳气体的燃烧
A、NaOH与H2SO4发生中和反应 B、氧化钙和水反应 C、红热的炭和水蒸气反应 D、一氧化碳气体的燃烧 -
11、下列属于取代反应的是A、C2H4+3O22CO2+2H2O B、CH2=CH2+HBr→ CH3CH2Br C、CH4+Cl2CH3Cl+HCl D、2CH3CH2OH+O22CH3CHO+2H2O
-
12、下列说法正确的是A、甲烷与乙烯互为同系物 B、32S与33S是同种核素 C、正丁烷与异丁烷互为同素异形体 D、乙醇和二甲醚(CH3-O-CH3)互为同分异构体
-
13、下列反应的离子方程式书写正确的是A、BaCl2溶液和Na2SO4溶液反应:Ba2+ +SO42- = BaSO4↓ B、Na与水反应:Na + H2O = Na+ + OH- + H2↑ C、CaCO3与盐酸反应:CO32- + 2H+ = H2O + CO2↑ D、Al与稀硫酸反应:Al + 2H+ = Al3++ H2↑
-
14、下列装置能达到实验目的的是




A.收集氨气
B.测氯水的pH
C.除Cl2中的HCl
D.蒸发NaCl溶液
A、A B、B C、C D、D -
15、在含有大量H+、Fe3+、的溶液中,还可能大量共存的离子是A、 B、Ba2+ C、 D、Ca2+
-
16、下列实验方案能达到目的的是A、加热蒸干FeCl3溶液制FeCl3晶体 B、用焰色试验鉴别KNO3和KCl C、用澄清石灰水鉴别MgCl2溶液和NaHCO3溶液 D、用品红溶液检验SO2
-
17、下列属于纯净物的是A、矿泉水 B、稀硫酸 C、冰水混合物 D、洁净的空气
-
18、有关Si(粗硅)+2Cl2SiCl4 , 下列说法正确的是A、Si是氧化剂 B、Cl2还原剂 C、Si失去电子 D、Cl2发生氧化反应
-
19、下列化学用语正确的是A、氟化氢的电子式:
 B、氯原子的结构示意图:
B、氯原子的结构示意图: C、乙烯的结构简式:CH2CH2
D、氯化钠的电离方程式:NaCl=Na++Cl−
C、乙烯的结构简式:CH2CH2
D、氯化钠的电离方程式:NaCl=Na++Cl−
-
20、下列物质含有离子键的是A、HF B、H2S C、N2O D、NH4Cl