相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、下列行为符合实验安全要求的是A、实验剩余的钠不可放回原试剂瓶,应投入废液缸 B、新制氯水应保存在棕色广口试剂瓶中 C、应戴护目镜观察氢气在氯气中燃烧 D、浓NaOH溶液不慎沾到皮肤上,应立即用大量水冲洗,然后涂上小苏打溶液
-
2、下列分散系不能产生“丁达尔效应”的是A、有色玻璃 B、胶体 C、云 D、漂白液
-
3、下列物质属于非电解质的是A、盐酸 B、NaClO C、CO D、
-
4、下列仪器能直接加热的是A、
 B、
B、 C、
C、 D、
D、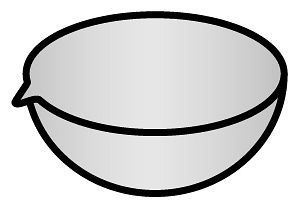
-
5、下列物质属于碱性氧化物的是A、KOH B、MgO C、 D、
-
6、下列实验装置能达到实验目的的是
 A、实验室制备乙烯 B、乙酸乙酯的制备和收集 C、制取硝基苯 D、除去乙烷中的乙烯
A、实验室制备乙烯 B、乙酸乙酯的制备和收集 C、制取硝基苯 D、除去乙烷中的乙烯 -
7、绿矾()是生产缺铁性贫血药品的重要原料,在常温下易溶于水,能溶于甘油,不溶于乙醇。现利用某废旧金属材料(主要含Fe、Cu、Al及其氧化物)制备绿矾,并回收部分金属。流程如下:

已知:在酸性条件下易被还原为。请完成下列问题。
(1)、碱浸时发生化学反应的物质是(填化学式)。(2)、酸浸1和酸浸2用到的酸是;向酸浸1后所得溶液中加入过量试剂a是。(3)、酸浸2涉及的离子方程式为。(4)、系列操作中,洗涤晶体时,采用乙醇而不用水的原因是。(5)、绿矾易变质,检验绿矾未被完全氧化的最佳试剂是_______。A、KSCN溶液 B、酸性高锰酸钾溶液 C、NaOH溶液 D、铜粉(6)、测定所得绿矾样品中的含量,步骤如下:Ⅰ:称取mg绿矾样品,将其配制成100mL溶液。Ⅱ:取20.00mL步骤Ⅰ配制的溶液,加入适量稀硫酸,滴入cmol/L的溶液至反应完全,共消耗溶液VmL。①Ⅱ中与反应的离子方程式为。
②计算绿矾样品中的质量分数是(用含m、c、V的代数式表示)。
-
8、某同学用高锰酸钾和浓盐酸制备氯气,并验证卤素单质间氧化性强弱。实验装置如图所示(夹持装置已省略)。

回答下列问题:
(1)、进行该实验前需进行的操作是。(2)、A装置中橡皮管的作用是。(3)、装置C中发生反应的离子方程式为。(4)、打开a,关闭b,装置C中的实验现象是 , 可证明氧化性:。一段时间后,装置C中溶液颜色不变,打开b,关闭a,装置E中溶液由无色逐渐变为蓝色,该同学由此得出结论,氧化性:。你是否认同该同学的结论,若不认同,给出理由是。(5)、装置D中主要发生的化学反应方程式为。(6)、尾气处理可用于制取氯水,氯水通常保存在棕色试剂瓶中,因为光照条件下容易变质。用传感器分析氯水在光照过程中微粒成分的变化,得到以下图像,其中不合理的是。

-
9、
已知是重要的无机化合物,在工业上有着广泛的用途。某研究性学习小组对进行如下实验:
Ⅰ.配制240mL0.1000mol/L溶液
(1)完成该实验所需要的玻璃仪器除了烧杯、玻璃棒、量筒、胶头滴管外,还需要。(2)计算需要固体的质量是g(保留小数点后4位)。(3)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,会使配制的溶液浓度(填“偏大”、“偏小”或“无影响”)。Ⅱ.探究与的还原性强弱:取10.00mL上述溶液于试管中,向其中通入少量氯气,发现溶液呈黄色。同学们对产生黄色的原因提出假设:假设1:被氧化;假设2:被氧化。
(4)设计方案,验证假设实验步骤
实验现象
实验结论
取少量黄色溶液于试管中,滴加几滴
假设1正确
取少量黄色溶液于试管中,滴加几滴
无明显现象
假设2不正确
(5)通过上述实验结论可知,该条件下还原性:(填“强于”或“弱于”)。 -
10、元素周期表的建立成为化学发展史上的重要里程碑之一,下表是元素周期表的一部分,数字①~⑧代表八种短周期元素,请回答下列问题:
 (1)、①~⑧中金属性最强的元素是 , 化学性质最不活泼的元素是(填元素符号)。(2)、②在周期表中的位置是。(3)、写出③的最简单气态氢化物的电子式为。(4)、③、④、⑥按原子半径由大到小的顺序排列是(填化学式)。(5)、写出⑤和⑦的最高价氧化物对应的水化物之间反应的离子方程式为。(6)、欲比较③和⑧的非金属性强弱,下列说法可作为判断依据的是(填标号)。
(1)、①~⑧中金属性最强的元素是 , 化学性质最不活泼的元素是(填元素符号)。(2)、②在周期表中的位置是。(3)、写出③的最简单气态氢化物的电子式为。(4)、③、④、⑥按原子半径由大到小的顺序排列是(填化学式)。(5)、写出⑤和⑦的最高价氧化物对应的水化物之间反应的离子方程式为。(6)、欲比较③和⑧的非金属性强弱,下列说法可作为判断依据的是(填标号)。a.两种元素单质的沸点高低 b.两种元素单质与化合的难易程度
c.两种元素气态氢化物的稳定性 d.两种元素的氧化物对应水化物的酸性强弱
-
11、将和空气的混合气体通入含、和的废水中回收S,其转化如图所示(CuS不溶于水)。下列说法正确的是
 A、整个转化过程中是催化剂 B、过程①发生了氧化还原反应 C、过程②中发生反应的离子方程式为 D、若过程中不变,当有32g硫生成时,消耗
A、整个转化过程中是催化剂 B、过程①发生了氧化还原反应 C、过程②中发生反应的离子方程式为 D、若过程中不变,当有32g硫生成时,消耗 -
12、类推的思维方式在化学学习与研究中经常采用,以下类推的结论正确的是A、由可推出 B、由可推出 C、由可推出 D、由可推出
-
13、在给定条件下,下列物质间的转化均能一步实现的是A、 B、 C、 D、
-
14、应用元素周期律分析下列推断,正确的组合是
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是第ⅦA族元素,其氢化物的稳定性强于HCl
③第3周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
④磷与砷(As)位于同主族,砷元素的最高价氧化物对应的水化物的酸性强于磷酸
A、①③ B、①④ C、②③ D、②④ -
15、如图为氯元素的“价类二维图”,下列说法正确的是
 A、甲的水溶液能导电,因此甲属于电解质 B、乙既有氧化性又有还原性 C、丁与NaOH溶液反应的离子方程式为 D、戊→己必须加还原剂才能实现
A、甲的水溶液能导电,因此甲属于电解质 B、乙既有氧化性又有还原性 C、丁与NaOH溶液反应的离子方程式为 D、戊→己必须加还原剂才能实现 -
16、W、X、Y、Z为原子序数依次增大的四种短周期主族元素,W的单质是理想的清洁能源,X、Y位于同一周期,X的最外层电子数是其内层电子数的三倍,Z元素的焰色为黄色。下列说法正确的是A、W和Z形成的化合物中W的化合价为+1价 B、与的化学键类型完全相同 C、最简单氢化物的稳定性:X>Y D、离子半径:Y>Z
-
17、用下列仪器或装置进行相应实验,能达到实验目的的是
 A、图甲可除去氯气中的氯化氢 B、图乙可制取纯净的二氧化碳气体 C、图丙可配制一定物质的量浓度的硫酸溶液 D、图丁可较长时间观察到白色沉淀
A、图甲可除去氯气中的氯化氢 B、图乙可制取纯净的二氧化碳气体 C、图丙可配制一定物质的量浓度的硫酸溶液 D、图丁可较长时间观察到白色沉淀 -
18、高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠的一种方法的化学原理为。下列说法正确的是A、氧化产物和还原产物的物质的量之比为3:2 B、处理饮用水的原理为胶体 C、每生成4mol转移电子数目为 D、该条件下,氧化性强于
-
19、用表示阿伏加德罗常数的值,下列说法正确的是A、常温常压下,22.4L中所含有的原子数目为 B、1mol中所含有的离子数目为 C、标准状况下,3.4g所含有的质子数目为 D、足量Fe与1mol反应,转移电子数目为
-
20、为提纯下列物质,“[ ]”中为杂质,所选除杂试剂正确的是
选项
被提纯的物质[杂质]
除杂试剂
A
饱和溶液
B
Zn
C
无水
D
NaOH溶液
A、A B、B C、C D、D