-
1、下列物质中属于新型无机非金属材料的是( )A、碳化硅 B、陶瓷 C、铝合金 D、普通玻璃
-
2、氨溴索(G)是β-内酰胺类的抗生素,可以治疗多种细菌感染。一种合成路线如下:
 (1)、A~C三种物质中(填“有”、“无”)易溶于水的物质。D中氮原子杂化类型为。(2)、
(1)、A~C三种物质中(填“有”、“无”)易溶于水的物质。D中氮原子杂化类型为。(2)、 中的官能团名称是 , 所涉及到的非金属元素第一电离能由大到小顺序为。 (3)、反应③的化学方程式是。(4)、反应⑤的反应类型是。(5)、B的芳香族同分异构体中,满足下列条件的有种;其中核磁共振氢谱有4组吸收峰且峰面积之比为2∶2∶2∶1的结构简式为。
中的官能团名称是 , 所涉及到的非金属元素第一电离能由大到小顺序为。 (3)、反应③的化学方程式是。(4)、反应⑤的反应类型是。(5)、B的芳香族同分异构体中,满足下列条件的有种;其中核磁共振氢谱有4组吸收峰且峰面积之比为2∶2∶2∶1的结构简式为。①能发生银镜反应;②能水解;③1 mol最多能与2 mol NaOH反应;
(6)、写出以 为原料制备
为原料制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。 -
3、SO2、CO、NO、NO2及其他氮氧化物都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。(1)、上述四种气体中直接排入空气时会引起酸雨的有(填化学式)。(2)、回收大气污染物SO2的方法如下:
方法一:在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。已知:
CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(1) △H=-295.9kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297.2kJ·mol-1
则CH4的燃烧热的热化学方程式为:。
方法二:在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中部分物质的物质的量浓度随时间的变化关系如图2所示:

①由分析可知X为(填化学式)。
②0~t1时间段H2的化学反应速率。
方法三:利用反应:NO2(g)+SO2(g)SO3(g)+NO(g)。
③一定条件下,将NO2与SO2以体积比1∶1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g)SO3(g)+NO(g),能说明反应达到平衡状态的是(填字母)。
a. 混合气体的密度保持不变 b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变 d.每生成1molSO3的同时消耗1molNO
e.容器内的混合气体平均相对分子质量保持不变
④已知该反应的平衡常数为 , 向某恒温恒容密闭容器中通入NO2、SO2、SO3、NO各1mol,此时v(正)v(逆)(填“>”、“<”或“=”)。
(3)、在发动机的高温下,空气中的N2和CO2可能发生:N2(g)+CO2(g)C(s)+2NO(g)。现向2L体积恒定的密闭容器中充入一定量N2和CO2来模拟此过程,其中N2、NO物质的量随时间变化的曲线如图所示。①图中A点v正v逆(填“>”“<”或“=”)。

②第10min时,外界改变的条件可能是(填字母)。
A. 加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
-
4、绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
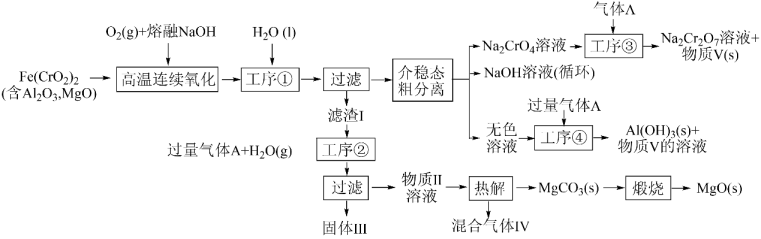
回答下列问题:
(1)、高温连续氧化工序中被氧化的元素是(填元素符号),Cr元素在元素周期表中的位置 ,(2)、滤渣I的主要成分是(填化学式)。(3)、工序③中发生反应的离子方程式为。(4)、物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为。钠在火焰上灼烧产生的黄光是一种(填“吸收光谱” 或“发射光谱”)。(5)、工序④溶液中的铝元素恰好完全转化为沉淀的pH为。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;Al(OH)3+OH-⇌Al(OH):K=100.63 , Kw=10-14 , Ksp[Al(OH)3]=10-33)(6)、基态Al原子的核外电子排布式为。Fe的晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,若晶胞参数为a nm,则Fe晶胞的密度为g•cm-3(用含NA和a的代数式表示)。
-
5、(1)、Ⅰ.氨气是一种重要的工业原料。
氨气的制备
①氨气的发生装置可以选择上图中的 , 反应的化学方程式为。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示)。
③新制的氨水中含氮元素的微粒有3种:、和 , 试用合理的方程式解释:。
(2)、设计实验,探究对稀氨水中存在的溶质的电离平衡的影响。已知:影响电离平衡的因素有浓度、温度等。
①限制试剂与仪器:0.1mol/L氨水、、、、、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量,数据用字母表示)。
物理量
实验序号V(0.1mol/L氨水)/mL m(铵盐)/g t/℃ 1 100 0 25 b 2 100 a 25 c ③表中物理量“m(铵盐)/g”的铵盐是(填字母)。
A. B. C. D.
(已知25℃几种弱电解质的电离常数分别为: 、醋酸、碳酸和)
④按实验序号2所拟数据进行实验,则一水合氨的电离度(平衡转化率)为。(可忽略水的电离)
-
6、中国科学院研究团队在碱性锌铁液流二次电池电池研究方面取得新进展。下列叙述不正确的是( )
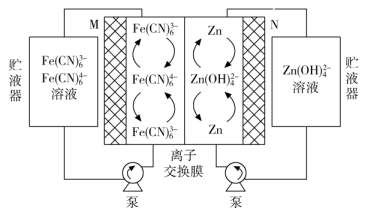 A、充电时,电极M与电源正极相连 B、充电时,阳极的电极反应式为Fe(CN)64--e-=Fe(CN)63- C、放电时,电极N发生氧化反应 D、放电时,电路中转移2 mol电子时,负极区电解质溶液增重65g
A、充电时,电极M与电源正极相连 B、充电时,阳极的电极反应式为Fe(CN)64--e-=Fe(CN)63- C、放电时,电极N发生氧化反应 D、放电时,电路中转移2 mol电子时,负极区电解质溶液增重65g -
7、部分含氮、硫元素的化合物的价-类二维图如图所示。下列关于各物质的说法正确的是。( )
 A、i在一定条件下均可以与a、b、c发生反应 B、e的浓溶液可用于干燥c、f、g C、实验室中产生的g可用NaOH溶液吸收 D、b在纯氧气中点燃可生成d
A、i在一定条件下均可以与a、b、c发生反应 B、e的浓溶液可用于干燥c、f、g C、实验室中产生的g可用NaOH溶液吸收 D、b在纯氧气中点燃可生成d -
8、物质X能发生如下反应:①X→mY;②X→nZ(m、n均为正整数)。恒容体系中X、Y、Z的浓度c随时间t的变化曲线如图所示,下列说法不正确的是( )
 A、m=n=1 B、t1时,c(X)=c(Y) C、反应的活化能:①<② D、t2时,X的消耗速率等于Z的生成速率
A、m=n=1 B、t1时,c(X)=c(Y) C、反应的活化能:①<② D、t2时,X的消耗速率等于Z的生成速率 -
9、对浓盐酸与高锰酸钾反应产生的气体进行如下图所示的探究实验,下列分析正确的是( )
 A、a处酚酞褪色,说明了氯气有漂白性 B、b处湿润的红布条褪色,说明氯气有漂白性 C、c湿润的蓝色石蕊试纸先变红后褪色,说明氯气与水生成了酸性物质和漂白性物质 D、d处溶液变成橙黄色、e处试纸变成蓝色,说明氧化性:
A、a处酚酞褪色,说明了氯气有漂白性 B、b处湿润的红布条褪色,说明氯气有漂白性 C、c湿润的蓝色石蕊试纸先变红后褪色,说明氯气与水生成了酸性物质和漂白性物质 D、d处溶液变成橙黄色、e处试纸变成蓝色,说明氧化性: -
10、甲到丁均为短周期元素,在元素周期表中的相对位置如图所示。丙的单质是空气中主要组成成分之一。下列说法不正确的是( )
 A、原子半径:甲>乙 B、丁的氢化物水溶液可能用于雕刻玻璃 C、丙的简单液态氢化物之间一定存在氢键 D、甲的最高价氧化物一定可以与水反应生成对应的酸
A、原子半径:甲>乙 B、丁的氢化物水溶液可能用于雕刻玻璃 C、丙的简单液态氢化物之间一定存在氢键 D、甲的最高价氧化物一定可以与水反应生成对应的酸 -
11、下列实验中,所采取的分离方法或对应原理不正确的是( )
选项
目的
分离方法
原理
A
除去淀粉胶体中的NaCl
过滤
淀粉胶体不能透过滤纸,NaCl则可以透过
B
除去中的HCl
洗气
在饱和食盐水中的溶解度很小而HCl易溶
C
除去粗苯甲酸晶体中的沙子
重结晶
苯甲酸的溶解度受温度影响较大,沙子在水中溶解度小
D
分离食用油和汽油
蒸馏
食用油和汽油的沸点不同
A、A B、B C、C D、D -
12、下列有关物质结构与性质的说法正确的是( )
 A、基态碳原子价电子排布图:
A、基态碳原子价电子排布图: B、CO32-的空间结构:平面三角形
C、C60和高温高压下可转变为结构类似金刚石的碳玻璃,该碳玻璃中碳原子为杂化
D、硫单质和氢气低温高压下可形成一种新型超导材料,其晶胞如右上图,该晶体属分子晶体
B、CO32-的空间结构:平面三角形
C、C60和高温高压下可转变为结构类似金刚石的碳玻璃,该碳玻璃中碳原子为杂化
D、硫单质和氢气低温高压下可形成一种新型超导材料,其晶胞如右上图,该晶体属分子晶体
-
13、把锌片和铁片放在盛有稀食盐水和K3[Fe(CN)6]试液混合溶液的培养皿中,经过一段时间后,下列说法中正确的是(提示:Fe2+遇K3[Fe(CN)6]产生蓝色沉淀)( )
 A、Ⅰ附近产生黄绿色气体 B、Ⅱ附近铁受保护而几乎不被腐蚀 C、Ⅲ附近开始时无明显现象 D、Ⅳ附近很快出现蓝色沉淀
A、Ⅰ附近产生黄绿色气体 B、Ⅱ附近铁受保护而几乎不被腐蚀 C、Ⅲ附近开始时无明显现象 D、Ⅳ附近很快出现蓝色沉淀 -
14、宏观辨识与微观探析是化学学科核心素养之一。下列性质实验对应的离子方程式书写正确的是( )A、往饱和NaCl溶液中先通氨气,再通入过量的CO2:NH3+ CO2 + H2O = HCO3- + NH4+ B、往NaClO溶液中通入过量SO2:SO2 + ClO- + H2O = SO42- + 2H+ +Cl- C、把足量醋酸加入Na2CO3溶液中:CO32- + 2H+ = CO2↑ + H2O D、过量铁粉加入稀硝酸中:
-
15、下列实验装置不能达到实验目的的是( )
 A、图Ⅰ:由海水制取蒸馏水 B、图Ⅱ:验证NH3易溶于水 C、图Ⅲ:将红热的Pt丝伸入盛有浓氨水的锥形瓶中,瓶口可观察到的白烟是NH4NO3 D、图Ⅳ:用SO2做喷泉实验
A、图Ⅰ:由海水制取蒸馏水 B、图Ⅱ:验证NH3易溶于水 C、图Ⅲ:将红热的Pt丝伸入盛有浓氨水的锥形瓶中,瓶口可观察到的白烟是NH4NO3 D、图Ⅳ:用SO2做喷泉实验 -
16、劳动是幸福的源泉,下列劳动项日与所述的化学知识没有关联的是( )
选项
劳动项目
化学知识
A
社区消毒:向不同区域喷洒“84”消毒液消毒
NaClO具有强氧化性
B
生产活动:葡萄酒中添加适量SO2
SO2可以漂白,防氧化
C
日常防火:用水玻璃浸泡木材或纺织品防火
Na2SiO3水溶液阻燃、耐高温
D
医疗健康:医生用氢氧化铝给病人治疗胃酸过多
氢氧化铝能与盐酸反应
A、A B、B C、C D、D -
17、2021年,我国科学家利用为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应: , 设为阿伏加德罗常数,下列有关说法正确的是。( )A、17 g H2O2中含有过氧键数目为0.5 NA B、标况下,22.4 L CH3OH中含有的羟基数为NA C、18 g D2O中含有氧原子的数目为1 NA D、1 mol O2参与反应转移电子数为4 NA
-
18、化学在生活生产中应用广泛,下列有关叙述正确的是( )A、钢水注入干燥的模具,是为了防止铁与水蒸气高温下产生H2和Fe2O3 B、利用FeCl3溶液作为“腐蚀液”制作覆铜板电路时发生了置换反应 C、硬铝常用于制造飞机的外壳,利用了合金熔点比任一组成金属低的特点 D、过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
-
19、我国近年取得了很多世界瞩目的科技成果,化学发挥了重要作用,下列正确的是( )A、神舟十四号飞船的燃料是偏二甲肼 , 偏二甲肼属于烃类 B、中国天眼FAST用到的高性能碳化硅属于新型无机非金属材料 C、2022年10月19日,中国“人造太阳”取得突破性进展,技术水平处于世界前列,反应堆中使用的、互为同位素,其物理性质和化学性质均相同 D、我国最新研发的航空发动机使用了含铼(Re)合金材料,合金是纯净物
-
20、世界文明史上,中华文化是世界上唯一从未间断的文明,始终显示出顽强的生命力和无穷的魅力。
下列文物主要由硅酸盐材料制成的是( )




A.东汉青铜奔马“马踏飞燕”
B.唐代“鎏金舞马衔杯纹银壶”
C.秦“兵马俑”
D.仅49 g的西汉“直裾素纱禅衣”
A、A B、B C、C D、D