-
1、某无色透明溶液中只可能含有Na+、K+、Ag+、Ba2+、Cu2+、Cl-、OH-、、中的一种或几种,对其进行如下实验操作:(1)、不做任何实验就可以肯定,原溶液中不存在的离子是。(2)、取少量溶液,滴加无色酚酞试剂,酚酞变红(不考虑碳酸盐溶液的碱性);说明原溶液中存在的离子是 , 不存在的离子是。(3)、另取少量溶液,加入足量溶液,产生白色沉淀;再加入足量盐酸,沉淀部分溶解,并有无色气体生成:说明原溶液中肯定存在的离子是 , 肯定不存在 , 写出无法确定是否存在的阳离子的一种检验方法(答具体操作步骤)。(4)、将(3)所得混合物过滤,向滤液中加入溶液,有白色沉淀生成,(填能/不能)说明原溶液中含 , 原因是。
-
2、根据所学知识,回答下列问题。(1)、汽车尾气中常含有NO、CO等气体,在催化剂的作用下NO和CO可反应生成和 , 请写出该反应的化学方程式:。(2)、生活中若将“84”消毒液(有效成分是NaClO)和洁厕精(主要成分是HCl)混合,易产生黄绿色有毒气体,请写出该反应的离子方程式:。(3)、胶体和溶液的本质区别是____(填标号)。A、能否发生电泳 B、分散质粒子的直径大小不同 C、能否产生丁达尔效应(4)、下列状态的物质既属于电解质又能导电的是____(填标号)。A、熔融的NaCl B、纯净的矿泉水 C、某品牌的饮料 D、熟石灰固体(5)、请运用你所学的知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?(填“是”或“不是”),若是,这个反应的氧化产物是 (填化学式)。
-
3、次磷酸与足量的氢氧化钠溶液反应生成溶液,可以用于镀铜,发生反应的离子方程式为。下列说法正确的是( )A、中元素的化合价为价 B、属于酸式盐 C、为还原产物 D、每有1个参加反应则转移4个电子
-
4、实验室制氯气时,多余氯气用氢氧化钠溶液吸收,关于该反应的下列说法正确的是( )A、仅作氧化剂 B、是还原产物 C、每生成 , 有被氧化 D、每转移电子,有被还原
-
5、下列反应属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )A、 B、 C、 D、
-
6、下列各选项中的反应①与反应②不能用同一离子方程式表示的是( )
选项
反应①
反应②
A
向AgNO3溶液中滴加稀盐酸
AgNO3溶液与食盐水混合
B
过量CO2通入NaOH溶液中
过量CO2通入澄清石灰水中
C
向烧碱溶液中滴加稀盐酸
向H2SO4溶液中滴加KOH溶液
D
向BaCl2溶液中滴加稀H2SO4
向Ba(OH)2溶液中滴加CuSO4溶液
A、A B、B C、C D、D -
7、氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是( )A、新制氯水呈淡黄绿色,是因为氯水中溶解了未反应的Cl2 B、新制氯水滴入硝酸银溶液中产生白色沉淀是因为氯水中有Cl- C、久置氯水酸性将增强 D、新制氯水能使有色布条褪色是因为Cl2具有漂白性
-
8、下列离子方程式正确的是( )A、盐酸滴在铜片上:Cu + 2H+=Cu2+ + H2↑ B、铜片插入硝酸银溶液中:Cu + Ag+=Cu2+ + Ag C、Na2SO4溶液和Ba(OH)2溶液混合:SO+ Ba2+=BaSO4↓ D、醋酸滴在大理石上:2H+ + CaCO3=Ca2+ + CO2↑+ H2O
-
9、下列说法中正确的是( )A、标准状况下, 9g H2O的体积约为11.2L B、0.5 mol O3与11.2 L O3所含的分子数一定相等 C、标准状况下,22.4L氩气含有的原子数为NA D、常温常压下,22.4 L的SO2和CO2混合气体含有2NA个氧原子
-
10、下列化学反应中,属于氧化还原反应但不属于置换反应的是( )A、CuO+COCu+CO2 B、Fe+H2SO4=FeSO4 + H2↑ C、2Na+2H2O=2NaOH + H2↑ D、H2SO4+BaCl2=BaSO4↓+ 2HCl
-
11、汽车发生碰撞时,安全气囊中发生反应: , 则下列说法正确的是( )A、是氧化剂 B、消耗的氧化剂是还原剂的5倍 C、氧化产物和还原产物的物质的量之比为1:15 D、生成6.2g Na2O时,反应转移0.2 mol电子
-
12、下列选项中离子能大量共存的是( )A、无色透明的溶液中: B、使紫色石蕊试液呈蓝色的溶液中: C、含有大量的溶液中: D、碱性溶液中:
-
13、在无色透明强碱性溶液中,能共存的离子组是( )A、Na+、CO、SO、Fe2+ B、Ba2+、NO、Cl-、Na+ C、K+、SO、HCO、Na+ D、MnO、K+、SO、Na+
-
14、钠和氯的化合物与生活密切相关,下列物质与其用途不符合的是( )A、小苏打用作制作馒头和面包的膨松剂 B、漂白粉用作郑州洪水过后环境的消毒剂 C、可用金属钠与熔融的发生置换反应制备金属Ti D、钠着火用泡沫灭火器灭火
-
15、分类是科学研究的重要方法,下列物质分类正确的是( )A、碱性氧化物:Fe2O3、Na2O2 B、同素异形体:石墨、金刚石 C、电解质:二氧化碳、氯气 D、碱:纯碱、一水合氨
-
16、我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m、分子式为C32H16N8Co)恢复了磁性,“钴酞菁”的分子结构和性质与人体的血红素和植物体叶绿素非常相似。下列说法中正确的是( )A、分子直径比钠离子小 B、“钴酞菁”分子既能透过滤纸,也能透过半透膜 C、在水中所形成的分散系属于悬浊液 D、在水中所形成的分散系具有丁达尔效应
-
17、化学与社会、生活密切相关。对下列现象或事实及解释均正确的是( )
选项
现象或事实
解释
A
过氧化钠能应用在飞船中作供氧剂
过氧化钠与CO2反应得到氧气
B
漂白粉在空气中久置变质
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C
纳米铜具有丁达尔效应
纳米铜的直径为 , 纳米铜是一种固态胶体
D
苏打、苛性钠可用于治疗胃酸过多
苏打、苛性钠都与胃酸反应
A、A B、B C、C D、D -
18、化学促进了科技进步和社会发展,下列叙述中没有涉及化学变化的是( )A、北京冬奥会场馆使用CO2跨临界将水直冷制冰 B、利用电解饱和食盐水制取NaOH C、《神农本草经》中记载的“石胆能化铁为铜” D、科学家成功将CO2转化为淀粉或葡萄糖
-
19、某研究小组通过下列路线合成镇静药物氯硝西泮。
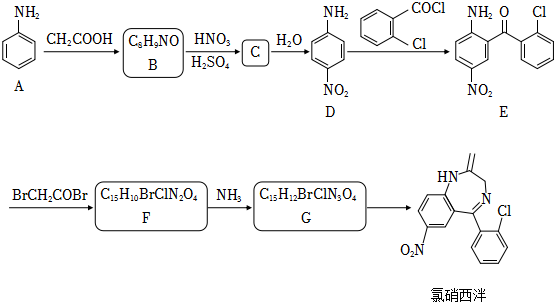
已知:
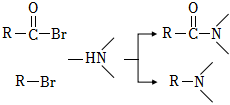
请回答:
(1)、化合物E的含氧官能团的名称是 。(2)、化合物C的结构简式是 。(3)、下列说法不正确的是 。A、化合物A→D的过程中,采用了保护氨基的方法 B、化合物A的碱性比化合物D弱 C、化合物B在氢氧化钠溶液加热的条件下可转化为化合物A D、化合物G→氯硝西泮的反应类型为取代反应(4)、写出F→G的化学方程式 。(5)、聚乳酸( )是一种可降解高分子,可通过化合物X(
)是一种可降解高分子,可通过化合物X( )开环聚合得到,设计以乙炔为原料合成X的路线 (用流程图表示,无机试剂任选)。 (6)、写出同时符合下列条件的化合物B的同分异构体的结构简式 。
)开环聚合得到,设计以乙炔为原料合成X的路线 (用流程图表示,无机试剂任选)。 (6)、写出同时符合下列条件的化合物B的同分异构体的结构简式 。①分子中含有二取代的苯环:
②1H﹣NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,无碳氧单键。
-
20、H2S可用于合成光电材料。某兴趣小组用CaS与MgCl2反应制备液态H2S,实验装置如图,反应方程式为:CaS+MgCl2+2H2O═CaCl2+Mg(OH)2+H2S↑
已知:①H2S的沸点是61℃,有毒:
②装置A内产生的H2S气体中含有酸性气体杂质。
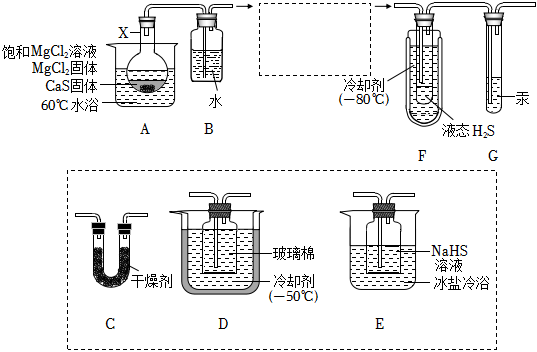
请回答:
(1)、仪器X的名称是 。(2)、完善虚框内的装置排序:A→B→→→→F+G(3)、下列干燥剂,可用于装置C中的是 。A、氢氧化钾 B、五氧化二磷 C、氯化钙 D、碱石灰(4)、装置G中汞的两个作用是:①平衡气压:②。(5)、下列说法正确的是 。A、该实验操作须在通风橱中进行 B、装置D的主要作用是预冷却H2S C、加入的MgCl2固体,可使MgCl2溶液保持饱和,有利于平稳持续产生H2S D、该实验产生的尾气可用硝酸吸收(6)、取0.680gH2S产品,与足量CuSO4溶液充分反应后,将生成的CuS置于已恒重、质量为31.230g的坩埚中,煅烧生成CuO,恒重后总质量为32.814g。产品的纯度为 。