-
1、化学与生活密切相关。下列叙述错误的是( )A、漂白粉的有效成分为次氯酸钙 B、可用作漂白剂和抗氧化剂 C、碳酸氢钠可作食品膨松剂 D、烟花中的红色源于钠元素的焰色
-
2、新制氯水中含有、、分子,它们分别属于单质、氧化物、酸,下列物质与上述三种物质的类别完全不同的是( )A、 B、 C、 D、
-
3、下列变化中 , 未涉及氧化还原反应的是( )A、钢铁生锈 B、面包腐败 C、生石灰吸水 D、溴化银分解
-
4、溶液甲可能含有八种离子中的若干种。为确定溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量溶液并加热,产牛气体(标准状况);
②向另一份溶液中加入的溶液 , 恰好可以与溶液中的离子完全反应,过滤得到43g的沉淀B和一定体积的滤液;
③向上述沉淀中加入过量的盐酸,白色沉淀部分溶解,剩余23.3g沉淀,产生的气体通入足量澄清石灰水中,得到沉淀C;
④向上述滤液中加溶液 , 恰使溶液中离子完全沉淀;
据此,请回答下列问题(用相应的离子符号表示):
(1)、实验①中可得到含有的离子是;(2)、定量分析实验②中43g沉淀成分。(写出化学式);(3)、实验③中得到沉淀C的质量为;(4)、甲溶液中一定不存在的离子是;可能存在的离子是;(5)、甲溶液一定存在的离子中,物质的量最大的离子是;物质的量最小的离子是 , 此物质的量最小的离子其物质的量为。 -
5、下列反应的离子方程式书写正确的是( )A、溶液和溶液反应: B、与溶液反应: C、与盐酸反应: D、醋酸和氢氧化铜反应:
-
6、常温下0.1mol/LFe2(SO4)3溶液中,各组离子能大量共存的是( )A、 B、 C、 D、
-
7、在无色溶液中能大量共存的一组离子是( )A、 B、 C、、 D、
-
8、已被世界卫生组织(WHO)列为级的安全高效灭菌消毒剂,我国从2000年起就逐渐用取代对饮用水进行消毒。下图是某实验室用于制备一定量较纯净的的装置(某些夹持装置等省略)。
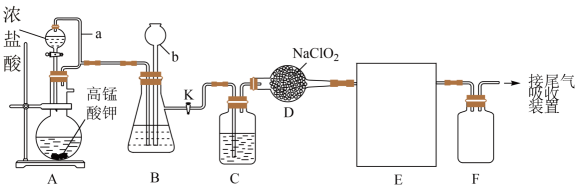
①实验室可用亚氯酸钠固体(NaClO2)与氯气反应来制备。
②通常情况下,是一种有剌激性气味的黄绿色气体、常温下1L水约溶解 , 遇热水不稳定,其熔点为-59.5℃,沸点为11℃。请回答:
(1)、盛放浓盐酸的仪器名称是。(2)、①请将A装置中发生反应的方程式配平并用单线桥法标出电子转移的方向和数目。②氧化产物是 , 被还原的元素为。
③若生成(标准状况下)气体,则反应中转移电子个数为。
④该反应中氧化剂和还原剂的物质的量之比为。
(3)、写出D中制备反应的化学反应方程式。(4)、下列操作或描述正确的是____。A、装置A中导气管a起平衡气压作用,可以使浓盐酸顺利流下 B、A装置中的高锰酸钾可用二氧化锰替代 C、E装置用以收集 , 宜采用冰水浴冷却 D、F可起防倒吸作用,若用氢氧化钠溶液吸收尾气,只含一种溶质(5)、B中所盛试剂是 , C中所盛试剂是。(6)、已知氯气与氢氧化钠溶液在较低温度下生成和 , 在较高温度下生成和在一定温度下,将一定是氯气通入氢氧化钠溶液中,溶液中生成的和个数之比为 , 则该反应中氧化剂与还原剂质量之比为。 -
9、海水提纯精盐的过程是用化学沉淀法去除粗盐中的杂质离子和 , 有学生设计出如下粗盐提纯工艺流程图
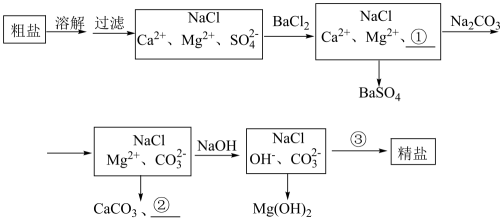 (1)、①上述溶解过程所需仪器除烧杯外,还需要的玻璃仪器为。(2)、②除杂的原则尽量不引入新杂质,但图中新引入的杂质离子①为 , ②对应的物质是。(3)、上述流程图中③处加入的试剂是(填名称),写出流程中③处发生的离子反应方程式 , 。(4)、化学沉淀法中和加入的顺序能否交换?(填“能”或“否”)。(5)、③处加入的市售试剂通常较浓,配制1L1mol/L的③处溶液,所需1.19g/mL,质量分数为的浓溶液,体积L(保留两位有效数字)。
(1)、①上述溶解过程所需仪器除烧杯外,还需要的玻璃仪器为。(2)、②除杂的原则尽量不引入新杂质,但图中新引入的杂质离子①为 , ②对应的物质是。(3)、上述流程图中③处加入的试剂是(填名称),写出流程中③处发生的离子反应方程式 , 。(4)、化学沉淀法中和加入的顺序能否交换?(填“能”或“否”)。(5)、③处加入的市售试剂通常较浓,配制1L1mol/L的③处溶液,所需1.19g/mL,质量分数为的浓溶液,体积L(保留两位有效数字)。 -
10、模拟用空气吹出法从海水中提取溴的工艺流程,如下图:
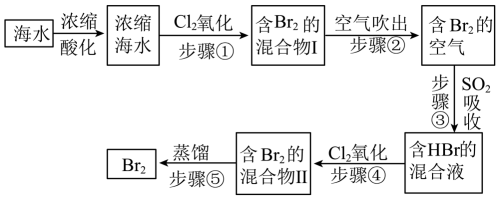
请回答下列问题。
(1)、将海水浓缩的方法是。(2)、步骤②通入热空气吹出 , 利用了的性质。(3)、步骤①中的氯气改为过氧化氢,则其反应的离子方程式是 , 步骤③反应的离子方程式是。从理论上分析,下列也能吸收溴的是(不定项选择)。A. B. C. D.
(4)、已知海水中含量为 , 在上述流程步骤①的氯气氧化过程中,若将海水中的溴元素完全氧化得到含的混合物Ⅰ,至少需要标准状况下的体积L(Cl2在水中溶解和与水反应均忽略)。 -
11、下列玻璃仪器在相应实验中应用不合理的是( )
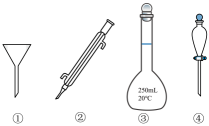 A、①用于粗盐提纯实验除去泥沙 B、②用于蒸馏法分离乙醇和 C、③用于实验室稀释浓硫酸 D、④用于提碘实验萃取后分液
A、①用于粗盐提纯实验除去泥沙 B、②用于蒸馏法分离乙醇和 C、③用于实验室稀释浓硫酸 D、④用于提碘实验萃取后分液 -
12、实验室海带提碘的实验中不涉及的操作是( )A、浸泡 B、萃取 C、过滤 D、蒸发
-
13、短周期元素Q、R、T、X、Y在元素周期表中的位置如图所示,期中X所处的周期序数与主族序数相等。请回答下列问题:
 (1)、R元素在元素周期表中的位置为(2)、Q元素的最高价氧化物对应的水化物电离的方程式是。(3)、Y的氢化物稳定性(强/弱),原因是。(4)、R、T、X元素形成的简单离子的半径由小到大的顺序为(用离子符号表示)。T元素的氢化物可用于在室温下实验室制备氧气,该化合物的结构式是 , 在相同条件下,T的三原子组成的单质相对于氢气的密度是。(5)、Q有多种氧化物,其中甲的相对分子质量最小,一定条件下,的甲气体与的氧气相混合点燃,完全反应后气体被足量的溶液完全吸收后没有气体残留,所生成Q的含氧酸盐只有一种,则该含氧酸盐的化学式是 , 属于晶体。
(1)、R元素在元素周期表中的位置为(2)、Q元素的最高价氧化物对应的水化物电离的方程式是。(3)、Y的氢化物稳定性(强/弱),原因是。(4)、R、T、X元素形成的简单离子的半径由小到大的顺序为(用离子符号表示)。T元素的氢化物可用于在室温下实验室制备氧气,该化合物的结构式是 , 在相同条件下,T的三原子组成的单质相对于氢气的密度是。(5)、Q有多种氧化物,其中甲的相对分子质量最小,一定条件下,的甲气体与的氧气相混合点燃,完全反应后气体被足量的溶液完全吸收后没有气体残留,所生成Q的含氧酸盐只有一种,则该含氧酸盐的化学式是 , 属于晶体。 -
14、《自然》杂志曾报道我国科学家通过测量中和两种核素的比例确定“北京人”生存年代的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:(1)、和____。A、是同种元素 B、是同种核素 C、具有相同中子数 D、具有相同性质(2)、自然界一共存在三种硅的稳定同位素,分别是、、。
①原子的结构示意图为。
②计算硅元素的近似相对原子质量的计算为 , 其中……是指各同位素的。
(3)、向盐酸中逐滴滴加硅酸钠溶液,当达到6~7时得到一种乳白色、半透明的分散系,其分散质为粒径在的粒子。该分散系属于(选填“溶液”“浊液”“胶体”),简单的证明方法是。 -
15、下列叙述中正确的是( )A、含离子键的化合物一定是离子化合物 B、含共价键的化合物一定是共价化合物 C、全部由非金属元䋈组成的化合物一定是共价化合物 D、在离子化合物中不可能有共价键
-
16、S与Cl为同一周期元素,下列事实正确且能比较两者非金属性强弱的是( )A、热稳定性: B、酸性: C、氢化物的沸点: D、将氯气通入溶液中,观察到有淡黄色沉淀产生
-
17、下列化学用语不正确的是( )A、的原子结构示意图是:
 B、的电子式是:
B、的电子式是: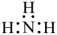 C、的分子结构式是:
C、的分子结构式是: D、的形成过程是:
D、的形成过程是:
-
18、请用你学到的化学知识填空。
I.实验空用固体配制的溶液,回答下列问题.
(1)、需要固体g。(2)、配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、。(3)、用胶头滴管滴加蒸馏水至刻度线时,某同学按照如图所示进行操作,配成的溶液的实际浓度(填“偏大”或“偏小”)。 (4)、II、某小组同学依据性质差异,采用比较的方法设计实验鉴别和 .
(4)、II、某小组同学依据性质差异,采用比较的方法设计实验鉴别和 .实验Ⅰ
实验Ⅱ
实验Ⅲ



实验I中,分别向两支试管中滴加几滴水,A中温度计示数略有降低,B中温度计略开高.说明固体b与水作用的过程中(填“放出”或“吸收”)热量,可判断固体b为。
(5)、实验II中,向试管C和D中分别加入水,充分振荡,试管C中固体有剩余,试管D中固体完全溶解。①判断固体d为(填化学式)。
②分别向两支试管中滴加2滴酚酞,(填“C”或“D”)试管中红色较浅。
③实验Ⅲ中,分别向溶液e和溶液f中逐滴加入稀盐酸,F中开始滴加就可以观察到气泡;E中开始无气泡产生,一段时间后产生气泡。结合离子方程式解释E中开始无气泡产生的原因。
-
19、请用你学到的化学知识填空。
I.某工厂的工业废水中含有大量的和较多的。为了减少污染并变废为宝,工厂计划从该废水中回收和金属铜。请根据以下流程图,回答下列问题。
 (1)、操作I的名称是 , 固体A是(填化学式),固体C是(填化学式)。(2)、为防止溶液氧化变质,应在溶液中加入少量 , 其原因是。(3)、把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中和物质的量浓度恰好相等。则已反应的和未反应的的物质的量之比为。(4)、Ⅱ. 实验室制氯气可用下图装置,并进行氯气性质实验。
(1)、操作I的名称是 , 固体A是(填化学式),固体C是(填化学式)。(2)、为防止溶液氧化变质,应在溶液中加入少量 , 其原因是。(3)、把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中和物质的量浓度恰好相等。则已反应的和未反应的的物质的量之比为。(4)、Ⅱ. 实验室制氯气可用下图装置,并进行氯气性质实验。
写出实验室制备氯气的化学方程式:。
将氯气通入冷的石灰乳中可制备用于环境消毒的漂白粉,写出此反应的化学方程式。
(5)、将氯气通入溶液中可发生置换反应,写出反应的离子方程式;通过单质之间的置换证明氧化性(填“”,“”或“”)。 -
20、下表列出了①~⑨九种元素在周期表中的位置。
族
周期
ⅠA
ⅡA
ⅢA IVA VA VIA VIIA 0 1
①
2
②
③
④
3
⑤
⑥
⑦
⑧
⑨
请按要求回答下列问题:
(1)、元素⑦的原子结构示意图:;元素⑤与⑧组成的化合物的电子式:;该化合物中化学键类型为。(2)、元素⑤~⑧中原子半径最大的是(填元素符号)。(3)、元素①~⑨中化学性质最不活泼的是(填元素符号)(4)、元素③的最简单氢化物,分子的空间结构呈形。(5)、元素⑤和⑥的最高价氧化物对应的水化物分别为X和Y,其中属于两性氢氧化物的是(填化学式),X和Y反应的离子方程式:。(6)、元素⑤在元素③构成的常见单质中加热燃烧生成产物M,写出M与二氧化碳反应的化学方程式。