-
1、盐的水解及沉淀的溶解平衡是中学化学研究的重点之一、回答下列问题:(1)、已知常温下甲酸()的电离常数。
①写出水解反应的离子方程式: , 往其溶液中加入下列物质,能促进水解的是 (填字母)。
A. B. C. D.
②常温下,向溶液中滴入的溶液,溶液的变化曲线如图所示,d点溶液中(保留两位有效数字);b点溶液中:(填“>”“<”或“=”)。
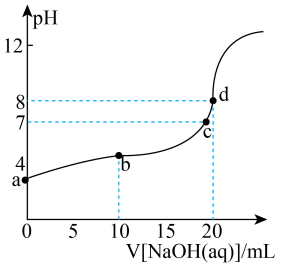 (2)、某酸性工业废水中含有一定量的硫酸铜,其物质的量的浓度为 , 向该溶液中加入氢氧化钠稀溶液除去(、、)
(2)、某酸性工业废水中含有一定量的硫酸铜,其物质的量的浓度为 , 向该溶液中加入氢氧化钠稀溶液除去(、、)①常温下要使降低为 , 溶液的应调至。
②向硫酸铜溶液中通入气体,该反应的离子方程式为 , 当溶液中的时,。
(3)、时,向溶液中滴加溶液(一种酸,酸性强弱未知)时,溶液中由水电离的浓度随加入的体积的变化如图所示:
①若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会(填“增大”“不变”或“减小”)。
②若c点溶液中溶质的总物质的量为 , 向c点溶液中加入的 , 此时溶液满足的元素质量守恒式为。
-
2、短周期主族元素的原子序数依次增大,原子序数是6,Q元素基态原子核外有三个未成对电子,与同主族,的原子序数是的2倍,元素在同周期中原子半径最大。回答下列问题:(1)、可以正确描述W原子结构的是____(填字母)。A、原子结构示意图:
 B、原子核外能量最高的电子云图像:
B、原子核外能量最高的电子云图像: C、碳原子:
D、原子的轨道表示式:
C、碳原子:
D、原子的轨道表示式: (2)、Z元素基态原子
(2)、Z元素基态原子 电子排布式为 , 基态Z原子的价电子中,两种自旋状态的电子数之比为。 (3)、基态X原子的未成对电子数为 , 其价电子轨道表示式为。(4)、图a、b、c分别表示W、Q,X和F的逐级电离能(Ⅰ)变化趋势(纵坐标的标度不同)。第一电离能的变化图是(填标号)。
电子排布式为 , 基态Z原子的价电子中,两种自旋状态的电子数之比为。 (3)、基态X原子的未成对电子数为 , 其价电子轨道表示式为。(4)、图a、b、c分别表示W、Q,X和F的逐级电离能(Ⅰ)变化趋势(纵坐标的标度不同)。第一电离能的变化图是(填标号)。 (5)、W、Q、X、Y四种元素的电负性由大到小的顺序为(用元素符号表示);最高价氧化物对应水化物的酸性:W(填“>”或“<”)Q。
(5)、W、Q、X、Y四种元素的电负性由大到小的顺序为(用元素符号表示);最高价氧化物对应水化物的酸性:W(填“>”或“<”)Q。 -
3、电化学知识与我们的生产、生活密切相关。回答下列问题:(1)、某兴趣小组同学利用氧化还原反应 , 设计了如图所示原电池,其中甲、乙两烧杯中各物质的量浓度均为 , 盐桥中装有饱和溶液。

①发生还原反应的烧杯是(填“甲”或“乙”)。
②外电路的电流方向:(填“”或“”)。
③电池工作时,盐桥中的移向(填“甲”或“乙”)烧杯。
④甲烧杯中发生的电极反应式为。
(2)、利用反应(未配平)消除的简易装置如图所示,电极b的反应式为 , 消耗标准状况下时,被消除的的物质的量为。
-
4、科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是( )
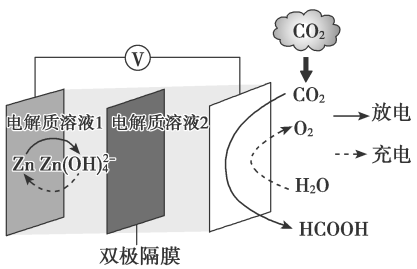 A、充电时,电池总反应为2=2Zn+O2↑+4OH-+2H2O B、充电时,正极溶液中OH-浓度升高 C、放电时,1molCO2转化为HCOOH,转移的电子数为2mol D、放电时,负极反应为Zn-2e-+4OH-=
A、充电时,电池总反应为2=2Zn+O2↑+4OH-+2H2O B、充电时,正极溶液中OH-浓度升高 C、放电时,1molCO2转化为HCOOH,转移的电子数为2mol D、放电时,负极反应为Zn-2e-+4OH-= -
5、如图为阳离子交换膜法以石墨为电极电解饱和溶液的原理示意图。已知溶液从A口进料,含少量的水从B口进料,下列说法错误的是( )
 A、阳极发生氧化反应,有氧气生成 B、从E出口逸出的气体是 C、从D出口流出的是较浓的溶液 D、电路中转移电子时,阳极区有生成
A、阳极发生氧化反应,有氧气生成 B、从E出口逸出的气体是 C、从D出口流出的是较浓的溶液 D、电路中转移电子时,阳极区有生成 -
6、如图为水的电离平衡曲线,下列说法正确的是( )
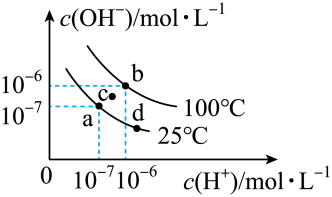 A、图中四点所对应的的大小关系: B、时,的溶液中, C、若d点为盐酸溶液,稀释该溶液可由d点变化到a点 D、时,向溶液中逐滴加入溶液,溶液中的值会逐渐增大
A、图中四点所对应的的大小关系: B、时,的溶液中, C、若d点为盐酸溶液,稀释该溶液可由d点变化到a点 D、时,向溶液中逐滴加入溶液,溶液中的值会逐渐增大 -
7、具有下列电子层结构的原子或离子,其对应元素一定属于同一周期的是( )A、两原子核外全部都是s电子 B、最外层电子排布式为的原子和最外层电子排布式为的离子 C、能级上只有一个空轨道的原子和能级上只有一个未成对电子的原子 D、原子核外M层上的s、p能级都充满电子,而能级上没有电子的原子和离子
-
8、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:。下列说法不正确的是( )A、该电池属于二次电池和碱性电池 B、电极是电池的负极,发生氧化反应 C、电池工作过程中,电解质溶液的浓度保持不变 D、充电时,电池的正极应与电源的正极相连
-
9、下表列出了某短周期元素的各级电离能数据(用、表示,单位为)。
……
R
740
1500
7700
10500
……
下列关于元素的判断中一定正确的是( )
A、R的最高正价为+3 B、R元素位于元素周期表中第IIA族 C、R元素的原子最外层共有4个电子 D、R元素基态原子的电子排布式为 -
10、锅炉水垢是一种安全隐患,为除去水垢中的 , 可先用溶液处理,很容易使之转化为 , 再用酸除去 , 下列说法错误的是( )A、 B、沉淀转化的难易与溶解度大小有关 C、转化反应的平衡常数 D、沉淀转化的实质是沉淀溶解平衡的移动
-
11、下列实验设计或装置能达到实验目的的是( )
 A、按甲的电路连接对反应塔进行防腐保护 B、用乙测定中和反应的反应热 C、用丙探究硫酸浓度对化学反应速率的影响 D、按丁设计锌铜“双液原电池”实现化学能持续转化为电能
A、按甲的电路连接对反应塔进行防腐保护 B、用乙测定中和反应的反应热 C、用丙探究硫酸浓度对化学反应速率的影响 D、按丁设计锌铜“双液原电池”实现化学能持续转化为电能 -
12、下列说法错误的是( )A、原子核外电子填充能级的顺序为 B、基态铁原子的价层电子排布式为 C、少数基态原子的核外电子排布不遵循构造原理 D、构造原理中的电子排布能级顺序,实质是各能级能量由低到高的顺序
-
13、在一刚性密闭容器内发生反应 , 若内B减少了 , 则下列说法正确的是( )A、反应达到平衡时 B、容器内气体总密度不再改变是该反应达到平衡的标志 C、末时用B表示反应速率为 D、升高温度能加快反应速率主要是其使活化分子的能量明显增加
-
14、化学与生产、生活密切相关。下列说法错误的是( )A、氯化铵溶液可以除铁锈 B、刷牙用含氟牙膏可使牙齿更坚固 C、氯碱工业电解槽采用阴离子交换膜 D、铝盐与小苏打可以作泡沫灭火器药品
-
15、图1和图2分别是1s电子的概率密度分布图和电子云轮廓图。下列有关说法正确的是( )
 A、图1中的每个小黑点都表示1个电子 B、图1中的小黑点表示电子在核外所处的位置 C、图2表明1s轨道呈球形,有无数对称轴 D、图2表示1s电子只能在球体内出现
A、图1中的每个小黑点都表示1个电子 B、图1中的小黑点表示电子在核外所处的位置 C、图2表明1s轨道呈球形,有无数对称轴 D、图2表示1s电子只能在球体内出现 -
16、下列溶液一定呈酸性的是( )A、含有的溶液 B、的溶液 C、的某电解质溶液 D、的溶液
-
17、下列表示氮原子的符号和图示中能反映能级差别和电子自旋状态的是( )A、
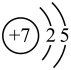 B、
C、
D、
B、
C、
D、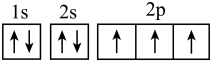
-
18、硫酸厂产生的烧渣(主要含、 , 还含有一定量的)可用于制备 , 某兴趣小组在实验室模拟该流程如下,请回答下列问题:

已知:、均不溶于硫酸,也不与硫酸反应
(1)、烧渣在加入稀硫酸溶解前需要粉碎,其目的是。(2)、“酸溶”时最适宜采用的加热方法是。(3)、“过滤I”的滤渣主要成分为(填化学式)。(4)、“还原”时需适当过量,其目的是将全部还原成 , 检验已完全转化的试剂为(填化学式);“还原”时既无沉淀生成又无气体生成,且“还原”后溶液中阴离子种类不变,写出“还原”过程中反应的离子方程式。(5)、写出“沉淀”时反应的离子方程式 , “过滤Ⅲ”所得滤液的主要成分为(填化学式),其主要用途为。(6)、所得需充分洗涤,检验是否洗净所需试剂是(填化学式)。 -
19、一氧化二氯()是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 , 反应的原理如下:。
已知:的部分性质如表所示
物理性质
化学性质
常温下,是棕黄色、有刺激性气味的气体;熔点:;沸点
易溶于水,同时与水反应生成

请回答下列问题:
(1)、装置A中仪器a的名称为 , 装置A中发生反应的化学方程式为。(2)、装置B中盛装的试剂的名称为。(3)、装置E采用冰水混合物冷却的目的是。(4)、装置F中无水的作用是。(5)、装置G中发生反应的离子方程式为。(6)、与传统消毒剂比较,消毒效率是的倍(产物视为 , 消毒效率以单位质量得到的电子数表示,结果精确到0.01)。 -
20、下图是部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数递增的变化情况,a→h代表八种元素,请根据推断出的元素回答下列问题:
 (1)、c的元素符号 , 它在元素周期表中位于第周期,第族。(2)、由a和b组成含10个电子的分子的电子式。(3)、d和e形成的既含离子键又含非极性共价键的化合物的化学式为 , 该化合物中阴离子与阳离子的个数比为 , 该物质与水反应的化学方程式为。(4)、e的最高价氧化物的水化物与f的最高价氧化物的水化物反应的离子方程式为(5)、能比较元素g、h的非金属性强弱的实验事实是____(填标号)。A、h单质可从g的氢化物的水溶液中置换出g单质 B、g的氢化物水溶液的酸性比h的氢化物水溶液的酸性弱 C、h的氢化物的稳定性比g的氢化物的稳定性强
(1)、c的元素符号 , 它在元素周期表中位于第周期,第族。(2)、由a和b组成含10个电子的分子的电子式。(3)、d和e形成的既含离子键又含非极性共价键的化合物的化学式为 , 该化合物中阴离子与阳离子的个数比为 , 该物质与水反应的化学方程式为。(4)、e的最高价氧化物的水化物与f的最高价氧化物的水化物反应的离子方程式为(5)、能比较元素g、h的非金属性强弱的实验事实是____(填标号)。A、h单质可从g的氢化物的水溶液中置换出g单质 B、g的氢化物水溶液的酸性比h的氢化物水溶液的酸性弱 C、h的氢化物的稳定性比g的氢化物的稳定性强