-
1、下列说法不正确的是( )A、二氧化硅生产的光导纤维能有效提高通信效率 B、中国华为集团自主研发的“麒麟”芯片在生产时需要用到高纯度的硅 C、普通玻璃的生产以纯碱、石灰石、石英砂为主要原料 D、工业上制硫酸和硝酸的最后一步都是用水来吸收
-
2、一定温度下,往的密闭容器中通入气体X发生放热反应: , X的物质的量随时间的变化曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述正确的是( )
 A、实线表示的是使用催化剂的情形 B、反应进行到a点时的平均反应速率可表示为 C、b点已达到了化学平衡状态,若升高温度正、逆反应速率都加快,原平衡被破坏 D、反应进行到a点时放出的热量大于反应进行到b点时放出的热量
A、实线表示的是使用催化剂的情形 B、反应进行到a点时的平均反应速率可表示为 C、b点已达到了化学平衡状态,若升高温度正、逆反应速率都加快,原平衡被破坏 D、反应进行到a点时放出的热量大于反应进行到b点时放出的热量 -
3、设表示阿伏加德罗常数的值.下列说法正确的是( )A、个分子的体积约为 B、常温常压下,乙烷中含有的共价键数日为 C、标准状况下,壬烷中含有的分子数目为 D、氨水中,含有的的数目共为
-
4、下列关于甲烷与氯气的反应表述正确的是( )A、该反应为置换反应 B、若过量,则有机产物仅为 C、若生成等物质的量的四种有机产物则需消耗 D、反应条件是水浴加热
-
5、某原电池装置如图所示,下列叙述正确的是( )
 A、电子经过溶液流向电极 B、作负极,发生氧化反应 C、铜电极的电极反应式: D、电池工作时,溶液中移向正极
A、电子经过溶液流向电极 B、作负极,发生氧化反应 C、铜电极的电极反应式: D、电池工作时,溶液中移向正极 -
6、下列方程式书写正确的是( )A、碳酸氢铵的电离: B、二氧化氮与水反应: C、工业制粗硅: D、过量通入溶液中:
-
7、过量铁与稀硫酸反应,下列措施能加快反应速率但又不改变生成的总量的是( )A、加入适量溶液 B、加入少量水 C、加入少量固体 D、用的浓硫酸代替稀硫酸
-
8、下列说法中正确的是( )A、锂离子电池、铅蓄电池都是一次电池 B、锌锰干电池放电时被还原 C、化学电池实现了化学能全部转化为电能 D、燃料电池是一种清洁、安全、低效的新型电池
-
9、下列说法不正确的是( )A、化学反应必然伴随着能量的变化 B、化学反应中能量变化的主要原因是化学键的断裂与形成 C、化学键断裂需要吸收能量 D、放热反应中任一反应物的能量都高于生成物的能量
-
10、关于反应 , 下列说法不正确的是( )A、C发生了氧化反应 B、反应中N元素被还原 C、浓硝酸体现了酸性和氧化性 D、氧化产物与还原产物的物质的量之比为
-
11、下列说法正确的是( )A、与互为同位素 B、石墨烯和碳纳米管互为同素异形体 C、与互为同分异构体 D、和互为同系物
-
12、下列反应属于氧化还原反应,且能量变化如图所示的是( )
 A、镁与盐酸的反应 B、双氧水的分解反应 C、灼热的炭与的反应 D、晶体与晶体的反应
A、镁与盐酸的反应 B、双氧水的分解反应 C、灼热的炭与的反应 D、晶体与晶体的反应 -
13、下列物质与俗名对应不正确的是( )A、氯仿: B、水玻璃:水溶液 C、重晶石: D、胆矾:
-
14、下列表示物质结构的化学用语或模型不正确的是( )A、氮气的结构式: B、分子的球棍模型:
 C、的结构示意图:
C、的结构示意图: D、异丁烷的结构简式:
D、异丁烷的结构简式:
-
15、在粗盐提纯实验中不需要用到的仪器是( )A、烧杯 B、玻璃棒 C、酒精灯 D、坩埚
-
16、下列属于酸性氧化物的是( )A、 B、 C、 D、
-
17、下列设备或物品工作时,将化学能转化为电能的是( )
 A、硅太阳能电池 B、干电池 C、燃气灶 D、太阳能集热器
A、硅太阳能电池 B、干电池 C、燃气灶 D、太阳能集热器 -
18、一种非甾体抗炎药物(H)的合成路线如下(部分反应条件省略):
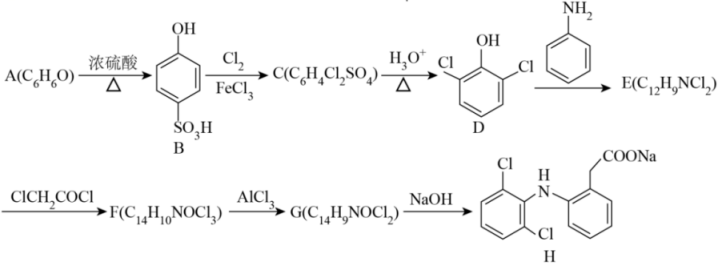
已知:
Ⅰ.

Ⅱ.

回答下列问题:
(1)、物质B中含氧官能团名称。(2)、下列说法正确的是____。A、反应D→E的反应类型是取代反应 B、含物质A的溶液中滴加氯化铁溶液,产生紫色沉淀 C、物质H中最多有13个碳原子共平面 D、设计A→B和C→D两步反应的目的是保护酚羟基的对位氢不被取代(3)、E→F的化学反应方程式为。(4)、G的结构简式为。(5)、符合下列条件G的同分异构体有种,写出其中一种结构简式为。①除
 结构外,不含其他环状结构;
结构外,不含其他环状结构;②含有;
③含有四种化学环境的氢
(6)、已知:。综合上述信息,写出以 和为主要原料制备
和为主要原料制备 的合成路线
的合成路线 -
19、实验室制备苯甲酸(相对分子质量122),提纯及纯度测定步骤如下:
Ⅰ.往圆底烧瓶中加入2.5mL甲苯和140mL水,加热至沸,从仪器A上口(如图)分批加入10.4g 固体,最后用少量水将粘在仪器A内壁的固体冲洗入圆底烧瓶内。

Ⅱ.继续煮沸并间歇性摇动圆底烧瓶,直至甲苯完全反应。
(反应方程式:
 )
)Ⅲ.趁热过滤反应混合物,用少量热水洗涤滤渣,合并滤液和洗涤液,将滤液放在冷水浴中冷却,用浓硫酸酸化,使溶液从强碱性至强酸性,苯甲酸全部析出为止。
Ⅳ.过滤可得粗产品约2g。用重结晶法提纯。
Ⅴ.用碱滴定法测纯度,取0.1000g样品,溶于乙醇中,加入10mL水和2滴酚酞,用0.02mol/L NaOH溶液滴定。
回答下列问题。
(1)、步骤Ⅰ中仪器A的名称是。(2)、步骤Ⅱ加热前需要向圆底烧瓶中加入沸石,目的是。(3)、步骤Ⅲ“趁热过滤反应混合物,用少量热水洗涤滤渣”中使用热水的目的是(4)、步骤Ⅳ中重结晶操作的合理步骤为a→→→→。(步骤不重复)a.加入约100mL水(75℃)配制成热的浓溶液;
b.加半匙活性炭;
c.用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;
d.搅拌下将溶液煮沸3~5min,趁热过滤;
e.冷却结晶,过滤、洗涤、晾干得苯甲酸纯品。
(5)、步骤Ⅴ中测得苯甲酸纯度大于100%的可能原因是 , 因此将该步骤改为中和酸滴定法:称取0.1000g样品,溶于15mL浓度为0.1mol/L NaOH溶液中,加入2滴酚酞作指示剂,用0.1000mol/L盐酸调至红色消失,加入20mL乙醚,10滴溴酚蓝作指示剂,摇匀,用0.1000mol/L盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,水层显淡绿色时为滴定终点,四次滴定平行数据如表,则苯甲酸的纯度为。序号
1
2
3
4
样品质量/g
0.1000
0.1000
0.1000
0.1000
耗酸体积/mL
8.00
8.02
7.98
8.96
-
20、“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国的新名片。(1)、Ⅰ.已知25℃和101kPa下:
①
②
③
表示(l)燃烧热的热化学方程式为。(2)、Ⅱ.和在一定条件下反应可制得合成气,反应方程式: 。该反应在(填“高温”或“低温”)条件下能自发进行。
(3)、下列能判断达到平衡状态的是____。A、一定温度下,容积固定的容器中,密度保持不变 B、容积固定的绝热容器中,温度保持不变 C、一定温度和容积固定的容器中,平均相对分子质量不变 D、和的物质的量之比不再改变(4)、一定条件下,在2L密闭容器中通入和各1mol,反应达到平衡时,测得的物质的量为1mol,则此条件下,该反应的平衡常数为。(5)、Ⅲ.如图所示组成闭合回路,其中甲装置是新型电池,以—为原料,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出。
装置中气体A为(填“”或“和”),a极上的电极反应式为。