-
1、氯及其部分化合物相关转化如下.

请回答:
(1)、常温下,与溶液反应的离子方程式:.(2)、下列有关流程中的物质的说法正确的是:____.A、工业上采用软锰矿(主要成分是)与浓盐酸混合加热制备 B、混合物A、B的物质的量之比为可为5:1 C、若C中的各原子最外层均达8电子稳定结构,C确定为 D、具有强氧化性,用作自来水的消毒剂(3)、与浓硫酸反应可得( ): , 利用减压蒸馏分离.试解释高氯酸比硫酸易从体系中分离的原因(从结构角度分析):.在液态时为双聚体,请写出的结构式:. (4)、通过分析,M分子中只有一种化学环境的氢原子.与经过氧化反应、取代反应,两步生成M和D,写出总反应化学方程式:。设计实验检验D:。
): , 利用减压蒸馏分离.试解释高氯酸比硫酸易从体系中分离的原因(从结构角度分析):.在液态时为双聚体,请写出的结构式:. (4)、通过分析,M分子中只有一种化学环境的氢原子.与经过氧化反应、取代反应,两步生成M和D,写出总反应化学方程式:。设计实验检验D:。 -
2、碳、硅元素及其化合物在生产生活中应用广泛。请回答:(1)、基态硅原子核外电子排布式:。(2)、与碳的氢化物类似,硅元素的氢化物硅烷的通式为:SinH2n+2。
下列有关说法不正确的是____。
A、Si3H8没有同分异构体 B、Si-Si键能比C-C键能小,故热稳定性:SinH2n+2<CnH2n+2 C、SinH2n+2中Si原子杂化方式均为sp3 D、SinH2n+2可与水反应生成氢气(3)、硅酸盐是地壳中的主要成分。硅酸盐的最简单阴离子为 , 为硅氧四面体,结构如图1。在溶液中形成的分子形态脱水易形成凝胶状的固体物质—硅胶.硅胶继续脱水,形成了共用氧原子的硅氧四面体骨架—SiO2(硅石)。联系相关信息,解释硅胶转变为硅石后,硬度变大的原因:。 (4)、石墨与金属钾反应生成钾的石墨插层化合物KCx: , KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。
(4)、石墨与金属钾反应生成钾的石墨插层化合物KCx: , KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。
①x=。
②若石墨层内的大π键可表示为(上标表示电子总数,下标表示轨道数),则平均每个KCx单元中的大π键可表示为(用具体的数据表示)。
③KCx中,石墨层间,每个钾离子相距最近且等距的钾离子有个。
-
3、探究硫元素及常见含硫物质的性质,下列方案设计、现象和结论都正确的是( )
实验方案
现象
结论
A
溶液加入溶液,振荡
出现乳白色浑浊,产生气体
生成硫单质,不能证明有氧化性
B
将铜丝放入浓硫酸中,加热
开始时铜丝表面变黑,产生无色气体,后黑色固体溶解
由氧化还原规律可知黑色固体一定是
C
久置于空气中的水溶液
出现乳白色浑浊
不稳定,易分解
D
0.5g硫粉和1.0g铁粉混合均匀,在石棉网上堆成条状,用灼热的玻璃棒接触混合粉末的一段
粉末呈红热状态,持续反应,冷却后得到黑色固体
硫粉与铁粉接触面积大,反应放热,生成黑色
A、A B、B C、C D、D -
4、工业废水中的、等可通过沉淀法除去.现有、均约为的工业废水1L,下列说法不正确的是( )
已知:25℃,只存在于溶液中,固体立刻分解,饱和溶液的浓度约为.
难溶物
电离常数 , , [当溶液中离子浓度小于时可视为完全沉淀,不考虑与的进一步反应,不考虑废水中其它离子参与反应].
A、可用除去废水中的、 B、调节至 , 溶液中未沉淀完全 C、通过滴加溶液,可使沉淀和沉淀分离 D、向废液中通入至饱和,大于 -
5、室温时用稀硝酸可将苯酚直接硝化,转化关系及部分产物产率表示如下:

反应历程:

下列说法不正确的是( )
A、工业生产中产物Ⅱ由于存在分子内氢键,易被水蒸气蒸出,产品容易提纯 B、反应生成产物Ⅱ过程中最大能垒为 C、反应足够长的时间,升高温度可提高体系中产物Ⅰ的产率 D、反应中体系中加入浓硫酸有利于产生活性中间体 , 可促使反应进行
, 可促使反应进行
-
6、高能耗的氯碱工业,经过优化工艺设计可降低能耗.下图所示设计中,表示了相关物料的传输和转化关系,下列说法不正确的是( )
 A、该设计中主要的节能之处一是用氢氧燃料电池来供电,二是提高溶液浓度 B、离子交换膜Ⅰ应选用阳离子交换膜,离子交换膜Ⅱ选用阴离子交换膜 C、图中Y为氢气,Y在燃料电池中发生的电极反应是: D、燃料电池装置中通空气的一端发生还原反应
A、该设计中主要的节能之处一是用氢氧燃料电池来供电,二是提高溶液浓度 B、离子交换膜Ⅰ应选用阳离子交换膜,离子交换膜Ⅱ选用阴离子交换膜 C、图中Y为氢气,Y在燃料电池中发生的电极反应是: D、燃料电池装置中通空气的一端发生还原反应 -
7、乙酰苯胺是一种具有解热镇痛作用的白色晶体,20℃时在乙醇中的溶解度为36.9 g,在水中溶解度为0.46 g,100℃时水中溶解度为5.50 g。某实验小组设计提纯粗乙酰苯胺(含少量氯化钠和有机杂质)方案如下:

下列说法不正确的是( )
A、操作Ⅰ中若观察到乙酰苯胺未完全溶解,可补加适量水 B、操作Ⅱ稍冷却目的是防止暴沸,加入活性炭可吸附有机杂质 C、操作Ⅲ宜缓慢自然冷却结晶,有利于得到较大晶体颗粒 D、操作Ⅳ可用乙醇洗涤,利于快速晾干 -
8、原子序数依次递增的前四周期的X、Y、Z、W元素,其中X与Y、Z均相邻,X与Y有多种常见氧化物,元素X的某种氧化物甲含氧量为50%,甲可以水解为一种多元有机酸.Y与Z能形成一种高沸点、高硬度的化合物,该化合物中Y元素含量为40%.W元素基态原子最外层只有一个电子,内层能级全充满.下列说法不正确的是( )A、氧化物甲的实验式可以表示为 B、Y同周期元素中第一电离能比Y大的主族元素有2种 C、电负性: D、原子半径:
-
9、苯乙烯可发生如下转化,下列说法中不正确的是( )
 A、苯乙烯分子中所有碳原子可共平面 B、X的结构简式可能是
A、苯乙烯分子中所有碳原子可共平面 B、X的结构简式可能是 , 该反应需要控制温度减少碳碳双键被氧化
C、与足量溶液反应,最多消耗
D、聚合物Z的结构可表示为
, 该反应需要控制温度减少碳碳双键被氧化
C、与足量溶液反应,最多消耗
D、聚合物Z的结构可表示为
-
10、用离子方程式表示下列反应,不正确的是( )A、亚硫酸钠溶液中通入二氧化硫气体: B、铜片和足量浓硝酸反应: C、硫酸铜溶液中滴入氨水至产生沉淀恰好溶解时总的离子方程式为: D、常温下,内壁沾有硫的试管中加入溶液,振荡后得到略显黄色的澄清溶液:
-
11、下列说法不正确的是( )A、与环氧丙烷(
 )在催化剂作用下聚合得到可降解高分子材料
)在催化剂作用下聚合得到可降解高分子材料 B、牛胰岛素分子中含6个硫原子,硫元素含量约为3.6%,可求出其相对分子质量为5533
C、以农林产品中的木材、秸秆等经加工可生产人造丝、人造棉等化学纤维
D、在加热和催化剂的作用下,可使石油中的链状结构转化为环状结构,获得芳香烃.
B、牛胰岛素分子中含6个硫原子,硫元素含量约为3.6%,可求出其相对分子质量为5533
C、以农林产品中的木材、秸秆等经加工可生产人造丝、人造棉等化学纤维
D、在加热和催化剂的作用下,可使石油中的链状结构转化为环状结构,获得芳香烃.
-
12、室温下,下列各组离子在指定溶液中可能大量共存的是( )A、水电离出的的溶液中:、、、 B、加入铝粉能放出氢气的溶液中:、、 C、透明的溶液中:、、、 D、溶液:、、、
-
13、二氧化氯泡腾片是常用的鱼缸消毒剂,也可用于除居室甲醛,其反应方程式可表示为: , 下列说法不正确的是( )A、甲醛具有还原性 B、二氧化氯是氧化剂,还原产物为 C、反应生成 , 则转移4mol电子 D、若将二氧化氯改为次氯酸钠,消耗等量甲醛所需与的物质的量之比为
-
14、下列设计正确且能实现实验目的的是( )
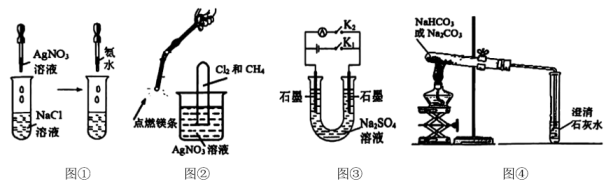 A、图①,验证可溶于氨水 B、图②,验证氯气和甲烷反应生成了 C、图③,闭合一段时间,再打开闭合可制得简易燃料电池,左侧石墨为电池负极 D、图④,分别加热不能证明分解温度高于
A、图①,验证可溶于氨水 B、图②,验证氯气和甲烷反应生成了 C、图③,闭合一段时间,再打开闭合可制得简易燃料电池,左侧石墨为电池负极 D、图④,分别加热不能证明分解温度高于 -
15、物质的性质决定用途,下列两者对应关系不正确的是( )A、二氧化硫具有漂白性,食品中添加适量的SO2有防腐和抗氧化作用 B、氯化铁溶液有氧化性,可用于蚀刻不锈钢广告牌上的图形 C、生铁硬度大,抗压性强,可用于铸造机器底座 D、新型陶瓷碳化硅(SiC)硬度很大,可用作砂纸和砂轮的磨料
-
16、碳酸钠和碳酸氢钠在生产生活中有广泛的应用.下列有关说法不合理的是( )A、通过化合反应可由碳酸钠制得碳酸氢钠 B、可用碳酸钠溶液处理锅炉水垢中的硫酸钙: C、向浓度均为和溶液中分别滴加浓的溶液,只有碳酸钠溶液产生白色沉淀 D、碳酸钠溶液和碳酸氢钠溶液都显碱性,均可用作食用碱
-
17、下列化学用语表示合理的是( )A、氮的基态原子的价电子排布图:
 B、异戊二烯的键线式为:
B、异戊二烯的键线式为: C、乙醛分子空间填充模型为:
C、乙醛分子空间填充模型为: D、中键的电子云轮廓图:
D、中键的电子云轮廓图:
-
18、下列常见物质中,不属于碱性氧化物的是( )A、 B、 C、 D、
-
19、高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺流程如下:

请回答下列问题:
(1)、写出向KOH溶液中通入足量Cl2发生反应的离子方程式 .(2)、在溶液I中加入KOH固体的目的是____(填编号).A、为下一步反应提供碱性的环境 B、使KClO3转化为KClO C、与溶液I中过量的Cl2继续反应,生成更多的KClO D、KOH固体溶解时会放出较多的热量,有利于提高反应速率(3)、从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3 , KCl,则反应③中发生的离子反应方程式为 . 每制得59.4克K2FeO4 , 理论上消耗氧化剂的物质的量为 mol.(4)、高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: + H2O= Fe(OH)3(胶体)+O2↑+OH﹣ . -
20、二氧化碳加氢制甲醇和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:
Ⅰ.CO2加氢选择合成甲醇的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1(298K)
②CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2(298K)
③CO(g)+2H2(g)⇌CH3OH(g)ΔH3(298K)
 (1)、在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓(ΔfHmθ)。
(1)、在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓(ΔfHmθ)。物质
H2(g)
O2(g)
CO(g)
CO2(g)
H2O(g)
CH3OH(g)
ΔfHmθ(kJ•mol﹣1)
0
0
﹣110.5
﹣393.5
﹣241.8
﹣201.2
有利于反应①自发进行的条件是 (填“高温”或“低温”),ΔH2(298K)=kJ•mol﹣1 , 有利于提高甲醇平衡产率的措施有 (至少回答2条)。
(2)、反应②的反应速率v=v正﹣v逆=k正c(CO2)c(H2)﹣k逆cm (CO)cn (H2O),其中k正、k逆分别为正、逆反应速率常数。该反应的平衡常数K= , 则m= , 升高温度时lgk正﹣lgk逆(填“增大”、“减小”或“不变”)。(3)、Ⅱ.甲烷重整工艺主要包括甲烷水蒸气重整制氢、甲烷部分氧化重整制氢、甲烷二氧化碳重整制氢、甲烷三重整制氢等。甲烷三重整制氢的逆反应3H2(g)+CO(g)⇌CH4(g)+H2O(g)。若将H2与CO按物质的量之比3:1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为x(CH4),在t=250℃条件下x(CH4)与p的关系、在p=5×105Pa条件下x(CH4)与t的关系如图a所示。当CO的平衡转化率为时,反应条件可能是 ;图a中能表示相同状态下、相同平衡状态的点是 。210℃时,甲烷三重整制氢反应的在该温度下,反应的标准平衡常数Kθ=[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)⇌gG(g)+hH(g),Kθ=
 , 其中pθ=100kPa,PG、PH、PD、PE为各组分的平衡分压]。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是 。(4)、同时进行甲烷与二氧化碳的重整反应制备合成气是当前的研究热点,反应为④CH4+CO2═2CO+2H2 , 该反应的Arrhenius经验公式实验数据如图b所示,已知Arrhenius经验公式Rlnk=﹣+C(Ea为活化能,k为速率常数,R和C为常数)。反应④的逆反应活化能为 kJ•mol﹣1。(用含“x1、y1、x2、y2”的式子表示)
, 其中pθ=100kPa,PG、PH、PD、PE为各组分的平衡分压]。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是 。(4)、同时进行甲烷与二氧化碳的重整反应制备合成气是当前的研究热点,反应为④CH4+CO2═2CO+2H2 , 该反应的Arrhenius经验公式实验数据如图b所示,已知Arrhenius经验公式Rlnk=﹣+C(Ea为活化能,k为速率常数,R和C为常数)。反应④的逆反应活化能为 kJ•mol﹣1。(用含“x1、y1、x2、y2”的式子表示)