-
1、二甲醚(DME)作为一种新兴的基本有机化工原料,在制药、燃料、农药等化学工业中有许多独特的用途,其制备方法有CO氢化法、氢化法、电化法等。回答下列问题:(1)、CO氢化法所涉及的反应如下:
反应i. ;
反应ii. ;
反应iii. 。
①反应iv。 , 利于该反应正向进行的条件是(填“高温”“低温”或“任意温度”)。
②将和充入密闭容器中仅发生反应iv,平衡体系中的物质的量分数与压强和温度的关系如图所示,关于温度和压强的关系判断正确的是(填字母)。

A. , B. ,
C. , D. ,
(2)、在某温度及压强为pMPa条件下,在密闭容器中按物质的量之比1:2充入、 , 发生反应 , 平衡时的转化率为50%。①达平衡时,MPa。
②该温度下,平衡常数 MPa-4(以平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
(3)、氢化法反应原理为反应v。 。在一定压强、和的起始投料一定的条件下,发生反应iii、反应v,实验测得平衡转化率和平衡时的选择性随温度的变化如图所示。
①的选择性 , 其中表示平衡时的选择性的是曲线(填“x”或“y”)。
②温度高于300℃时,曲线y随温度升高而升高的原因是。
③为同时提高的平衡转化率和平衡时的选择性,应选择的反应条件为(填字母)。
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
(4)、电化法工作原理如图所示:阴极电极反应式为 , 电解过程中右池溶液的质量(填“增大”“减少”或“不变”)。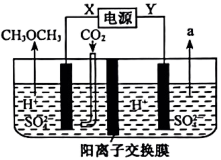
-
2、某工厂废渣的主要成分为ZnO、PbO、、CuO、等(与性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:

回答下列问题:
(1)、“焙烧”产生的气体是(填分子式),该气体的用途是(填一条),若发生反应,则转移(Bi元素转化为)。(2)、“氨浸”所得滤液1中的阳离子主要成分为、 , 该步骤温度不宜过高,其原因是 , “沉铜”时发生反应的离子方程式为。(3)、“滤渣4”的主要成分为(填化学式)。(4)、“滤液3”的主要溶质为 , 以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为。(5)、“转化”时生成的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为。(6)、铁酸铋具有铁电性和反铁磁性,其晶胞结构如图所示,晶胞参数为apm。
①基态O原子的核外电子排布式为。
②该晶体的密度=(为阿伏加德罗常数的值)。
-
3、氨基钠可用作有机合成的还原剂、脱水剂等。已知,i.几乎不溶于液氨,易与水、氧气等反应;ii.、、。回答下列问题:
I.制备氨基钠
 (1)、按气流从左往右的方向,上述装置合理的连接顺序为(填仪器接口字母,必要时个别装置可重复使用)。(2)、仪器x的名称为 , 装置A的作用为。(3)、装置B中制备的化学方程式为。(4)、的作用是 , 若装置D中生成1.12L(标准状况下) , 则消耗gNa。(5)、反应前装置D中需通入氨气排尽体系中空气,设计方案判断密闭体系中空气是否排尽:。(6)、II.氨基钠产品质量分数测定
(1)、按气流从左往右的方向,上述装置合理的连接顺序为(填仪器接口字母,必要时个别装置可重复使用)。(2)、仪器x的名称为 , 装置A的作用为。(3)、装置B中制备的化学方程式为。(4)、的作用是 , 若装置D中生成1.12L(标准状况下) , 则消耗gNa。(5)、反应前装置D中需通入氨气排尽体系中空气,设计方案判断密闭体系中空气是否排尽:。(6)、II.氨基钠产品质量分数测定称量2.0g氨基钠产品,溶于水配成500mL溶液;量取25mL溶液,加热除去 , 冷却至室温后,滴入2滴酚酞试液,用的HCl标准溶液进行滴定,记下达到滴定终点所消耗HCl标准溶液的体积,重复上述实验4次,滴定结果如下表。
实验数据
滴定次数
1
2
3
4
V(产品)/mL
25.00
25.00
25.00
25.00
V[HCl(标准溶液)]/mL
25.75
25.00
25.05
24.95
氨基钠的质量分数为%(保留三位有效数字)。
-
4、25℃条件下,改变亚碲酸[开始时,]溶液的pH,溶液中、、、的物质的量分数随pH的变化如图所示[已知]。下列说法错误的是( )
 A、 B、的平衡常数 C、时, D、溶液中:
A、 B、的平衡常数 C、时, D、溶液中: -
5、砷化镓是重要的半导体材料,用于制作微波集成电路、红外线发光二极管等元件,砷化镓立方晶胞结构如图所示,晶胞参数为apm。下列说法正确的是( )
 A、每个Ga周围距离最近的Ga原子个数为8 B、Ga原子与As原子的最短距离为 C、该晶胞的质量为(为阿伏加德罗常数的值) D、一个晶胞中含有4个As原子和14个Ga原子
A、每个Ga周围距离最近的Ga原子个数为8 B、Ga原子与As原子的最短距离为 C、该晶胞的质量为(为阿伏加德罗常数的值) D、一个晶胞中含有4个As原子和14个Ga原子 -
6、已知反应i. , 平衡常数;
ii. , 平衡常数;
iii. , 平衡常数 , 各反应的平衡常数的对数值随温度变化如图所示。下列说法正确的是( )
 A、反应i的 , 反应iii的 B、反应的 C、tK时,若反应ii中 , 则一定有 D、在恒容密闭容器中充入和进行反应iii,三点压强
A、反应i的 , 反应iii的 B、反应的 C、tK时,若反应ii中 , 则一定有 D、在恒容密闭容器中充入和进行反应iii,三点压强 -
7、一种捕获并将其转化为的反应历程如图所示。

下列说法正确的是( )
A、所有中间产物中均存在配位键 B、反应过程中N元素的化合价没变 C、 为催化剂
D、反应过程中存在非极性键的断裂和形成
为催化剂
D、反应过程中存在非极性键的断裂和形成
-
8、我国西沙群岛软珊瑚中存在多种朵蕾烷二萜类天然产物,结构如图所示,它们具有较强抗菌、抗肿瘤等生物活性。下列关于该二萜类化合物说法错误的是( )
 A、化合物I不属于芳香族化合物 B、化合物II能使的溶液褪色 C、化合物III不能发生水解反应 D、等物质的量的化合物I、II、III最多消耗的物质的量之比为2:2:3
A、化合物I不属于芳香族化合物 B、化合物II能使的溶液褪色 C、化合物III不能发生水解反应 D、等物质的量的化合物I、II、III最多消耗的物质的量之比为2:2:3 -
9、一种以钌矿石[主要含 , 还含少量的FeO、MgO、、CaO、]为原料制备钌(Ru)的工艺流程如图。

下列说法错误的是( )
A、“除镁”的离子方程式为 B、若“灼烧”时生成33.6L(标准状况下) , 则转移的电子数为 C、“酸浸”时,的作用是做还原剂,还原 D、从“滤液2”中可提取一种化肥,其电子式为
-
10、有机物M的结构简式如图所示。下列说法正确的是( )
 A、M的分子式为 B、M中含有三种官能团 C、1molM最多与5molH反应 D、M苯环上的二氯代物有6种(不考虑立体异构)
A、M的分子式为 B、M中含有三种官能团 C、1molM最多与5molH反应 D、M苯环上的二氯代物有6种(不考虑立体异构) -
11、锂电池中某阻燃剂的结构式如图所示,其中Y、Z、Q、W是原子序数依次增大的短周期主族元素,基态W原子核外能量不同的电子有3种,下列说法正确的是( )
 A、电负性: B、基态原子未成对电子数: C、原子半径: D、该化合物中各原子的最外层均满足8电子稳定结构
A、电负性: B、基态原子未成对电子数: C、原子半径: D、该化合物中各原子的最外层均满足8电子稳定结构 -
12、同时作为燃料和氧化剂的直接过氧化氢燃料电池(DPPFC)的工作原理如图所示(电解过程中溶液中溶质的种类不变且其质量减轻)。下列有关说法错误的是( )
 A、石墨1为负极,发生氧化反应 B、石墨2的电极反应式为 C、离子交换膜1、2分别为阴、阳离子交换膜 D、当外电路中转移时,溶液的质量减轻52.2g
A、石墨1为负极,发生氧化反应 B、石墨2的电极反应式为 C、离子交换膜1、2分别为阴、阳离子交换膜 D、当外电路中转移时,溶液的质量减轻52.2g -
13、下列实验操作、现象及得出的结论均正确的是( )
选项
实验操作、现象
实验结论
A
的溶液与的溶液等体积混合,产生白色沉淀
结合能力:
B
将补铁口服液(含维生素C)滴入酸性溶液,紫红色褪去
补铁口服液中含有
C
将久置的加入稀盐酸中,产生气泡
已经变质
D
取两份新制氯水,分别滴加溶液和淀粉-KI溶液,前者有白色沉淀,后者溶液变蓝
氯气与水的反应存在限度
A、A B、B C、C D、D -
14、制备(S呈+2价)的化学方程式为。下列说法正确的是( )A、参与反应,转移电子的数目为 B、25℃、101kPa条件下,的分子数为 C、由(
 )与(
)与( )组成的混合物中所含共价键的数目为
D、常温下,1LpH为5的溶液中,由水电离出的数目为
)组成的混合物中所含共价键的数目为
D、常温下,1LpH为5的溶液中,由水电离出的数目为
-
15、下列实验装置(夹持仪器已省略)及操作合理且能达到实验目的的是( )
 A、用装置甲制备 B、用装置乙测定醋酸浓度 C、用装置丙制备并收集 D、用装置丁比较和的热稳定性
A、用装置甲制备 B、用装置乙测定醋酸浓度 C、用装置丙制备并收集 D、用装置丁比较和的热稳定性 -
16、下列化学用语正确的是( )A、的电子式:
 B、HClO分子的VSEPR模型:直线形
C、2-丙醇的结构简式:
B、HClO分子的VSEPR模型:直线形
C、2-丙醇的结构简式: D、基态铜原子价层电子轨道表示式:
D、基态铜原子价层电子轨道表示式:
-
17、化学在人类卫生保健中有着极为重要的作用。下列说法错误的是( )A、用于给环境消毒的84消毒液的有效成分是NaClO B、用于生产医用口罩的聚丙烯可使酸性溶液褪色 C、用于配制免洗洗手液的过氧乙酸能使蛋白质变性 D、用酒精溶液消毒时,75%的酒精溶液消毒效果最好
-
18、有机物K是合成药物尿多灵的中间体。一种以芳香族化合物为原料合成K的路线如图所示。

已知:

回答下列问题:
(1)、G的名称为;K中含有的官能团名称为。(2)、B→C的反应试剂条件是。(3)、写出D→F的化学方程式: , 反应类型为。(4)、F的同分异构体有多种,满足下列条件的有种(不含立体异构)。①与溶液发生显色反应;
②能发生水解反应和银镜反应;
③属于芳香族化合物且只有一个环状结构。
其中核磁共振氢谱有6组峰且峰面积之比为的有机物结构简式为。
(5)、根据流程,写出以甲醇和丙酮为原料,制备叔丁醇( )的合成路线:。
)的合成路线:。 -
19、为了实现“碳中和”,的综合利用成为科学家研究的热点。(1)、将催化加氢制取 , 通过下列步骤实现,反应过程中能量变化如图1所示。

。
(2)、在的绝热密闭容器中,按充入和 , 在催化剂作用下合成甲醇。下列说法中说明主反应达到平衡状态的是____(填字母)。A、的转化率保持不变 B、混合气体的密度保持不变 C、断裂键同时形成键 D、容器内混合气体温度保持不变(3)、在密闭容器中通入和的混合气体,制取甲醇过程中,存在竞争反应:. ;
. 。
在不同压强下,当按进料,反应达到平衡时,测得甲醇的物质的量分数与温度的关系如图2所示物质ⅰ的物质的量分数:)

①图2中压强由小到大的顺序为 , 判断的依据是。
②图2中,当、发生上述反应,反应达到平衡时, , 则在内用的分压变化表示的速率 , 此时反应I中的转化率为(保留小数点后1位)。
③在压强为时,发生上述反应并达到平衡状态,平衡转化率为 , , 该温度下反应的平衡常数(保留1位有效数字,用各组分的分压代替浓度计算平衡常数 , 气体分压=总压×物质的量分数)。
-
20、四氧化三铁俗称磁性氧化铁,常用于制造录音磁带和电讯器材,也可作颜料和抛光剂。某工厂以硫铁矿烧渣(主要含有等元素的氧化物及)为原料,制备的工艺流程如图所示。

已知:常温下,、、。
回答下列问题:
(1)、“酸溶”硫铁矿烧渣时,为了加快酸溶速率可采取的措施有(任写两条)。(2)、料渣1的主要成分有(填化学式)。(3)、常温下,已知溶液中 , 要使沉淀完全,则“调”的范围是(保留2位有效数字,一般离子浓度认为沉淀完全)。(4)、加入“沉铁”时,发生反应的离子方程式为。(5)、①“煅烧1”的目的是将转化为 , 若“煅烧2”阶段发生反应时 , 则该反应的化学方程式为。②“煅烧2”时温度对的纯度有很大影响。已知温度对纯度的影响如图1所示,则“煅烧2”时,温度最好控制在。
 (6)、一种铁基超导材料(化学式为)的晶胞如图2所示。已知:该晶胞底边边长为 , 高为 , 1号原子的高为。为阿伏加德罗常数的值。
(6)、一种铁基超导材料(化学式为)的晶胞如图2所示。已知:该晶胞底边边长为 , 高为 , 1号原子的高为。为阿伏加德罗常数的值。
①该晶胞中,原子的个数之比为;距2号原子最近的铁有个。
②该晶体的密度为 , 1号原子的坐标为。