-
1、铁氰化钾()是一种氰配合物,易溶于水,可检验。某研究性学习小组拟制备铁氰化钾并探究其性质。(1)、制备铁氰化钾。用氧化制备 , 装置如图所示。
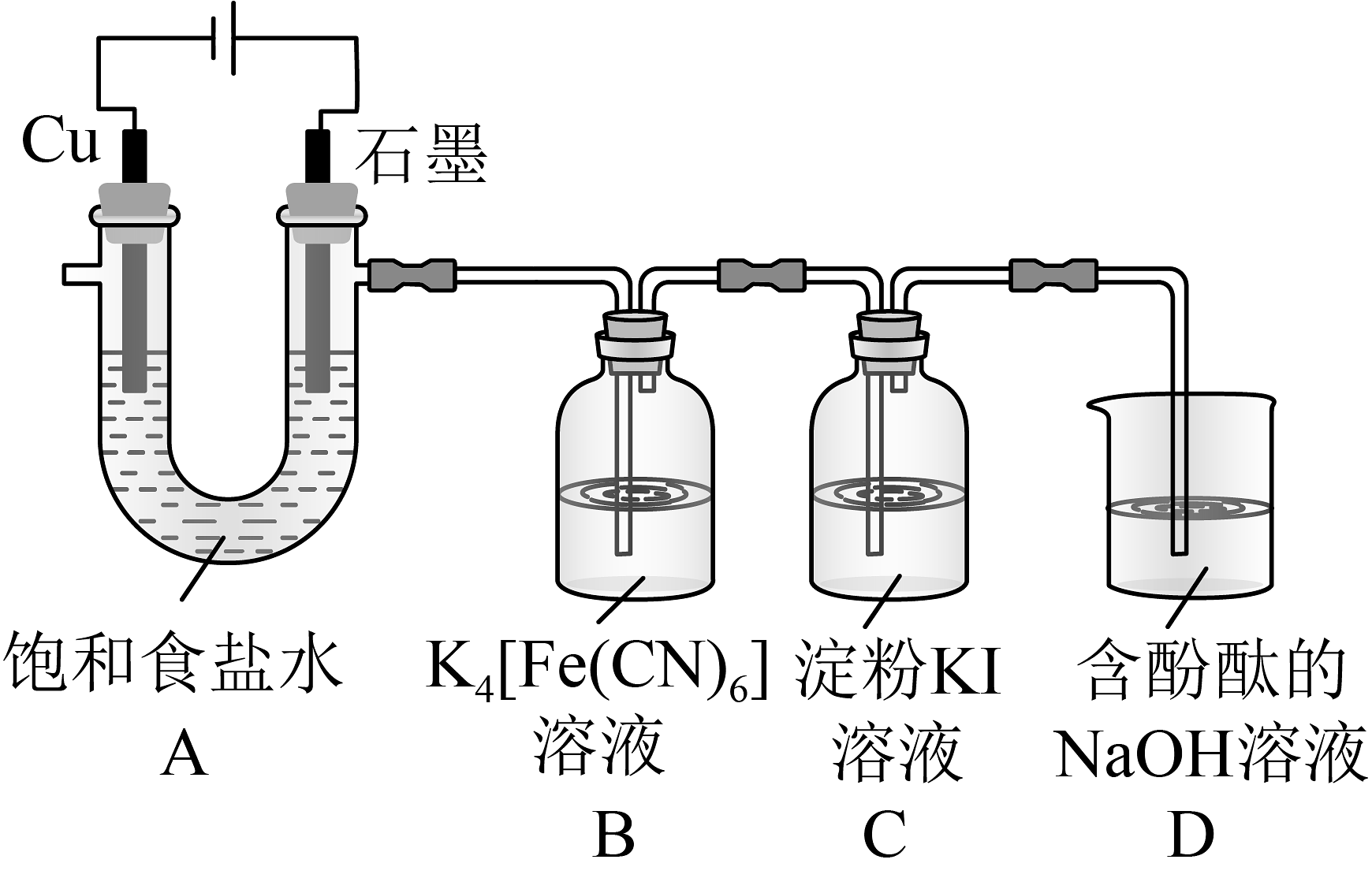
①装置A中Cu电极上的电极反应为。实验测得石墨电极上生成的体积小于Cu电极上生成气体的体积,其原因可能是。
②装置B中发生反应的化学反应方程式为。
(2)、探究铁氰化钾的性质。查阅资料,提出猜想:猜想1:具有氧化性;
猜想2:溶液中存在化学平衡。
设计如下实验展开探究(本实验所用蒸馏水均已除氧:已知)。
实验
实验操作
实验现象
Ⅰ
向2mL饱和KI溶液中滴加5~6滴溶液,振荡,再滴加几滴淀粉溶液
无明显现象
Ⅱ
向2mL溶液中滴加5~6滴饱和KI溶液,振荡,再滴加几滴淀粉溶液
溶液变成蓝色
Ⅲ
溶液中滴入几滴KSCN溶液,再向溶液中加入少量浓盐酸
滴入KSCN溶液,无明显现象,加入盐酸后,溶液变红
Ⅳ
向浓度均为、的混合溶液中放入一根无锈铁丝
产生蓝色沉淀
Ⅴ
向溶液中放入一根无锈铁丝(与实验Ⅳ铁丝相同)
产生蓝色沉淀
①铁氰化钾晶体中各种微粒间的相互作用不包括(填编号)。
a.离子键 b.共价键 c.配位键
d.金属键 e.键 f.范德华力
②实验Ⅱ可以证明猜想1成立。实验Ⅰ中滴加淀粉溶液后不变蓝的原因可能是。
③利用平衡移动原理解释实验Ⅲ中加入浓盐酸后溶液变为红色的原因:。
④由实验Ⅲ、Ⅳ、Ⅴ的信息,小组同学认为猜想2成立。实验Ⅳ、Ⅴ中判断猜想2成立的依据是。
(3)、铁氰化钾可用于测定硫酸钴晶体中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液mL。反应的方程式为。样品中钴的含量(以钴的质量分数ω计)(4)、铁盐或亚铁盐应用广泛,写出其中一种的化学式并写出该盐的一种用途。 -
2、1,3-丁二烯与HBr发生加成反应机理如图。反应Ⅰ和反应Ⅱ都经过同一中间体,进一步发生基元反应②和基元反应③得到两种不同的加成产物。下列说法错误的是
 A、基元反应①△H>0,基元反应②△H<0 B、基元反应③相对于基元反应②为慢反应 C、同一条件下,反应Ⅱ的倾向性比反应Ⅰ的倾向性大 D、反应过程中,升高温度,1,2-加成产物的产率明显增加
A、基元反应①△H>0,基元反应②△H<0 B、基元反应③相对于基元反应②为慢反应 C、同一条件下,反应Ⅱ的倾向性比反应Ⅰ的倾向性大 D、反应过程中,升高温度,1,2-加成产物的产率明显增加 -
3、下列方案设计、现象和结论均正确且具有因果关系的是
选项
方案设计
现象和结论
A
室温下,用pH计测定0.1mol/L的、两种溶液的pH
溶液的pH较大,则电负性:F>Cl
B
向盛有0.2mol/L溶液的试管中加入0.1mol/L的溶液
试管口出现红棕色气体,则被还原为
C
将注射器充满气体,再往里推活塞压缩体积
气体颜色加深,则加压平衡向生成气体的方向移动
D
2mL0.1mol·L-¹的溶液中滴加2滴同浓度NaOH的溶液,再滴加4滴同浓度的
白色沉淀转化为红褐色沉淀,则
A、A B、B C、C D、D -
4、X原子不含中子,Y元素位于第四周期且基态原子中有5个未成对电子,基态W原子的s能级与p能级的电子总数相等,ZW与氮气分子具有相同的电子数,四种元素形成的配合物XY(ZW)5、结构如下图所示。下列说法不正确的是
 A、电负性:W>Z>X>Y B、简单氢化物的沸点:W>Z C、同周期中第一电离能大于W的有3种 D、和的空间结构均为三角锥形
A、电负性:W>Z>X>Y B、简单氢化物的沸点:W>Z C、同周期中第一电离能大于W的有3种 D、和的空间结构均为三角锥形 -
5、以黄铜矿(主要成分为 , 能导电)为原料,用(溶液作浸取剂提取的原理示意图如下。(结构式为
 )下列说法正确的是
)下列说法正确的是 A、中O全部为-2价 B、负极的电极反应式为: C、一段时间后,的浸出速率显著变小,可能是致密硫膜阻碍了电子转移 D、溶解黄铜矿反应的离子方程式为:
A、中O全部为-2价 B、负极的电极反应式为: C、一段时间后,的浸出速率显著变小,可能是致密硫膜阻碍了电子转移 D、溶解黄铜矿反应的离子方程式为: -
6、表示阿伏加德罗常数的值,有关反应的叙述正确的是A、1LpH=1的溶液中含有的数目为 B、1mol与足量NaOH溶液反应转移电子数为 C、标准状况下,22.4L与充分反应,生成物的分子数为 D、1mol与足量NaOH溶液反应, 所得溶液中数为
-
7、宏观辨识与微观探析是化学学科核心素养之一,下列离子方程式能完全表示相应事实的是A、向溶液中滴加过量的氨水: B、将还原性铁粉加入过量的稀硝酸中: C、向溶液中加入溶液: D、模拟侯氏制碱法制备晶体:
-
8、以石墨为电极材料,按如图装置进行实验,关闭K后,反应开始。下列说法错误的是
 A、石墨电极A为正极,电极附近溶液颜色逐渐变浅 B、a中产生白色沉淀,溶液中、均减小 C、b中溶液先变蓝,后褪色,体现了的氧化性 D、M换用阴离子交换膜,化学能转化为电能效率降低
A、石墨电极A为正极,电极附近溶液颜色逐渐变浅 B、a中产生白色沉淀,溶液中、均减小 C、b中溶液先变蓝,后褪色,体现了的氧化性 D、M换用阴离子交换膜,化学能转化为电能效率降低 -
9、四环素(如图)是一种广谱抗生素,临床主要用于肺炎、百日咳等。关于该有机物的说法中不正确的是
 A、属于芳香族化合物 B、能与发生取代反应和加成反应 C、能与溶液反应生成 D、既能与强酸反应,又能与强碱反应
A、属于芳香族化合物 B、能与发生取代反应和加成反应 C、能与溶液反应生成 D、既能与强酸反应,又能与强碱反应 -
10、部分含氮、硫物质的分类与相应化合价关系如图所示。下列推断不合理的是
 A、e的浓溶液具有强氧化性,不能干燥气体c B、部分食品中添加适量c可起漂白、防腐和抗氧化等作用 C、将c和h同时通入到溶液中会产生白色沉淀 D、g和f可以通过催化转化生成无毒气体
A、e的浓溶液具有强氧化性,不能干燥气体c B、部分食品中添加适量c可起漂白、防腐和抗氧化等作用 C、将c和h同时通入到溶液中会产生白色沉淀 D、g和f可以通过催化转化生成无毒气体 -
11、劳动开创未来,成就梦想。下列劳动项目和涉及的化学知识描述正确的是
选项
劳动项目
化学知识
A
帮厨活动:用草木灰和生石灰等制作松花蛋
蛋白质在碱性环境中发生盐析
B
家务劳动:用热的纯碱溶液去除衣服上的油污
的水溶液具有碱性
C
学农活动:将糯米蒸煮后加入酒曲酿制成米酒
葡萄糖在酵母菌作用下水解成乙醇
D
社区服务:演示用泡沫灭火器灭火
盐酸与小苏打反应产生大量
A、A B、B C、C D、D -
12、化学是一门以实验为基础的科学,下列有关实验药品、装置或操作合理的是


A.用于制备氯气
B.测定盐酸物质的量浓度

C.蒸干溶液制备
D.配制溶液时转移溶液
A、A B、B C、C D、D -
13、化学与人类生活、科技、社会密切相关。下列新闻事件的解读正确的是
选项
新闻事件
化学解读
A
长征二号F遥十三运载火箭使用“偏二甲肼和”作推进剂
起氧化剂作用
B
化妆护肤品中常添加少量吸水性强的丙二醇
丙二醇是乙醇的同系物
C
速滑馆的冰面是采用超临界流体跨临界直冷制冰技术打造
跨临界直冷制冰技术是化学变化
D
科学家发现多层魔角石墨烯形成稳健超导性
石墨烯是有机高分子材料
A、A B、B C、C D、D -
14、化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是A、“尿不湿”中的高吸水性树脂,其主要成分聚丙烯酸钠属于天然有机高分子 B、2023年诺贝尔化学奖授予量子点研究,直径为2~20nm的硅量子点属于胶体 C、“煤制烯烃大型现代煤化工成套技术开发及应用”中煤的气化属于物理变化 D、“玉兔二号”月球车首次实现在月球背面着陆,其太阳能电池帆板的主要材料是硅
-
15、广东省博物馆集结了岭南文化的精髓,囊括历史、艺术、革命、与自然的多元魅力。下列文物主要成分属于无机非金属材料的是


A.新石器时代三足陶盘
B.西周兽面纹青铜岙


C.明雪梅双鹤图
D.潮汕百鸟朝凤木雕
A、A B、B C、C D、D -
16、某课题组设计合成一种多元酸内酯X,合成路线如下:

已知:①

②Cope重排反应:

请回答:
(1)、写出F中含有官能团的名称。(2)、写出D的结构简式。(3)、下列说法正确的是_______。A、A→B和D→E均经历Cope重排 B、化合物X的分子式为:C13H18O8 C、化合物C中含有4个手性碳原子 D、B→C的反应类型为取代反应(4)、写出G→X的化学反应方程式。(5)、写出4种同时符合下列条件的化合物C的同分异构体的结构简式(不包括立体异构体)。①含有1个六元环(不含其他环结构)
②1H-NMR谱和IR谱检测表明:分子中共有5种不同化学环境的氢原子,含碳氧双键。
(6)、以化合物 和
和 为原料,设计合成
为原料,设计合成 的路线(用流程图表示,无机试剂、有机溶剂任选)。
的路线(用流程图表示,无机试剂、有机溶剂任选)。 -
17、醋酸亚铬水合物{(相对分子质量376)}是常用的氧气吸收剂,为深红色晶体,难溶于冷水和乙醚,微溶于乙醇。实验室制备醋酸亚铬水合物的装置如图所示,涉及的部分化学方程式如下:

①
②
③
实验步骤:
①配制实验所需溶液。
②如图连接好仪器,检查装置气密性。
③在仪器2中放入6.34gCrCl3、7.50g锌丝,仪器3中放入冷的醋酸钠溶液,仪器4中放入试剂X。
④在仪器1中放入35.00mL6.00mol/L盐酸。
⑤……
⑥抽滤、洗涤和干燥,获得晶体。
请回答:
(1)、仪器1的名称为。(2)、仪器4所放的试剂X的作用是。(3)、下列说法正确的是_______。A、本实验中所有配制溶液的水都需要用去氧水 B、实验所用的醋酸钠溶液的浓度尽可能大 C、步骤⑥抽滤操作需要在通风橱中进行 D、步骤⑥为洗涤产品,可先用冷水洗,后用乙醚洗(4)、实验中须控制Zn过量,其目的有。(5)、步骤⑤中,涉及的操作如下,请按操作的先后顺序进行排序: , 装置3中有红色晶体析出。_______→_______→e→_______→_______
a.打开止水夹A b.打开止水夹B c.关闭止水夹A d.关闭止水夹B
e.打开仪器1的旋塞,向仪器2中加入盐酸反应一段时间
(6)、最后获得的醋酸亚铬水合物产品质量为5.64g,则产品的产率为(结果保留三位有效数字)。 -
18、煤燃烧过程中会产生大气污染物CO、NO,研究氮氧化物的消除和CO2资源再利用是目前研究的热点之一。(1)、用惰性电极(Pt)电解CO2吸收液(假设溶液成分为饱和NaHCO3溶液),阴极区通入CO2可以制得HCOONa,请写出阴极的电解电极方程式。(2)、已知: , CO、NO在铁催化剂表面进行如下两步反应:
反应I:
反应II:
①反应自发进行的条件为:。
②完成反应I的化学方程式:。
(3)、某课题组为研究CO存在下铁对NO的催化还原反应,设计了三组对照实验。分别如下:第1、2组将等量的Fe置于石英管内,通入N2吹扫约10min,然后分别通入一定量NO或NO和CO混合气体后,两端密封开始加热升温,测NO的转化率;第3组与第2组其它条件相同,但没有Fe参与实验,测NO的转化率,得出结果如图。
①下列说法正确的是。
A.其他条件不变时,用空气替代N2 , 对实验结果有影响
B.当体系中CO和CO2的物质的量浓度相等时,反应达到平衡状态
C.增加铁的质量和表面积,能降低该反应的活化能,提高反应速率,提高NO的平衡转化率
D.当温度小于750K,铁在NO、CO反应系统中,以Fe、NO的气固异相反应为主
②请解释图1中750K后曲线1、2变化趋势不同的原因:。
③若该反应的正、逆反应速率可表示为、 , 、分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1L的容器中加入2molNO和2.2molCO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图所示。已知该温度下K=27/20,则a点时。(结果保留两位有效数字)

-
19、固态化合物M的组成为CuSi2O5 , 以M为原料实现如下转化:

已知:a.固体X由两种氧化物组成,质量与M相同;b.CuAlO2难溶于水
(1)、①固体D的成分为 , 溶液E中含氮微粒有。②写出反应Ⅱ的化学反应方程式。
③溶液F加热可得纳米 , 过程中pH会明显下降,原因是。
(2)、下列说法正确的是_______。A、反应Ⅰ不能在陶瓷坩埚中进行 B、固体X可溶于浓氨水 C、溶液A经净化处理后可用于工业粘合剂 D、反应Ⅲ中发生的离子反应有:(3)、已知能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验。 -
20、卤素单质及其化合物在科研和工农业生产中有着广泛的应用。请回答:(1)、基态F原子核外电子的空间运动状态有种。下列属于氯原子激发态且能量较低的是。(填标号)
a. b.
c. d.
(2)、下列说法不正确的是_______A、熔点 B、化学键中离子键成分的百分数 C、第三电离能: D、与中心原子的杂化方式相同(3)、固态氟化氢中存在形式,画出的链状结构。(4)、已知键能: , 请说明理由:。(5)、已知某晶体的结构,其晶胞中阴离子(阳离子未画出)的位置如图1所示,其晶胞中的阳离子(隐去阴离子)在xz、yz和xy平面投影均如图2所示。
则
①其化学式为;
②每个的配位数(紧邻的F原子数)为。