-
1、下列实验方法能达到实验目的的是A、用加热的方法除去固体中混有的 B、用NaOH溶液除去氧化铁中混有的氧化铝 C、用溶液除去中的HCl D、用饱和食盐水吸收尾气中的
-
2、阅读下列信息,完成下列小题:
现实验室准备用NaOH固体配制100mL、的NaOH溶液。
(1)、下图所示的仪器中,不是实验中必须使用的是A、 B、
B、 C、
C、 D、
D、 (2)、下列情况或操作会使所配溶液浓度偏高的是A、NaOH已部分变质 B、容量瓶使用前未完全干燥 C、转移溶解后的NaOH溶液及定容时,未等溶液冷却 D、转移溶解后的NaOH溶液时,部分溶液洒落
(2)、下列情况或操作会使所配溶液浓度偏高的是A、NaOH已部分变质 B、容量瓶使用前未完全干燥 C、转移溶解后的NaOH溶液及定容时,未等溶液冷却 D、转移溶解后的NaOH溶液时,部分溶液洒落 -
3、下列反应所对应的离子方程式正确的是A、氯气通入水中: B、氯化铁溶液腐蚀铜线路板: C、稀硫酸中滴加溶液: D、NaOH溶液中通入过量
-
4、下列指定条件下的物质转化能够实现的是A、 B、 C、 D、
-
5、下列反应可用离子方程式表示的是A、碳酸钙和盐酸反应 B、碳酸钠和硫酸反应 C、碳酸氢钠与硝酸反应 D、碳酸钾和醋酸反应
-
6、常温常压,含有相同分子数的和 , 体积相同的原因是A、该条件下和的质量相同 B、该条件下和的密度相同 C、该条件下分子间距离相同 D、该条件下和分子的大小相同
-
7、关于常温常压下,0.1molHCl气体,下列说法不正确的是A、约含个HCl分子 B、质量为3.65g C、体积为2.24L D、溶于水配成100mL溶液,则HCl的物质的量浓度为
-
8、实验室用下列装置制取、净化、收集并验证氯水呈酸性,能达到实验目的的是




A
B
C
D
A、制备 B、干燥 C、收集 D、验证氯水的酸性 -
9、下图所示为Cr元素的部分化合物的转化图。下列说法不正确的是
 A、转化①可以加入NaOH溶液实现 B、转化②可以加入盐酸实现 C、转化③需要加入氧化剂才能实现 D、转化④中发生还原反应
A、转化①可以加入NaOH溶液实现 B、转化②可以加入盐酸实现 C、转化③需要加入氧化剂才能实现 D、转化④中发生还原反应 -
10、工业上炼铁中含有下列反应,其中不属于氧化还原反应的是A、 B、 C、 D、
-
11、下列不属于碱的通性的是A、能与酸反应生成盐和水 B、能与酸性氧化物反应生成盐和水 C、能与活泼金属反应生成 D、能与某些盐反应生成新的碱和新的盐
-
12、下列物质的性质与用途具有对应关系的是A、氧化铝能溶于酸,可用于制作耐磨材料 B、碳酸氢钠呈碱性,可用于焙制糕点 C、铁粉可与氧气反应,可用作食品脱氧剂 D、氧化铁熔点高,可用于制红色颜料
-
13、向绿矾溶液中滴加过量新制氯水,充分反应后溶液中不能大量存在的离子是A、 B、 C、 D、
-
14、下列有关钠及其化合物的说法正确的是A、金属活动性: B、的结构示意图:
 C、中Na的化合价为
D、的电离方程式:
C、中Na的化合价为
D、的电离方程式:
-
15、发射神舟飞船的火箭箭体使用的是某种铝合金材料。下列不属于火箭箭体所用铝合金材料特点的是A、强度高 B、密度大 C、延展性好 D、耐腐蚀
-
16、下列关于碱金属元素和卤族元素的说法错误的是A、由于钠和钾的原子结构极为相似,所以它们对应的碱都是强碱 B、通过钠与钾分别与水反应的剧烈程度可知,碱金属元素原子半径越大,失电子能力越强 C、碱金属元素的单质在氧气中燃烧均生成过氧化物 D、通过卤素单质与氢气反应所需要的反应条件难易,可以判断氯的非金属性比溴强
-
17、实验室制备氯气的方法有多种,下列说法错误的是A、KClO3与浓盐酸制备Cl2时,盐酸既表现酸性又表现还原性 B、Ca(ClO)2与浓盐酸制备Cl2时,Cl2既是氧化产物又是还原产物 C、KMnO4、Ca(ClO)2分别与浓盐酸反应,产生等量Cl2时转移电子数也相同 D、KMnO4和浓盐酸制备Cl2无需加热,因此不能用盐酸来酸化KMnO4溶液
-
18、
常温下,某小组同学用如图装置探究的沉淀溶解平衡。
实验装置
实验序号
传感器种类
实验操作
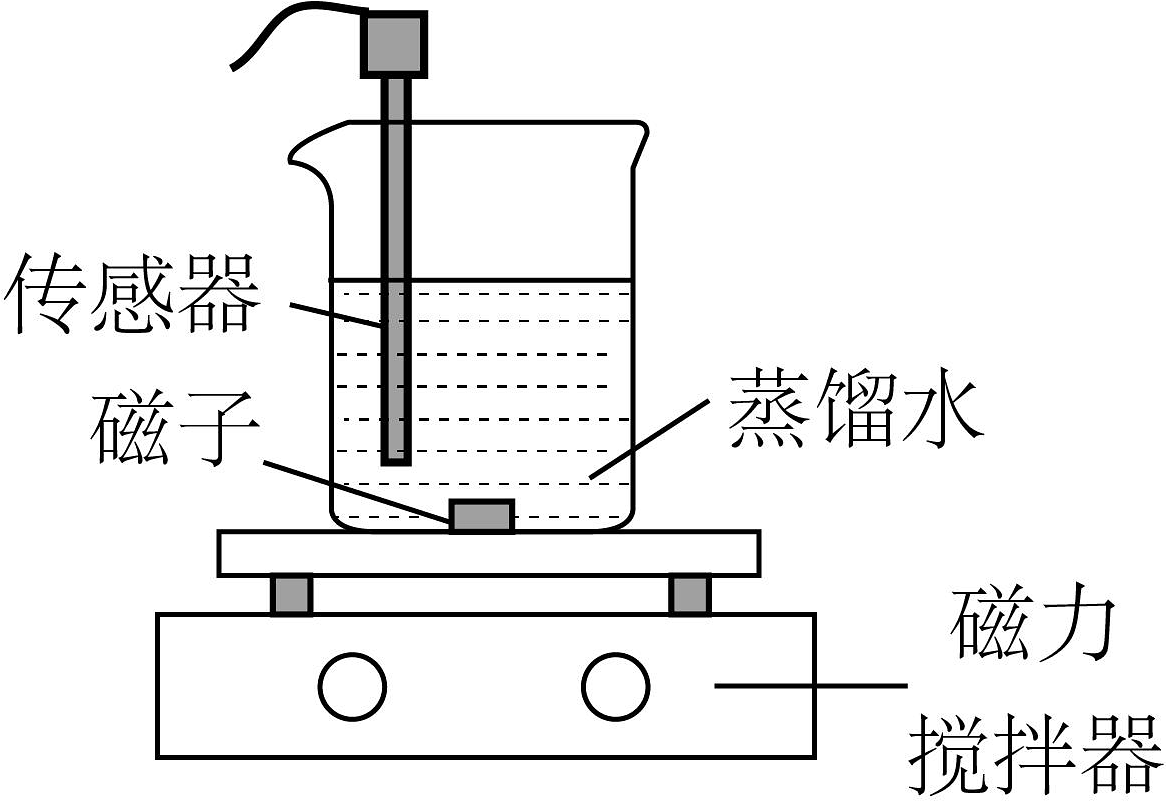
①
电导率传感器
向蒸馏水中加入足量粉末,一段时间后,再向所得悬浊液中加入少量蒸馏水
②
传感器
向滴有酚酞溶液的蒸馏水中加入足量粉末,一段时间后,再向所得悬浊液中加入一定量稀硫酸,一段时间后,仍存在粉末
Ⅰ.实验①测得电导率随时间变化的曲线如图1所示。
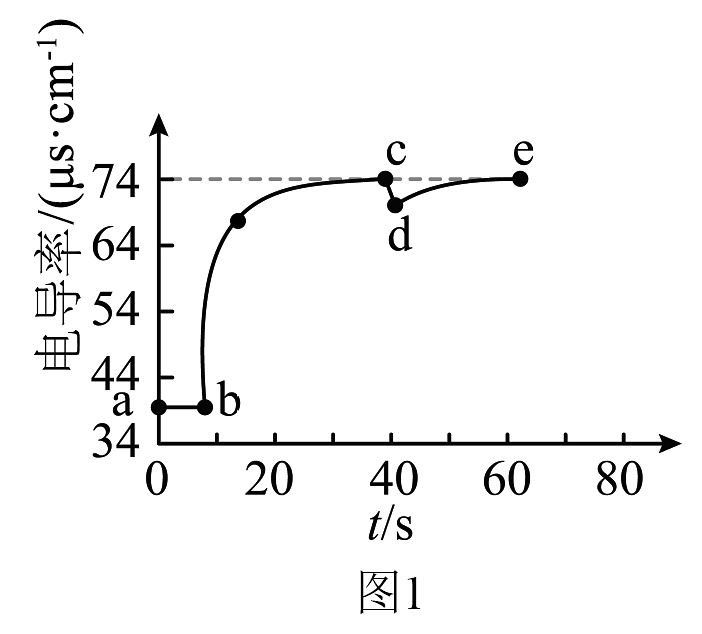
已知:在稀溶液中,离子浓度越大,电导率越大。
(1)点电导率不等于0的原因是。
(2)由图1可知,在悬浊液中再加入少量蒸馏水的时刻为(填“”“”或“”)点。
(3)分析电导率在段逐渐上升的原因:时刻,(填“>”“<”或“=”) , 导致。
Ⅱ.实验②测得随时间变化的曲线如图2所示。
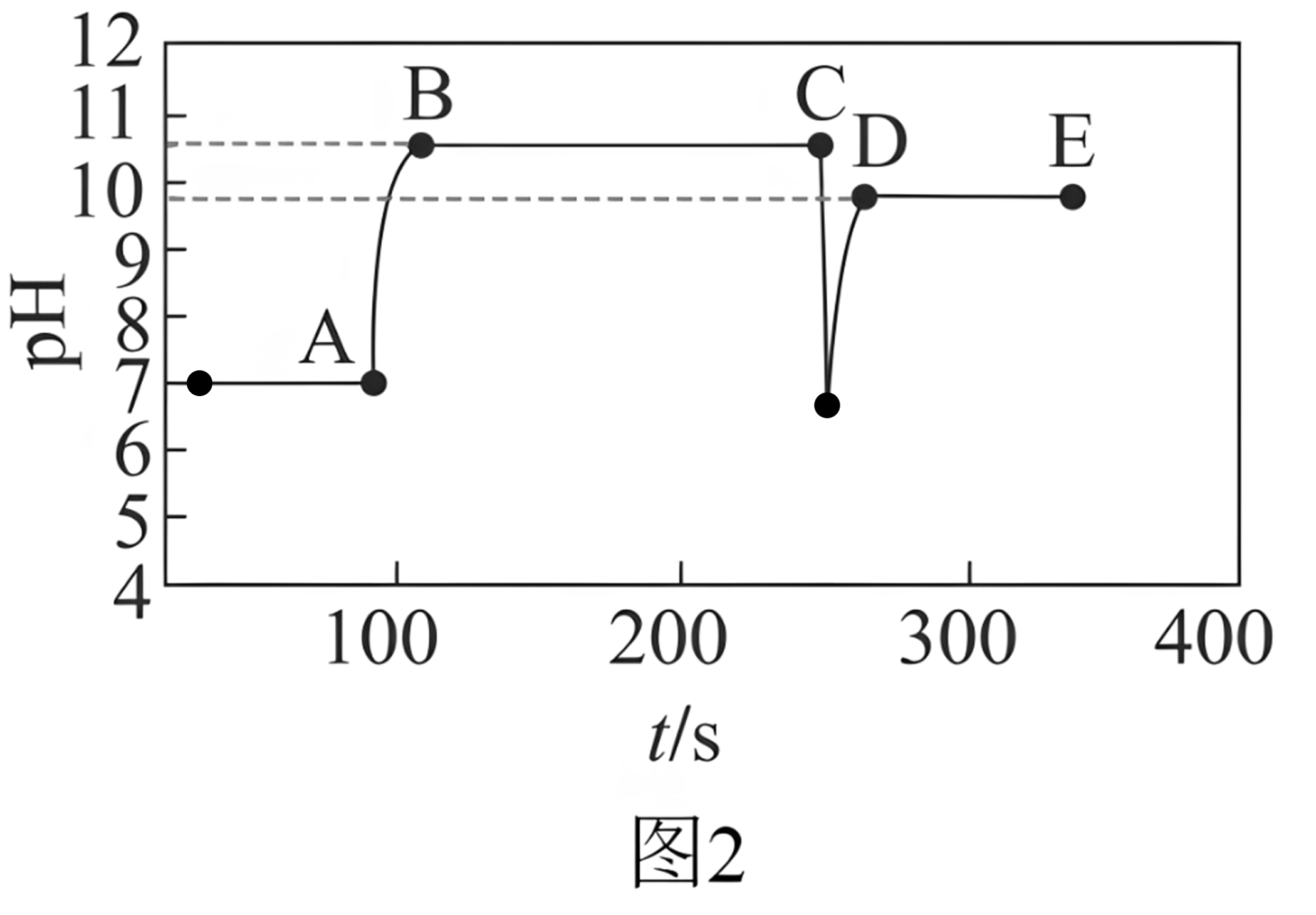
已知:①25℃时,;
②酚酞变色范围如下表:
颜色
无色
淡粉色
红色
(4)实验②过程中,溶液颜色变化:先变红,。
(5)图2中段低于段的原因是。
(6)常被用于改良水质,可调节水体 , 进而抑制细菌的生长。25℃且水体时,水体中为。
-
19、工业上以软锰矿(主要成分为 , 还含有少量的、、等)为原料制取金属锰的工艺流程如图所示。

已知:ⅰ.经检验浸取液中不存在。
ⅱ.部分金属离子形成氢氧化物沉淀时的如下表:
金属离子
开始沉淀的
6.8
1.8
3.7
8.6
沉淀完全的
8.3
2.8
4.7
10.1
ⅲ.25℃时,的电离常数、 , , 。
(1)、软锰矿“粉磨”的目的是。(2)、写出“浸出”过程中参与反应的离子方程式:。(3)、“浸渣”的主要成分是(填化学式)。(4)、“除杂”反应中的最佳选择是(填标号)。a. b. c.
(5)、“除杂”时,调节溶液的范围为。(6)、写出“沉锰”操作中发生反应的离子方程式:。(7)、在废水处理中常用将转化为除去,向含有的废水中通入一定量的气体,调节溶液的 , 当时,开始沉淀,则。往悬浊液中滴加过量饱和溶液,写出反应的离子方程式:。 -
20、和的高效利用不仅能缓解大气变暖,对日益枯竭的石油资源也有一定的补充作用。临氧耦合重整的反应有:
反应Ⅰ:
反应Ⅱ:
(1)、写出表示燃烧热的热化学方程式:。(2)、在两个体积均为的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应Ⅱ:(不发生其他反应),的平衡转化率如表所示。容器
起始物质的量/
的平衡转化率
X
0.1
0.1
0
0
Y
0.1
0.1
0.2
0.2
-
①下列条件能说明反应达到平衡状态的是(填标号)。
A.
B.容器内各物质的浓度满足
C.容器内混合气体的总压强不再变化
D.容器内混合气体的密度保持不变
②达到平衡时,容器X、Y内的物质的量关系满足(填“>”“<”或“=”)。
(3)、还可以通过催化加氢合成乙醇: 。设[]为起始时的投料比。通过实验得到下列图像: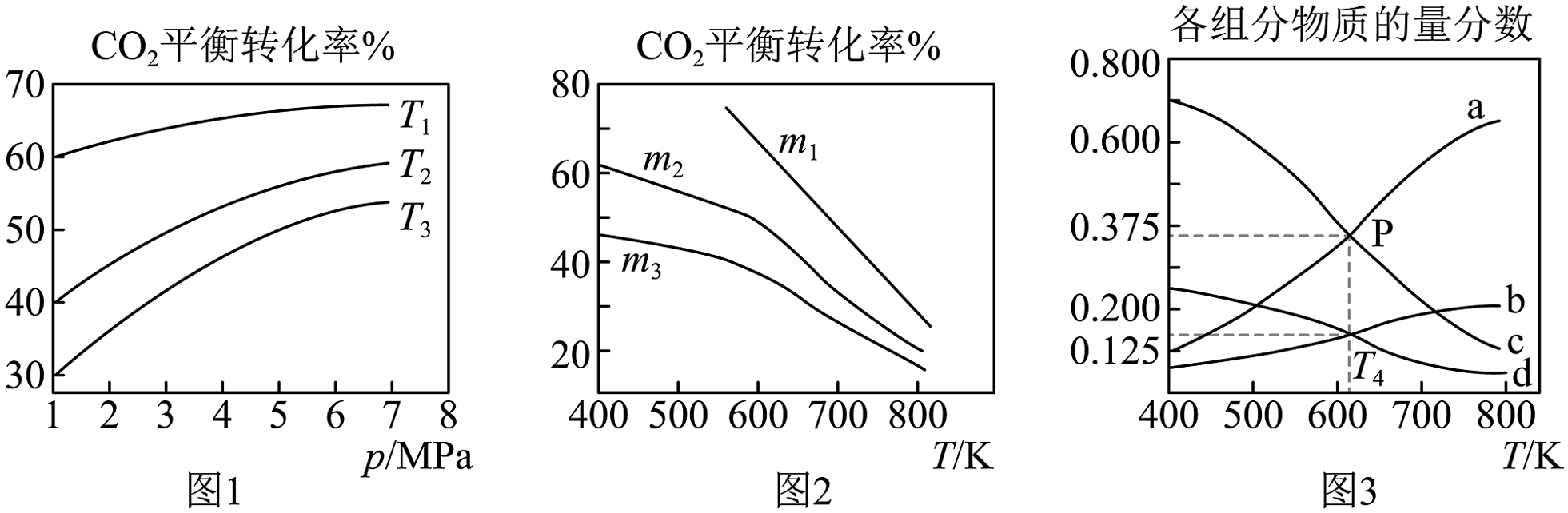
①若图1中相等,则温度从高到低的排序为 , 原因是。
②图2中、、从大到小的排序为。
③图3表示在总压为的恒压条件下,时,平衡状态下各组分的物质的量分数与温度的关系,则曲线表示的是(填化学式)的物质的量分数。下,该反应压强平衡常数的计算式为(用平衡分压代替平衡浓度计算,分压总压物质的量分数,代入数据,不用化简)。