-
1、CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液形成 , 不溶于乙醇,在空气中易被氧化。某小组使用如下装置制备。
 (1)、图1中用来盛放溶液的仪器名称为。(2)、用固体配制溶液时,需称量的固体质量为g。(3)、上述制备反应进行一段时间后,溶液pH约为4,写出该过程发生的离子方程式。(4)、反应过程中,和NaCl的用量对CuCl产率的影响如下图3所示:
(1)、图1中用来盛放溶液的仪器名称为。(2)、用固体配制溶液时,需称量的固体质量为g。(3)、上述制备反应进行一段时间后,溶液pH约为4,写出该过程发生的离子方程式。(4)、反应过程中,和NaCl的用量对CuCl产率的影响如下图3所示:
当时,CuCl产率先升高后降低,其降低的原因是。
(5)、用“醇洗”可快速去除滤渣表面的水分,防止滤渣被空气氧化为被氧化为的化学方程式为。(6)、为获得较高产率的CuCl,请补充实验方案:向三颈烧瓶中加入溶液, , 得CuCl固体。(实验须使用的试剂或装置:溶液,溶液,溶液,蒸馏水,无水乙醇,真空干燥箱) -
2、伐尼克兰(F)是戒烟辅助药物,其合成路线如下:
 (1)、B中的官能团名称为。(2)、过程中以为催化剂。酸性强于 , 其原因是:;过程中,以浓硫酸为催化剂时可能发生副反应,请写出其中一种副产物的结构简式:。(3)、过程中经历 , 已知分子式为的反应类型为。(4)、请写出一种满足以下条件的链状化合物的结构简式:。
(1)、B中的官能团名称为。(2)、过程中以为催化剂。酸性强于 , 其原因是:;过程中,以浓硫酸为催化剂时可能发生副反应,请写出其中一种副产物的结构简式:。(3)、过程中经历 , 已知分子式为的反应类型为。(4)、请写出一种满足以下条件的链状化合物的结构简式:。i.与比A多一个碳原子的同系物是同分异构体;
ii.存在2种不同化学环境的氢原子;
iii.能够与盐酸发生反应生成盐。
(5)、已知:① 与
与 性质相似;②
性质相似;② 。写出以
。写出以 和
和 为原料制备
为原料制备 的合成路线流程图,无机试剂任选,两碳及以下有机试剂任选。
的合成路线流程图,无机试剂任选,两碳及以下有机试剂任选。 -
3、硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为MnS及少量FeS)为原料制备硫酸锰的工艺流程如下:

已知:
①“混合焙烧”后烧渣含及少量。
②酸浸时,浸出液的pH与锰的浸出率关系如下图1所示。
③金属离子在水溶液中的平衡浓度与pH的关系如下图2所示 , 此实验条件下开始沉淀的pH为7.54;当离子浓度时,可认为该离子沉淀完全。
 (1)、的价电子排布式为。(2)、传统工艺处理高硫锰矿时,若不经“混合焙烧”,而是直接用浸出,其缺点为。(3)、实际生产中,酸浸时控制硫酸的量不宜过多,使pH在2左右。请结合图1和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:。(4)、“中和除杂”时,应调节pH的范围为;其中除去的离子方程式为。(5)、“氟化除杂”时,若维持 , 溶液中的和(填“能”或“不能”)都沉淀完全[已知:;]。(6)、产品纯度测定:称取1.000g产品,在适宜条件下用适量将氧化为 , 再用溶液20.00mL刚好把转化为。通过计算可知,产品纯度为(写出计算过程)。
(1)、的价电子排布式为。(2)、传统工艺处理高硫锰矿时,若不经“混合焙烧”,而是直接用浸出,其缺点为。(3)、实际生产中,酸浸时控制硫酸的量不宜过多,使pH在2左右。请结合图1和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:。(4)、“中和除杂”时,应调节pH的范围为;其中除去的离子方程式为。(5)、“氟化除杂”时,若维持 , 溶液中的和(填“能”或“不能”)都沉淀完全[已知:;]。(6)、产品纯度测定:称取1.000g产品,在适宜条件下用适量将氧化为 , 再用溶液20.00mL刚好把转化为。通过计算可知,产品纯度为(写出计算过程)。 -
4、在与反应制甲醇的反应体系中,主要反应的热化学方程式为
反应I:
反应Ⅱ:
向恒压密闭容器中通入1molCO2和3molH2 , CO2的平衡转化率、CH3OH的平衡产率随温度的变化如下图所示。下列说法正确的是
 A、反应I的平衡常数 B、和充分反应,吸收热量40.9kJ C、平衡时的体积分数可能大于0.5 D、曲线a代表的是的平衡转化率
A、反应I的平衡常数 B、和充分反应,吸收热量40.9kJ C、平衡时的体积分数可能大于0.5 D、曲线a代表的是的平衡转化率 -
5、草酸亚铁是生产磷酸铁锂电池的原料,实验室可通过如下反应制取:

已知室温时:。
下列说法正确的是
A、室温下,向溶液中加酸调节时溶液中存在: B、“酸化溶解”后的溶液中存在: C、室温时,能与反应生成沉淀 D、室温时,“沉铁”后的上层清液中: -
6、下列由实验操作和现象推出的结论正确的是
实验操作和现象
结论
A
向含有ZnS和的白色悬浊液中滴加少量溶液,有黑色沉淀生成
B
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,冷却后向其中加入足量稀NaOH溶液,再加入新制的银氨溶液,并水浴加热,产生了银镜
蔗糖水解产物具有还原性
C
向浓中插入红热的炭,有红棕色气体生成
炭可与浓反应生成
D
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液,无血红色出现
食品脱氧剂样品中无+3价铁
A、A B、B C、C D、D -
7、回收利用工业废气中的和 , 实验原理示意图如下。
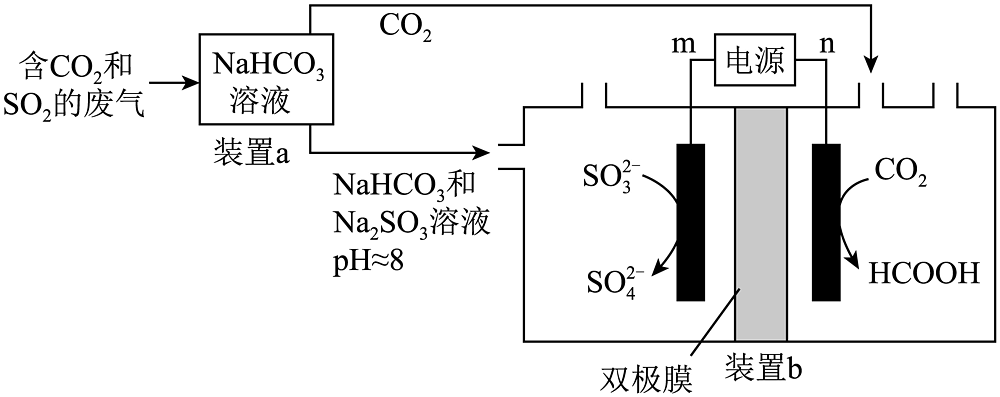
下列说法不正确的是
A、m极为电源正极 B、电解过程中,双极膜中产生的移向右侧,产生的移向左侧 C、装置a中溶液的作用是吸收废气中的和 D、装置b中,每当有标准状况下参与反应时,得电子数为2mol -
8、植物提取物阿魏萜宁具有抗菌活性,其结构简式如下图所示。下列关于阿魏萜宁的说法错误的是
 A、可与Na2CO3溶液反应 B、消去反应产物最多有2种 C、酸性条件下的水解产物均可生成高聚物 D、该有机物与足量H2反应所得产物有5个手性碳原子
A、可与Na2CO3溶液反应 B、消去反应产物最多有2种 C、酸性条件下的水解产物均可生成高聚物 D、该有机物与足量H2反应所得产物有5个手性碳原子 -
9、阅读以下材料,完成下列小题:
海洋是一个巨大的卤素资源宝库,从海水中能获得NaCl。工业常用电解饱和NaCl溶液制备 , 并进一步制得等用途更广泛的化合物。黄绿色气体可用于自来水消毒,(N的化合价为-3)有强氧化性,遇水剧烈水解,可用于漂白和杀菌消毒。
(1)、下列说法正确的是A、分子中含有键 B、是由极性键构成的非极性分子 C、中的键角小于中的键角 D、在NaCl晶胞中,每个周围紧邻且距离相等的构成正六面体结构(2)、下列化学反应表示正确的是A、电解饱和食盐水制备的离子方程式: B、将氯水在强光下照射的化学方程式: C、水解的化学方程式: D、与NaOH溶液在时生成的离子方程式:(3)、下列物质性质与用途具有对应关系的是A、能溶于水,可用于工业制盐酸 B、HCl具有还原性,可用于实验室制取氯气 C、NaClO具有强碱性,可用作漂白液 D、气体呈黄绿色,可用作自来水消毒剂 -
10、铵明矾常用作絮凝剂。下列说法正确的是A、离子半径: B、电负性: C、第一电离能: D、沸点:
-
11、利用下列装置(夹持装置略)进行实验,能达到实验目的的是
 A、用甲装置进行中和热的测定 B、用乙装置制备溴苯并验证有HBr产生 C、用丙装置制备无水 D、用丁装置加热熔融NaOH固体
A、用甲装置进行中和热的测定 B、用乙装置制备溴苯并验证有HBr产生 C、用丙装置制备无水 D、用丁装置加热熔融NaOH固体 -
12、传统鎏金工艺是将金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附着在器物表面。下列说法错误的是A、刻金工艺中金发生了化学反应 B、鎏金工艺利用了汞的挥发性 C、鎏金工艺的原理可用于金的富集 D、将银代替金溶于汞中即为鎏银工艺
-
13、已知常温下部分弱电解质的电离平衡常数如下表:
化学式
HF
HClO
H2CO3
NH3·H2O
电离常数
6.8×10−4
4.7×10−8
K1=4.3×10−7
K2=5.6×10−11
Kb=1.7×10−5
(1)常温下,pH相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其物质的量溶度由大到小的顺序是(填序号)
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为。
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO‒)c(HCO3‒)(填“>,<,=”)可使上述两种溶液PH相等的方法是(填代号)
a.向NaClO溶液中加适量的水b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水d.向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2 , 所发生的离子方程式为。
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性(填“酸性”“碱性”“中性”)
-
14、一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图所示。

(1)该反应的化学方程式为 , 在此条件下,下列各项能说明该反应达到平衡状态的是。
A.混合气体的压强不变B.混合气体的密度不变
C.混合气体的总物质的量不变D.混合气体的平均相对分子质量不变
E.C的体积分数不变
(2)该反应的反应速率υ随时间t的关系如图所示:

①根据图判断,在t3时刻如何改变外界条件的。
②a、b、c三点中,C的体积分数最大的是。
③各阶段的平衡常数如下表所示:则K1、K2、K3之间的关系为(用“”、“”或“=”连接)。
t2~t3
t4~t5
t5~t6
K1
K2
K3
-
15、
I.联氨(N2H4 , 常温下是无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式。(2)已知①2O2(g)+N2(g)=N2O4(l) ΔH1②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4= , 联氨和N2O4可作为火箭推进剂的主要原因为。
Ⅱ.现有反应:mA(g)+nB(g)pC(g).达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(3)该反应的逆反应为热反应,且m+np(填“>”“=”“<”)。(4)若加入B(体积不变),则A的转化率 , B的转化率(填“增大”“减小”或“不变”)。(5)若升高温度,则平衡时B、C的浓度之比将。(6)若加入催化剂,平衡时气体混合物的总物质的量。 -
16、25℃时,用浓度为0.1000的NaOH溶液滴定20.00mL浓度均为0.1000的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是
 A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B、根据滴定曲线,可得 C、将上述HX、HY溶液等体积混合后,用NaOH溶液中和滴定至恰好完全反应时,c(X−)>c(Y−)>c(OH−)>c(H+) D、HX、HY、HZ中均存在电离平衡
A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B、根据滴定曲线,可得 C、将上述HX、HY溶液等体积混合后,用NaOH溶液中和滴定至恰好完全反应时,c(X−)>c(Y−)>c(OH−)>c(H+) D、HX、HY、HZ中均存在电离平衡 -
17、如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
 A、电池总反应为N2H4+2O2=2NO+2H2O B、电池内的O2-由电极乙移向电极甲 C、电极乙上反应的电极方程式为:O2+2e-=O2- D、电池外电路的电子由电极乙移向电极甲
A、电池总反应为N2H4+2O2=2NO+2H2O B、电池内的O2-由电极乙移向电极甲 C、电极乙上反应的电极方程式为:O2+2e-=O2- D、电池外电路的电子由电极乙移向电极甲 -
18、下列依据热化学方程式得出的结论正确的是A、在、时,完全燃烧生成液态水,放出热量,则表示氢气燃烧热的热化学方程式为: B、的燃烧热是 , 则 C、在稀溶液中: , 若将含的稀硫酸与含的溶液混合,放出的热量大于 D、已知石墨,金刚石, , 则金刚石比石墨稳定
-
19、25℃时,向纯水中通入Cl2至饱和,再逐滴滴加0.1mol/L的NaOH溶液,实验过程中得到如下图所示的pH变化曲线。下列有关说法正确的是
 A、pH=7时,一定有c(Na+)=c(Cl-)+c(ClO-) B、从a点到b点,Cl2在水中的溶解度增大 C、b点溶液中:c(H+)=c(Cl-)+c(OH-)+c(HClO) D、从b点到c点,溶液中减小
A、pH=7时,一定有c(Na+)=c(Cl-)+c(ClO-) B、从a点到b点,Cl2在水中的溶解度增大 C、b点溶液中:c(H+)=c(Cl-)+c(OH-)+c(HClO) D、从b点到c点,溶液中减小 -
20、在25℃和T℃时,水溶液中c(H+)和c(OH-)的关系如图所示,下列说法正确的是
 A、T<25℃ B、AB点连线上的任意一点pH均为7 C、B点溶液的导电能力一定大于A点 D、溶液中水的电离程度C点可能大于D点
A、T<25℃ B、AB点连线上的任意一点pH均为7 C、B点溶液的导电能力一定大于A点 D、溶液中水的电离程度C点可能大于D点