-
1、氧化还原反应原理广泛应用于环境问题的优化处理。(1)、在太阳能作用下,Fe0.9O处理CO2和再生的过程如图所示。
①Fe0.9O中Fe3+与Fe2+的物质的量之比为。
②反应I的化学方程式为。
③反应Ⅱ中每产生1molFe0.9O,转移电子的物质的量为。
 (2)、Na2S2O3去除酸性废水中H3AsO3的反应过程如图所示。
(2)、Na2S2O3去除酸性废水中H3AsO3的反应过程如图所示。
①步骤Ⅲ中氧化剂与还原剂的质量之比为。
②步骤Ⅳ的化学方程式为。
(3)、O2在一定条件下能有效去除烟气中的SO2、NO,可能的反应机理如图所示,该过程可描述为。 (4)、在一定条件下,利用Fe去除酸性水体中的原理如图所示。
(4)、在一定条件下,利用Fe去除酸性水体中的原理如图所示。
初始pH
pH=2.5
pH=4.5
24小时后去除率
接近100%
<50%
铁的最终物质形态


①去除的总反应离子方程式为。
②溶液的初始pH值对铁的氧化产物和的去除率都有影响。取两份相同的含废液,调节起始pH分别为2.5和4.5,一段时间后,测得实验结果如上表所示。当初始pH=4.5,去除率低的原因是。
-
2、以废旧钴酸锂电池(主要成分为、炭黑、铝箔、铁以及有机粘接剂)为原料制取。(1)、酸浸。将废旧电池放电、拆解、灼烧后,用溶液浸取,过滤。
①灼烧的主要目的是。
②配制溶液,需质量分数为的浓硫酸(密度为)体积为(保留一位小数)。
③在相同条件下,使用盐酸作浸取剂可使浸取率达到99%,但工业生产不直接用盐酸作浸取剂的原因是。
(2)、制备。将酸浸后的滤液除杂后加入 , 充分反应后过滤,得到。①“制备”反应的离子方程式为。
②其他条件一定,“制备”过程中,钴的沉淀率与如图所示。“制备”时应该控制的原因是。

③其他条件一定,“制备”过程中,钴的沉淀率与温度的关系如图所示。“制备”时温度高于50℃,钴的沉淀率下降的原因是。

-
3、利用碳酸盐类铜矿[主要成分可表示为]可制备晶体和。(1)、向某碳酸盐类铜矿中加入足量的盐酸充分反应,生成:。该铜矿主要成分的化学式为(用最简整数比表示)。(2)、孔雀石(含、等杂质)是一种碳酸盐类铜矿,孔雀石制晶体的流程如下:

①通空气的作用是。
②“除杂”时需加入固体A调节溶液的 , 固体A的化学式为。
(3)、实验室用溶液与溶液反应可制得(难溶于水的绿色固体)。已知:I.溶液和溶液反应的最佳体积比为;
Ⅱ.其他条件相同,不同温度下,沉淀生成的速率、颜色和质量如下表所示。
温度℃
25
65
75
85
沉淀生成速率
最慢
较慢
快
很快
产物沉淀量g
无
1.303
1.451
1.28
沉淀颜色
蓝色
绿色
绿色
绿色(偏暗)
①配制溶液和溶液各。需要的玻璃仪器有:烧杯、玻璃棒、。
②制备。补充完整实验方案:取溶液, , 干燥。(必须使用的试剂有:溶液、溶液)
③测定纯度。称取样品溶于稀盐酸配成溶液,从中取出溶液,向其中滴加溶液至不再产生沉淀,继续滴加标准溶液至恰好完全反应,消耗标准溶液。质量分数为(写出计算过程)。已知:、。
-
4、依据物质类别和元素价态,可以预测物质的性质,设计和分析物质间的转化。(1)、是一种碱性氧化物。写出和溶液反应的离子方程式:。(2)、在一定条件下单质甲可发生转化:甲乙丙。
则甲化学式可能为。(写出两种物质)
(3)、将一小粒金属加入到溶液中,实验结束时观察到有少量黑色固体产生,其原因是。(4)、通过某一化合反应可生成 , 该反应的实验现象是。(5)、氧化还原反应一般可拆分为“氧化半反应”和“还原半反应”。请从、、、、中选择一种物质,使发生“还原半反应”:。
①该“氧化半反应”的反应式:。
②若上述氧化还原反应中转移电子,则消耗硝酸的物质的量为。
-
5、某学习小组为探究(砖红色)的性质,进行如下实验。
实验1:取少许加入到试管甲,滴加过量溶液并充分振荡,砖红色沉淀转化为红色沉淀,溶液显浅蓝色。
实验2:另取少许加入到试管乙,滴加过量氨水并充分振荡,沉淀逐渐溶解,溶液颜色为无色;静置一段时间后,溶液颜色变为深蓝色。
下列说法不正确的是
A、实验1中新生成的沉淀为金属 B、实验1中生成红色沉淀体现了的氧化性 C、实验2中溶液颜色变化的原因可能是被氧化 D、实验1、2不能说明为两性氧化物 -
6、根据下列实验操作和现象所得出的结论正确的是
选项
实验操作与现象
结论
A
湿润的有色布条放入盛有干燥氯气的集气瓶中,布条褪色
氯气具有漂白性
B
向某溶液中滴入少量溶液,溶液变成红色
溶液已氧化变质
C
向装有、固体的两支试管中分别加入蒸馏水,并将其置于水浴中,最终发现只有未完全溶解
40℃时的溶解度:
D
向某溶液中滴加过量的稀盐酸,产生使澄清石灰水变浑浊的气体
该溶液中含有大量
A、A B、B C、C D、D -
7、用作供氧剂,发生反应:。下列说法正确的是A、是氧化剂,是还原剂 B、约含有个 C、溶液中含 D、反应中每转移电子约生成(标准状况下)
-
8、在给定条件下,下列物质转化均可实现的是A、 B、 C、 D、溶液
-
9、下列关于海水资源综合利用的说法正确的是A、海水晒盐可获得纯净的氯化钠 B、向海水中通入热空气可提取到液溴 C、用过滤的方法对海水进行淡化处理 D、从海水获得碘单质的过程中发生了氧化还原反应
-
10、阅读下列资料,完成下列小题:
高铁酸钾是一种暗紫色固体,在低温、碱性条件下比较稳定。能溶于水,且能与水反应放出 , 并生成胶体,常用作水处理剂。有强氧化性,酸性条件下,其氧化性强于、等。工业制备的流程如下:
 (1)、下列关于的说法正确的是A、中钾元素与氧元素的质量比为1:2 B、进行水处理的过程中化合价未发生变化 C、将与盐酸混合使用,可增强其杀菌消毒效果 D、可用丁达尔效应鉴别和两种紫红色溶液(2)、下列关于工业制备的说法正确的是A、“反应”时,将更换为效果更好 B、“过滤”所得滤渣中大量存在、等物质 C、“转化”时,反应能进行的原因是该条件下的溶解度比小 D、“过滤Ⅱ”所得滤液在酒精灯外焰上灼烧,火焰呈黄色,说明滤液为溶液
(1)、下列关于的说法正确的是A、中钾元素与氧元素的质量比为1:2 B、进行水处理的过程中化合价未发生变化 C、将与盐酸混合使用,可增强其杀菌消毒效果 D、可用丁达尔效应鉴别和两种紫红色溶液(2)、下列关于工业制备的说法正确的是A、“反应”时,将更换为效果更好 B、“过滤”所得滤渣中大量存在、等物质 C、“转化”时,反应能进行的原因是该条件下的溶解度比小 D、“过滤Ⅱ”所得滤液在酒精灯外焰上灼烧,火焰呈黄色,说明滤液为溶液 -
11、下列反应的离子方程式书写正确的是A、硫酸镁溶液和氢氧化钠溶液反应: B、碳酸氢钠溶液和氢氧化钠溶液反应: C、铜和氯化铁溶液反应: D、氯气溶于水:
-
12、下列实验原理及装置均能达到实验目的的是
 A、用图1装置检验钾元素 B、用图2装置除去中少量的 C、用图3装置发生铝热反应 D、用图4装置制取氯气
A、用图1装置检验钾元素 B、用图2装置除去中少量的 C、用图3装置发生铝热反应 D、用图4装置制取氯气 -
13、常温下,下列各组离子在指定溶液中能大量共存的是A、强碱性溶液中:、、、 B、新制饱和氯水中:、、、 C、与反应产生的溶液中:、、、 D、使紫色石蕊变红的溶液中:、、、
-
14、下列盐的性质与用途具有对应关系的是A、微溶于水,可用于制作漂白粉 B、受热易分解,可用于治疗胃酸过多 C、溶液有氧化性,可用于制作铜制印刷电路板 D、溶于水能形成胶体,可用于自来水的消毒杀菌
-
15、与反应生成、和。下列说法正确的是A、的摩尔质量为18 B、中硫元素的化合价为+4价 C、中阴离子与阳离子的个数之比为1∶2 D、的电离方程式为
-
16、硫酸工业涉及反应:。下列说法正确的是A、的俗名磁性氧化铁 B、和是氧的同素异形体 C、该反应属于置换反应 D、是一种电解质
-
17、在日常生活中,金属腐蚀的现象普遍存在,金属腐蚀常常是自发进行的。回答下列问题:(1)、钢铁腐蚀分为析氢腐蚀和吸氧腐蚀:
①在酸性环境中,主要发生的腐蚀称为(填“析氢”或“吸氧”)腐蚀,此时正极上的电极反应式为。
②发生吸氧腐蚀时,每转移0.2mol电子,消耗气体的体积为mL(标准状况下)。
(2)、钢铁的保护法如图所示:
①图1为(填“牺牲阳极保护法”或“外加电流法”),此时锌板上发生的电极反应为。
②图2中,a为电源的(填“正”或“负”)极,判断的理由为。
-
18、下列反应方程式正确的是A、溶液中的水解方程式: B、铅酸蓄电池放电时正极电极反应: C、氢硫酸的电离方程式: D、甲烷燃烧热的热化学方程式:
-
19、Burns和Dainton研究了反应Cl2(g)+CO(g)COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m , k为速率常数(只受温度影响),m为CO的反应级数。该反应可认为经过以下反应历程:下列表述错误的是
第一步:Cl22Cl 快速平衡
第二步:Cl+COCOCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
A、COCl属于反应的中间产物 B、第一步和第二步的活化能较低 C、决定总反应快慢的是第三步 D、第三步的有效碰撞频率较大 -
20、下列通过制取硫酸铝、氢氧化铝,获得氧化铝的装置和原理能达到实验目的的是
A
B
C
D



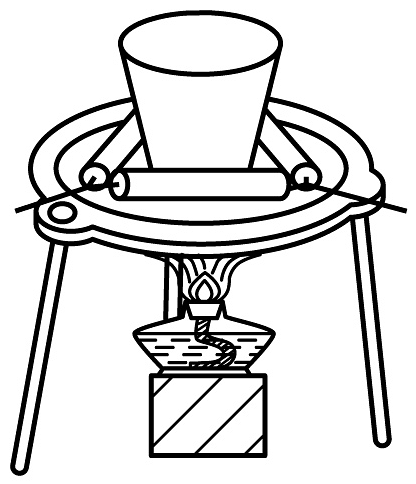
制硫酸铝
制氢氧化铝
过滤氢氧化铝
灼烧制氧化铝
A、A B、B C、C D、D