相关试卷
-
1、空气是一种宝贵的资源,下列有关空气的说法正确的是A、稀有气体可用于制作航标灯 B、氮气约占空气总质量的78% C、氧气具有助燃性,可用作燃料 D、计入空气污染指数的有害气体为SO2、CO2、NO2等
-
2、对下列宏观事实的微观解释错误的是A、水和过氧化氢化学性质不同——分子构成不同 B、“遥知不是雪,为有暗香来”——分子在不断运动 C、气体受热膨胀——分子大小随温度的变化而改变 D、氢气在氧气中燃烧生成水——在化学变化中,分子种类发生改变
-
3、水是宝贵的自然资源,请回答问题:

请根据图示回答下列问题。
(1)、图I吸附池内活性炭的作用是 , 该过程属于变化,常用的混凝剂是 , 作用是。(2)、实验室过滤常用到的仪器有铁架台、烧杯、漏斗和(它的作用是);若滤液浑浊原因可能是滤纸破损或;(3)、家庭生活中可以用对自来水杀菌消毒,该过程还有降低水的作用。(4)、图Ⅱ可实现海水的淡化,其原理和常用净水方法中的相似。(5)、有些科学家预言:“世界上最后一滴水就是人类的眼泪”,这句话警示我们应树立保护水资源的意识:一是节约用水,二是一水多用。请你举一例一水多用做法:合理答案均可。 -
4、根据如图所示的实验装置回答问题。
 (1)、仪器X的名称是。(2)、实验室用A制取氧气,在试管内加入了一种暗紫色固体,该反应的符号表达式是 , 试管口加一团棉花的作用是 , 要收集较干燥的氧气,选择的收集装置是(A-E中选)。(3)、写出实验室用B装置制取氧气的符号表达式 , 其中将仪器X下端伸入液面以下的原因是: , 若用装置E收集氧气,待集气瓶里的水排完后,(填操作),再把集气瓶移出水槽,在桌上(填正放或倒放)。(4)、若采用F装置收集氧气,应从导管(填“a”或“b”)端通入氧气,该方法如何验满:。(5)、如图所示进行实验,该实验能得出的结论是_______(填字母)。
(1)、仪器X的名称是。(2)、实验室用A制取氧气,在试管内加入了一种暗紫色固体,该反应的符号表达式是 , 试管口加一团棉花的作用是 , 要收集较干燥的氧气,选择的收集装置是(A-E中选)。(3)、写出实验室用B装置制取氧气的符号表达式 , 其中将仪器X下端伸入液面以下的原因是: , 若用装置E收集氧气,待集气瓶里的水排完后,(填操作),再把集气瓶移出水槽,在桌上(填正放或倒放)。(4)、若采用F装置收集氧气,应从导管(填“a”或“b”)端通入氧气,该方法如何验满:。(5)、如图所示进行实验,该实验能得出的结论是_______(填字母)。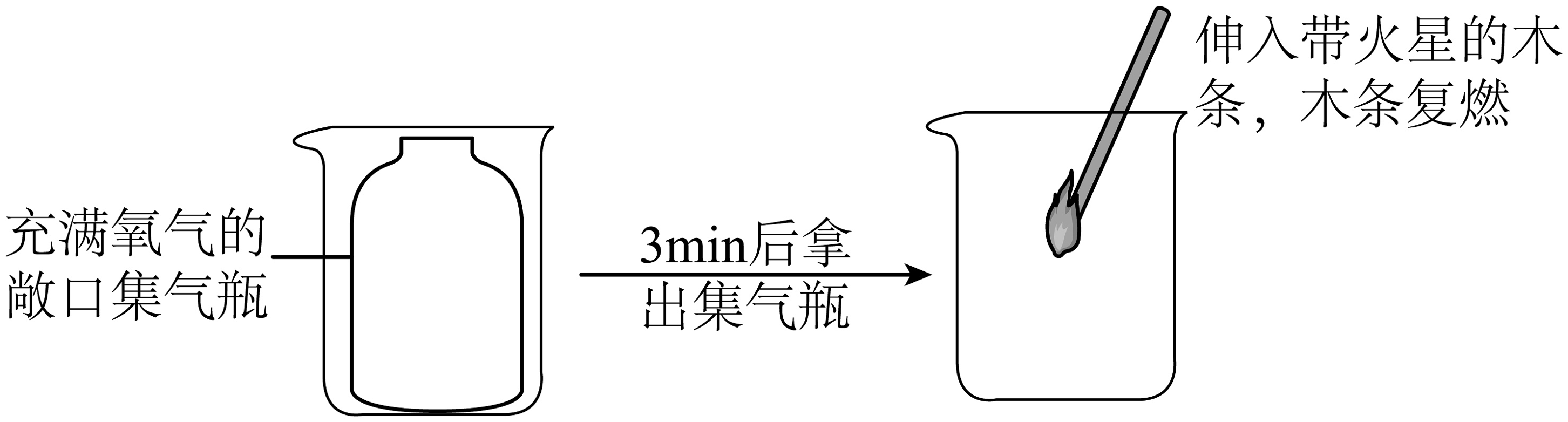 A、氧气具有助燃性 B、氧气密度比空气大 C、分子在不断运动 D、氧气不易溶于水
A、氧气具有助燃性 B、氧气密度比空气大 C、分子在不断运动 D、氧气不易溶于水 -
5、数字在化学学科中占有十分重要的地位。(1)、在化学王国里,数字被赋予了丰富的内涵,下列化学用语中数字“2”的含义分别是:
①2O;
②2Cl-;
③Mg2+。
(2)、单独的数字没有特别的意义。只有给数字赋予一定的界定,才有实际价值。如空气中氧气约占21%,指的是(填“体积分数”或“质量分数”);(3)、元素周期表是学习化学的重要工具,原子序数为1~18的元素的原子结构示意图等信息如下,请认真分析并回答下列问题。
①与氯元素化学性质相似的元素是(填元素名称)。
②已知一个A原子质量为m千克,一个碳12原子的质量为n千克,则A的相对原子质量是。
③原子序数为16的元素的原子容易(填“得到”或“失去”)电子,所形成的粒子的符号是。
④下列说法正确的是。
A.不同元素最本质的区别是相对原子质量不同
B. 在原子中,质子数一定等于电子数
C. Fe2+和Fe3+都属于铁元素,核外电子数不同
D.
 和
和 化学性质相似
化学性质相似⑤原子序数为11和17的元素组成的物质由构成(填符号)。
-
6、根据图文,回答问题。
 (1)、全球气候变暖,主要是由(填符号)大量排放引起的;酸雨与煤中所含硫的燃烧有关,硫在空气燃烧的符号表达式为;它在氧气中燃烧时常在集气瓶底加少量水,其作用为。(2)、自然界中的水能直接用于生产、生活的是(填“海水”、“陆地淡水”或“陆地咸水”);城市中的生活用水是经过自来水厂净化处理过的,净化处理过的自来水属于(填纯净物或混合物) 。(3)、上图(3)中X的符号是(填元素符号,下同);含量最多的金属元素是;铁、硅是不同种元素,最本质的区别是;符号“Fe”包含的意义有:表示铁元素、、。
(1)、全球气候变暖,主要是由(填符号)大量排放引起的;酸雨与煤中所含硫的燃烧有关,硫在空气燃烧的符号表达式为;它在氧气中燃烧时常在集气瓶底加少量水,其作用为。(2)、自然界中的水能直接用于生产、生活的是(填“海水”、“陆地淡水”或“陆地咸水”);城市中的生活用水是经过自来水厂净化处理过的,净化处理过的自来水属于(填纯净物或混合物) 。(3)、上图(3)中X的符号是(填元素符号,下同);含量最多的金属元素是;铁、硅是不同种元素,最本质的区别是;符号“Fe”包含的意义有:表示铁元素、、。 -
7、如图是某化学反应的微观示意图,“
 ”和“
”和“ ”分别表示两种不同的原子。下列说法错误的是
”分别表示两种不同的原子。下列说法错误的是 A、原子是化学变化中的最小微粒 B、参加反应的甲分子与乙分子的个数比为3:2 C、该反应类型为化合反应 D、元素的种类、原子的数目在化学反应前后不变
A、原子是化学变化中的最小微粒 B、参加反应的甲分子与乙分子的个数比为3:2 C、该反应类型为化合反应 D、元素的种类、原子的数目在化学反应前后不变 -
8、下列是五种微粒的结构示意图。关于这五种微粒的说法正确的是
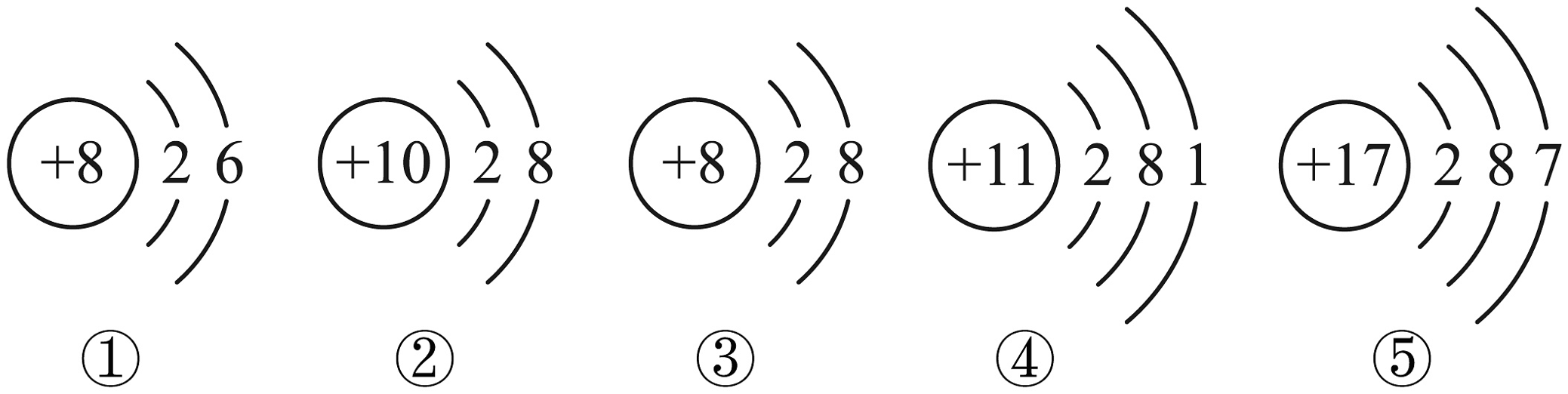 A、它们表示5种元素的微粒 B、②③都是稳定结构,都属于阴离子 C、④⑤对应的元素在同一周期 D、④在化学反应中易失去电子变成离子,该过程中电子层数不变
A、它们表示5种元素的微粒 B、②③都是稳定结构,都属于阴离子 C、④⑤对应的元素在同一周期 D、④在化学反应中易失去电子变成离子,该过程中电子层数不变 -
9、下列操作可以说明如图装置气密性良好的是
 A、拉活塞,试管内液面上升 B、推活塞,左边导管内出现一段水柱 C、拉活塞,左边导管内出现一段水柱 D、推活塞,左边导管口出现气泡
A、拉活塞,试管内液面上升 B、推活塞,左边导管内出现一段水柱 C、拉活塞,左边导管内出现一段水柱 D、推活塞,左边导管口出现气泡 -
10、嫦娥五号采集的月壤样品中存在氦-3(含有2个质子和1个中子的氦原子)。氦元素在元素周期表中的信息如图。下列有关氦元素的说法错误的是
 A、属于稀有气体元素 B、氦气是由氦元素组成 C、氦-3的原子结构示意图为
A、属于稀有气体元素 B、氦气是由氦元素组成 C、氦-3的原子结构示意图为 D、氦原子在化学反应中不易失去电子
D、氦原子在化学反应中不易失去电子
-
11、空气和水是人类生活与生产不可缺少的自然资源。下列说法错误的是A、空气的污染物成分主要有粉尘、二氧化硫、二氧化碳、二氧化氮等 B、空气中的氮气是制造硝酸和氮肥的重要原料 C、工业“三废”和生活污水要经处理后才能排放 D、爱护水资源,不仅要节约用水,而且要防治水体污染.
-
12、下列图示是同学们在实验操作考试中的具体操作。其中正确的是A、
 点燃酒精灯
B、
点燃酒精灯
B、 滴加液体
C、
滴加液体
C、 加热液体
D、
加热液体
D、 加热固体
加热固体
-
13、
创新实验是中学生最为重要的科学素养。下图是某学校师生对“二氧化锰催化过氧化氢分解实验装置的创新设计”,实验过程如下:
实验一:设计新的实验装置
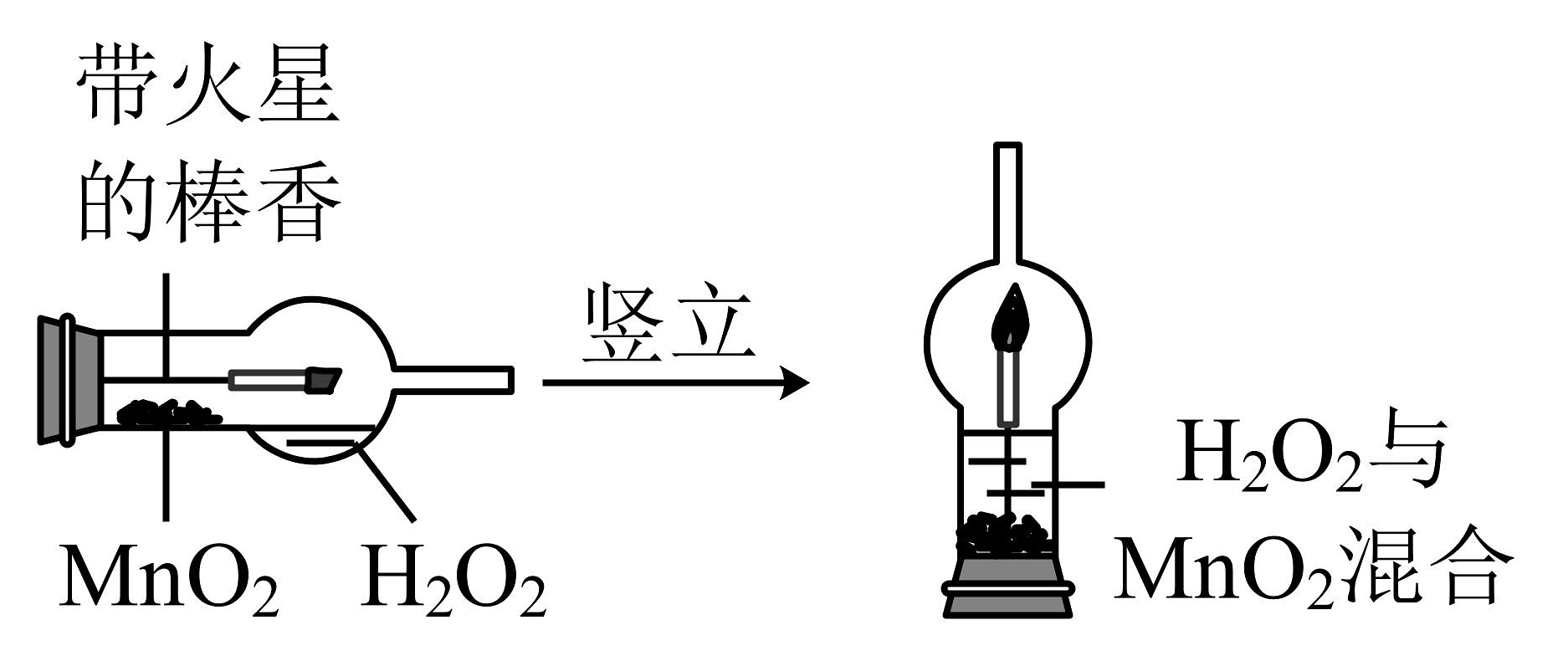
①将一支球形干燥管水平放置,用滴管吸取3mL(密度为1g/mL))质量分数为5%的过氧化氢溶液加入干燥管的球泡内,再用药匙取0.2g二氧化锰粉末,加在干燥的进气管的管壁上;②点燃橡胶塞上固定的棒香后,塞紧干燥管并将其竖立,观察到带火星的棒香立即复燃。
请分析回答下列问题:
(1)写出球形干燥管内发生的化学反应的文字表达式________。
(2)对该创新实验的评价,你认为不合理的是 (填字母)。
A. 反应速度太慢,耽误时间 B. 实验中所用的仪器、材料及药品均易得到 C. 实验使用的药品用量太大 D. 实验现象明显,整个装置好似点燃的灯塔,趣味性强 实验二:寻找新的催化剂
【实验探究】
实验步骤
实验现象
Ⅰ.分别取5mL 5%的过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并在A、B两支试管中插入带火星的小木条,观察现象。
A试管中产生气泡,带火星的小木条复燃,B试管中无明显实验现象
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的小木条伸入试管中,如此反复多次实验,观察现象。
试管中均产生气泡,带火星的木条均复燃
Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量。
所得固体质量为ag。
Ⅳ.分别量取5mL 5%的过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,再向D试管中加入ag二氧化锰粉末,观察现象。
【实验结论】
(3)实验Ⅱ可以证明________,再结合实验Ⅰ和实验Ⅲ证明:氧化铁可以作为过氧化氢分解的催化剂。
【实验评价】
(4)设计实验Ⅳ的目的是________;
【实验拓展】
查阅资料得知:氧化铜、硫酸铜、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。
(5)下列有关催化剂的说法中正确的是
A. 同一个化学反应可以有多种催化剂 B. 二氧化锰只能作为过氧化氢溶液分解的催化剂 C. 催化剂能使原本不发生的反应快速进行 D. 用作催化剂的物质不可能是其他反应的反应物或者生成物 -
14、化学兴趣小组同学对空气中氧含量测定实验装置进行改进,回答下列有关问题:(1)、如图为书本测定空气中氧气含量的实验装置,该实验发生的化学反应的文字表达式为。
 (2)、小林同学对图四实验进行了改进,设计如图甲所示实验装置,试管容积为45mL(规格是18180mm)。实验前,打开弹簧夹,将注射器的活塞前沿从30mL刻度处推至25mL刻度处,然后松手,若活塞仍能返回至30mL刻度处,则说明。
(2)、小林同学对图四实验进行了改进,设计如图甲所示实验装置,试管容积为45mL(规格是18180mm)。实验前,打开弹簧夹,将注射器的活塞前沿从30mL刻度处推至25mL刻度处,然后松手,若活塞仍能返回至30mL刻度处,则说明。 (3)、实验开始,将少量红磷装入试管中,将30mL的注射器活塞置于15mL刻度处,松开弹簧夹,点燃酒精灯,红磷燃烧,撤去酒精灯,待试管冷却后再读取注射器活塞的数据。实验过程中,可以观察到注射器活塞移动情况是 , 注射器活塞最终停在约为mL刻度处。(4)、小刘同学又改用图乙装置使用暖宝宝贴来测定空气中氧气的含量,已知暖宝宝贴(主要成分是铁粉、木炭、食盐)的热量来源于铁粉的缓慢氧化(即铁与氧气、水发生反应生锈),实验开始前的装置如图乙所示,实验后从量筒中倒吸入集气瓶(容积为250mL)中的水的体积为47mL(铁粉生锈消耗的水忽略不计)。通过该实验测得空气样品中氧气的体积分数为(精确到0.1%)。
(3)、实验开始,将少量红磷装入试管中,将30mL的注射器活塞置于15mL刻度处,松开弹簧夹,点燃酒精灯,红磷燃烧,撤去酒精灯,待试管冷却后再读取注射器活塞的数据。实验过程中,可以观察到注射器活塞移动情况是 , 注射器活塞最终停在约为mL刻度处。(4)、小刘同学又改用图乙装置使用暖宝宝贴来测定空气中氧气的含量,已知暖宝宝贴(主要成分是铁粉、木炭、食盐)的热量来源于铁粉的缓慢氧化(即铁与氧气、水发生反应生锈),实验开始前的装置如图乙所示,实验后从量筒中倒吸入集气瓶(容积为250mL)中的水的体积为47mL(铁粉生锈消耗的水忽略不计)。通过该实验测得空气样品中氧气的体积分数为(精确到0.1%)。 -
15、A-H是初中常见的八种物质,有如下图所示关系,“→”表示一种物质能生成另一种物质,其中A是一种暗紫色固体,D能使带火星的木条复燃,F是一种最常见的液体,反应③剧烈燃烧、火星四射,并且H是一种黑色的固体,在反应②前后B的质量和化学性质均不改变。试推断:
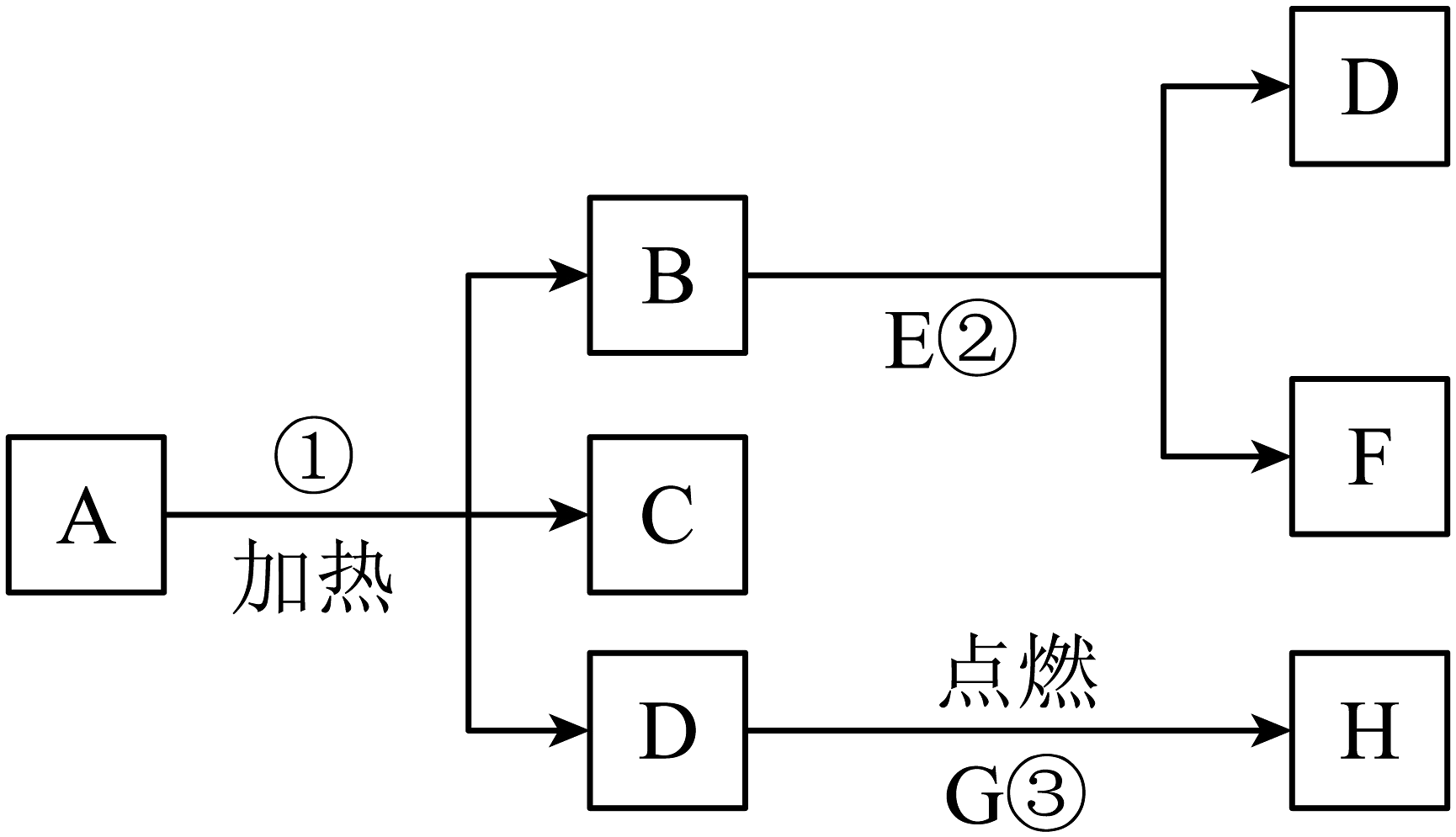 (1)、写出物质名称E:、H:。(2)、反应②中B物质的作用是。(3)、写出反应①的文字表达式。
(1)、写出物质名称E:、H:。(2)、反应②中B物质的作用是。(3)、写出反应①的文字表达式。 -
16、下图为实验室中常见的气体制备和收集装置,请回答下列问题:
 (1)、请写出仪器X的名称。(2)、用F装置进行排空气法收集氧气,将带火星的木条放在(选填“a”或“b”)处,若观察到带火星的木条复燃,则表示氧气已集满。(3)、实验室用一定质量的氯酸钾与适量的二氧化锰混合加热制取氧气,选择将装置G和H连接用排水集气法测定生成氧气的总体积,则导管的连接顺序为 , 实验过程中的说法正确的是。
(1)、请写出仪器X的名称。(2)、用F装置进行排空气法收集氧气,将带火星的木条放在(选填“a”或“b”)处,若观察到带火星的木条复燃,则表示氧气已集满。(3)、实验室用一定质量的氯酸钾与适量的二氧化锰混合加热制取氧气,选择将装置G和H连接用排水集气法测定生成氧气的总体积,则导管的连接顺序为 , 实验过程中的说法正确的是。A.要先用产生的氧气排出试管内的空气,再连接装置H
B.若试管未冷却至室温就读数,会造成测量结果偏大
C.若读数时俯视量筒读数,则测量结果偏大
(4)、检查C装置气密性的操作是:用止水夹夹住胶皮管,向长颈漏斗内加水,一段时间后,若 , 则装置气密性良好。(5)、某同学查资料得知,过氧化钠(Na2O2)是一种淡黄色固体粉末,常温下可与水反应生成氢氧化钠和氧气,如果在实验室用过氧化钠和水反应来制取并收集一瓶较纯净的氧气,同时希望控制反应的速率,应该选择的装置为(填写装置字母编号) -
17、请回答下列问题:(1)、下列物质:①氧气、②人体呼出的气体、③液氮、④空气中0.94%的稀有气体、⑤二氧化碳、⑥洁净的空气、⑦冰水混合物,其中属于纯净物的是。(2)、某同学用托盘天平称量5.5g(1g以下用游码)药品,称量时砝码和药品的位置放反了,则所称药品的质量是g。(3)、小刚量取8mL水时,仰视量筒内凹液面的最低处,导致量取的水的体积8mL(“大于”、“小于”或“等于”)。
-
18、如图所示的热现象,说法错误的是

①甲中炙热的铁水具有内能,冰冷的冰块没有内能
②图乙中冬天搓手取暖是将机械能转化为内能
③图丙中用湿毛巾冷敷降温是通过热传递的方式减小人体的内能
④丁图中能量转化与汽油机做功冲程能量转化都是机械能转化为内能
⑤甲图中冰块内能增大的方法,与图丁中硝化棉内能增大的方法相同
A、②③⑤ B、①④⑤ C、①④ D、②③ -
19、如图所示,关于分子热运动理论,以下反映微粒间有作用力的是A、
 气体扩散
B、
气体扩散
B、 金块中的金原子
C、
金块中的金原子
C、 两个铅柱不分开
D、
两个铅柱不分开
D、 四溢的花香
四溢的花香
-
20、某同学在做“对人体吸入空气和呼出气体的探究”实验时,进行了如下图的实验探究。下列说法错误的是
 A、图二实验中,吸气时应打开a,关闭b;呼气时应该打开b,关闭a B、图三实验中,吸气或呼气时都不需要关闭c、d C、图三乙装置中球形干燥管的作用是防止吸气时乙中液体进入口中 D、以上三个实验均可以证明呼出气体中二氧化碳的含量比空气中二氧化碳的含量高
A、图二实验中,吸气时应打开a,关闭b;呼气时应该打开b,关闭a B、图三实验中,吸气或呼气时都不需要关闭c、d C、图三乙装置中球形干燥管的作用是防止吸气时乙中液体进入口中 D、以上三个实验均可以证明呼出气体中二氧化碳的含量比空气中二氧化碳的含量高