相关试卷
-
1、纳米海绵
纳米海绵是一种新型环保清洁产品,具有网状多孔的结构,有良好的吸油能力、循环利用以及环境友好等特性。清洁过程中可以吸附物体表面污渍,可用于清洁茶垢、油垢等。科学家测定了纳米海绵对不同油品的吸收能力(吸油质量比越高,其吸油能力越强),结果如图所示。吸油能力的差异性取决于油品自身的密度。油品密度越大,纳米海绵的吸油能力越强。依据科普内容回答下列问题。
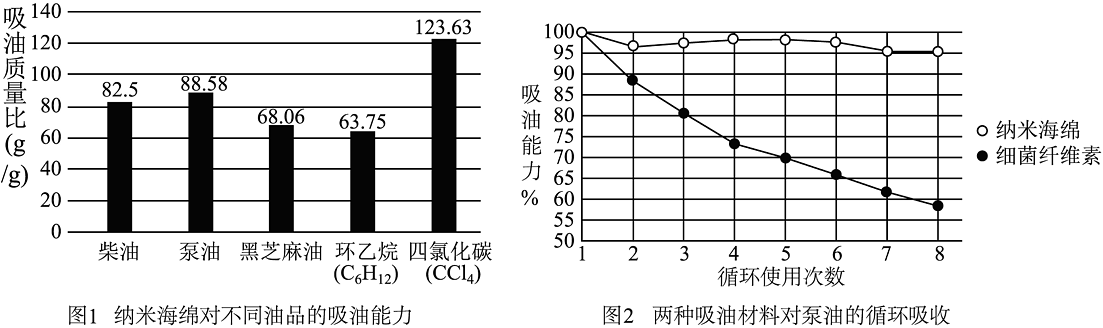 (1)、纳米海绵是以三聚氰胺和甲醛(HCHO)为原料制得的高分子物质,已知甲醛在空气中充分燃烧会生成二氧化碳和水,该反应的化学方程式为 , 纳米海绵具有的结构特性,适用解决石油泄露所造成的污染。(2)、由1图可知,纳米海绵对柴油的吸收能力比黑芝麻油的(填“强”或“弱”)。(3)、已知中氯元素为价,中碳元素的化合价为价(4)、由2图可得到结论:。(5)、下列说法正确的是______(多选,填字母)。A、纳米海绵可用于清洁炉具、油烟机清洁等方面 B、纳米海绵可用于处理海上石油泄漏造成的污染 C、纳米海绵可循环利用 D、图1的几种油品中环己烷的油品密度最大
(1)、纳米海绵是以三聚氰胺和甲醛(HCHO)为原料制得的高分子物质,已知甲醛在空气中充分燃烧会生成二氧化碳和水,该反应的化学方程式为 , 纳米海绵具有的结构特性,适用解决石油泄露所造成的污染。(2)、由1图可知,纳米海绵对柴油的吸收能力比黑芝麻油的(填“强”或“弱”)。(3)、已知中氯元素为价,中碳元素的化合价为价(4)、由2图可得到结论:。(5)、下列说法正确的是______(多选,填字母)。A、纳米海绵可用于清洁炉具、油烟机清洁等方面 B、纳米海绵可用于处理海上石油泄漏造成的污染 C、纳米海绵可循环利用 D、图1的几种油品中环己烷的油品密度最大 -
2、为探究铜的化学性质,某同学借助氧气传感器在密闭装置中进行如图所示实验,观察实验现象并分析氧气含量随时间变化的曲线图。其中终点D(203,615%)表示时间为203秒时,装置中氧气含量为6.15%。结合图示判断下列说法错误的是
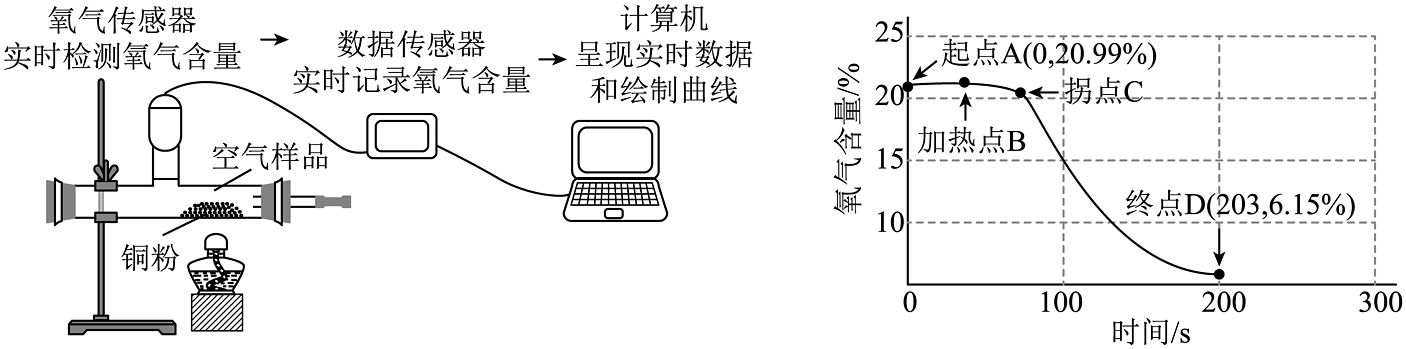 A、加热前的空气样品中氧气含量为20.99% B、铜在加热条件下能与氧气发生化学反应 C、加热时要先预热再固定在铜粉处加热 D、拐点C至终点D所对应的时间范围内,装置内物质的总质量逐渐减少
A、加热前的空气样品中氧气含量为20.99% B、铜在加热条件下能与氧气发生化学反应 C、加热时要先预热再固定在铜粉处加热 D、拐点C至终点D所对应的时间范围内,装置内物质的总质量逐渐减少 -
3、基于问题设计实验方案是实验探究活动的重要环节。下列实验方案中合理的是
选项
实验问题
实验方案
A
鉴别氮气和二氧化碳
将带火星的木条伸入盛有气体的试管中,观察现象
B
除去KCl中的
溶解,过滤,洗涤、干燥
C
验证Cu、Al的金属活动性
将洁净的铝丝浸入溶液中,观察现象
D
稀释浓硫酸
取水倒入浓硫酸中,并用玻璃棒不断搅拌
A、A B、B C、C D、D -
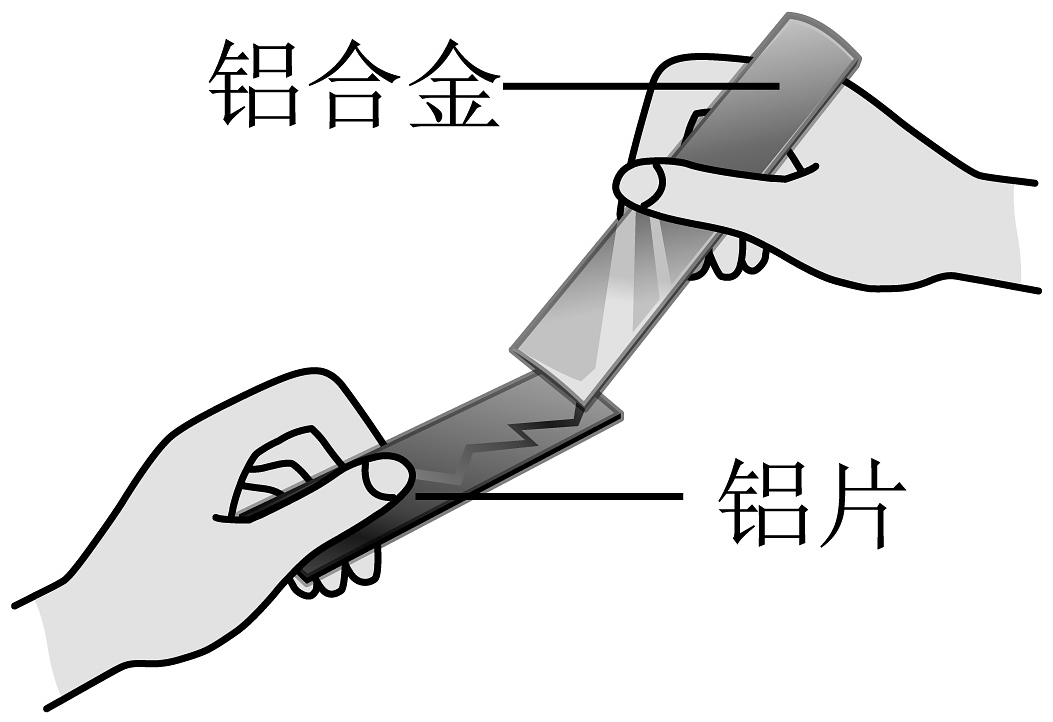
4、下列实验能达到实验目的的是A、比较合金与其组分金属的硬度
 B、探究不同催化剂的催化效果
B、探究不同催化剂的催化效果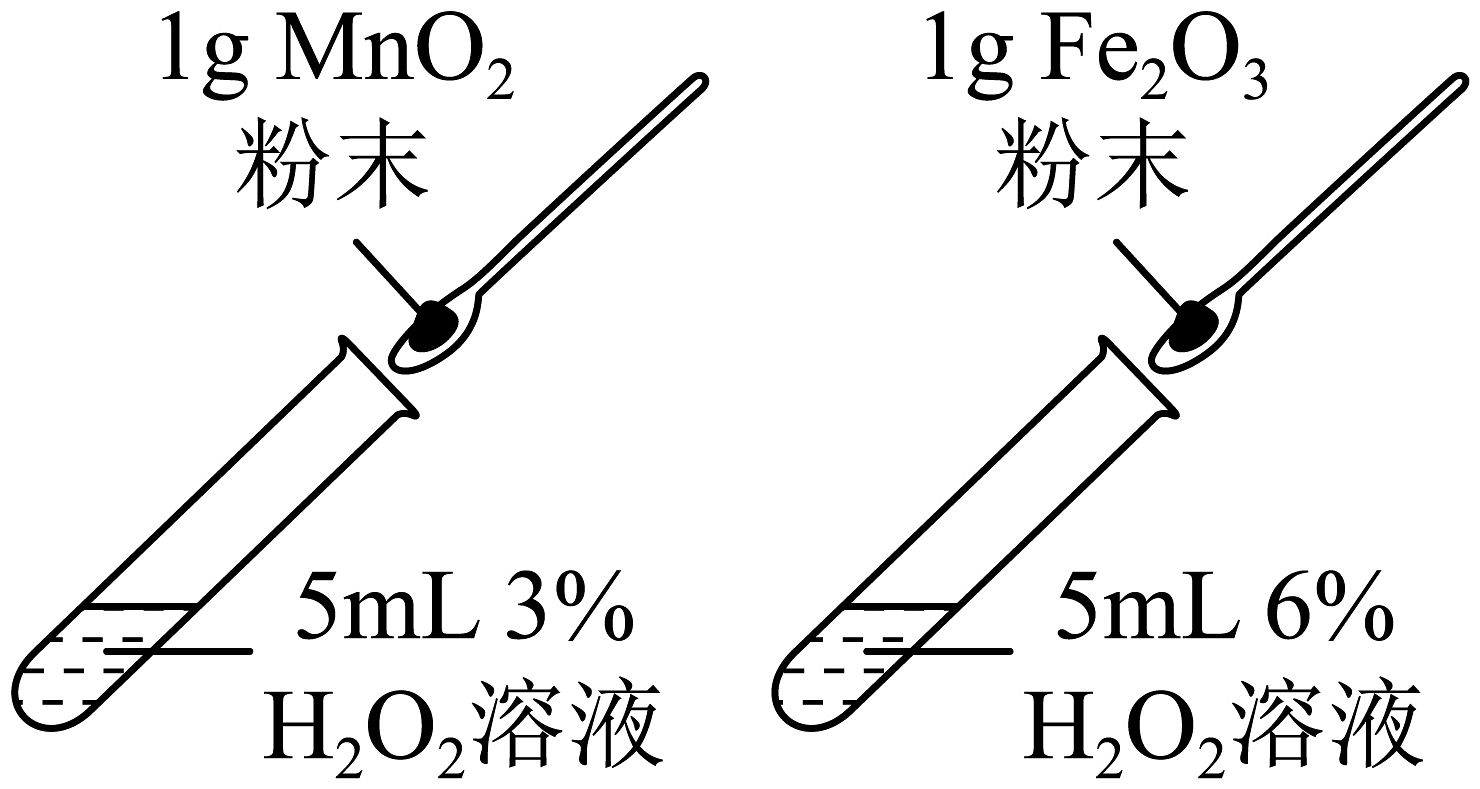 C、证明铜生锈与、和有关
C、证明铜生锈与、和有关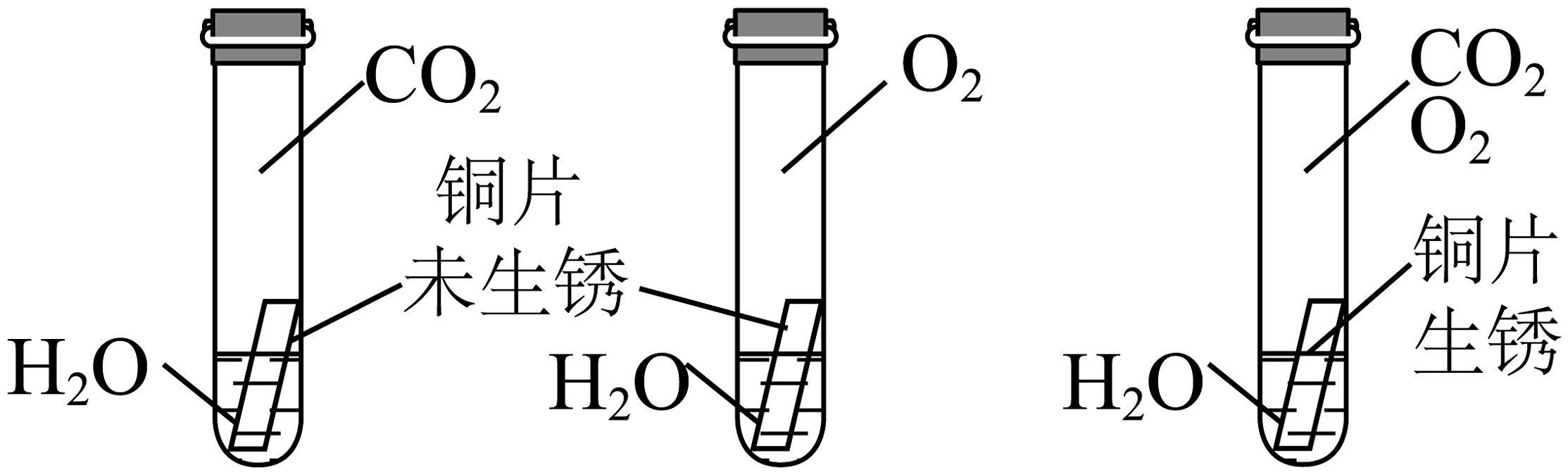 D、验证质量守恒定律
D、验证质量守恒定律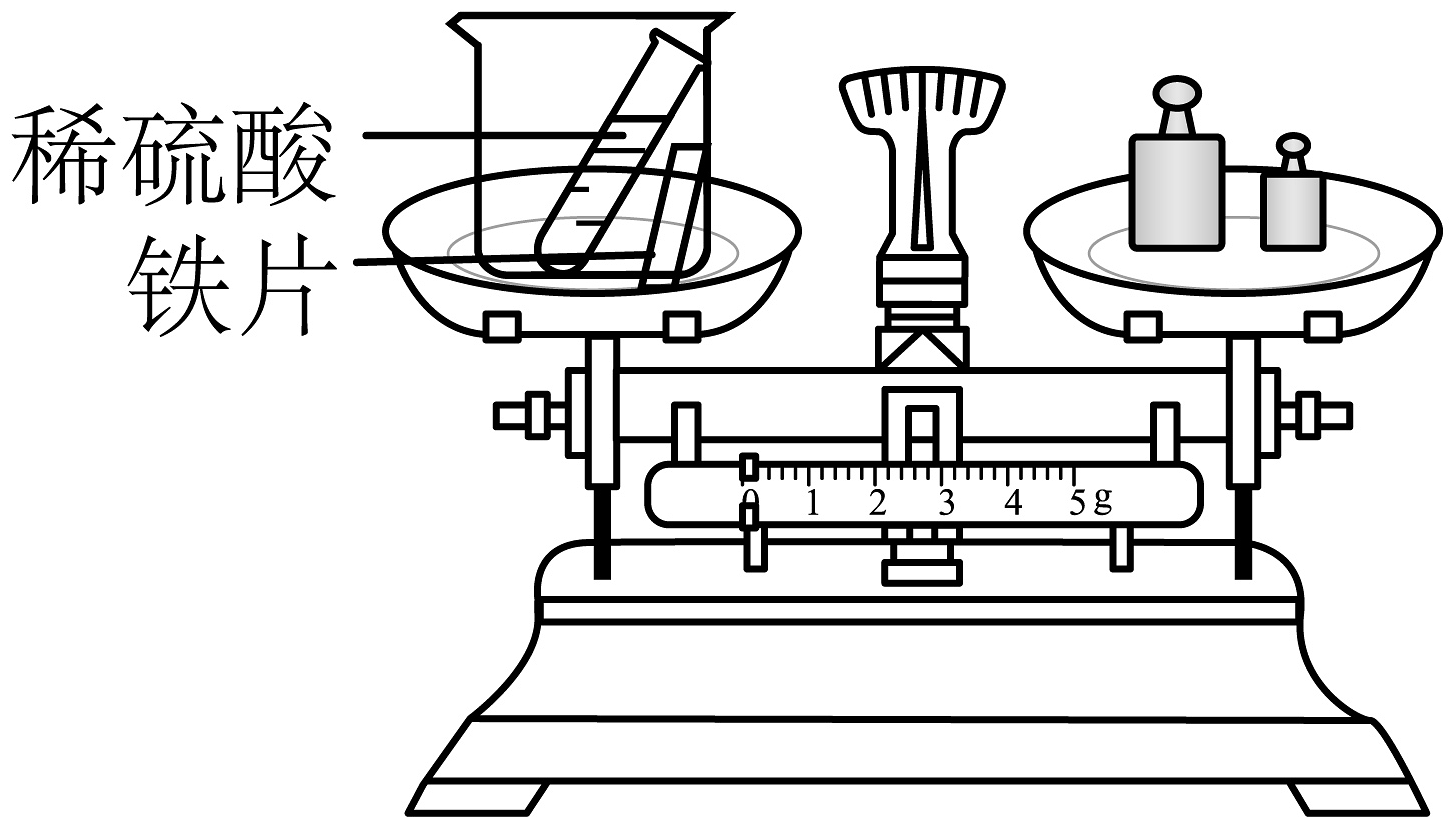
-
5、、KCl可用作钾肥,对大豆的生长具有重要的作用。、KCl的溶解度随温度变化的曲线如图所示,下列有关说法正确的是
 A、溶解度比KCl的大 B、在70℃时,将的饱和溶液降温至40℃,析出 C、d点对应的溶液为饱和溶液 D、e点对应的KCl饱和溶液中溶质的质量分数为40%
A、溶解度比KCl的大 B、在70℃时,将的饱和溶液降温至40℃,析出 C、d点对应的溶液为饱和溶液 D、e点对应的KCl饱和溶液中溶质的质量分数为40% -
6、臭氧()是一种常见的消毒剂。对氧气无声放电可获得臭氧,实验装置和反应的微观示意图如下所示。下列说法正确的是
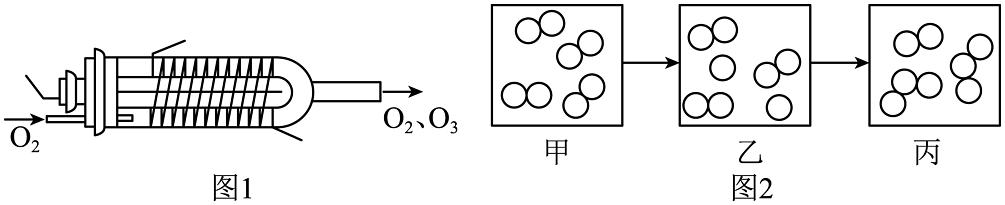 A、图2乙中的粒子均可保持氧气的化学性质 B、图2甲和丙表示的都是纯净物 C、参加反应的反应物和生成物的分子个数比为 D、该反应是化合反应
A、图2乙中的粒子均可保持氧气的化学性质 B、图2甲和丙表示的都是纯净物 C、参加反应的反应物和生成物的分子个数比为 D、该反应是化合反应 -
7、在“天宫课堂”中,航天员王亚平展示了“锆金属熔化与凝固”实验。下图呈现了锆元素在元素周期表中的信息及其原子结构示意图,据此判断,下列说法正确的是
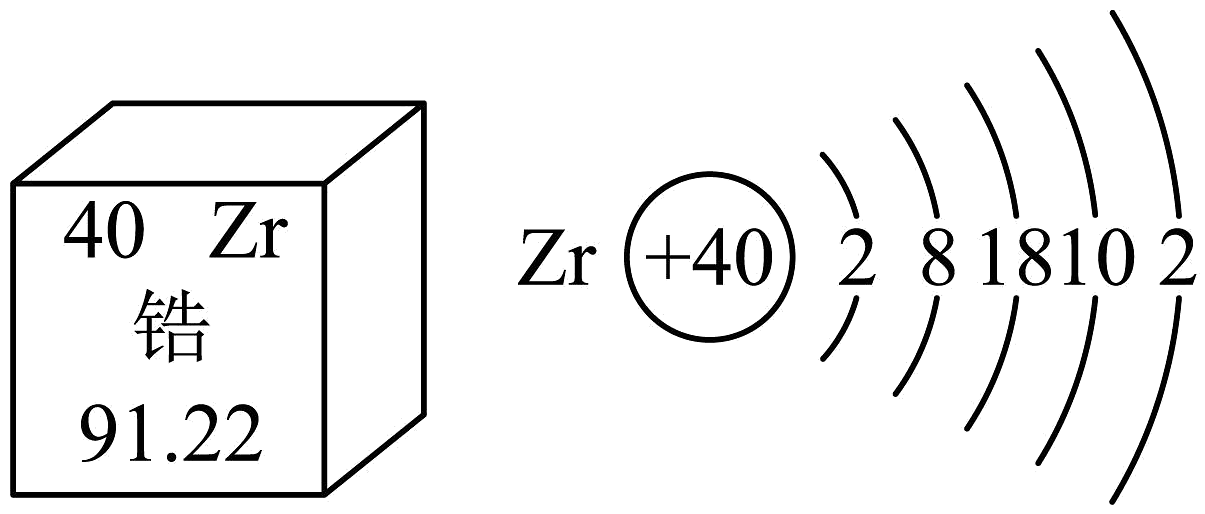 A、锆原子在化学变化中容易得到电子 B、锆元素的相对原子质量为91.22g C、锆原子的中子数为40 D、锆元素是金属元素
A、锆原子在化学变化中容易得到电子 B、锆元素的相对原子质量为91.22g C、锆原子的中子数为40 D、锆元素是金属元素 -
8、华东理工大学在钙钛矿太阳能电池研究领域取得重要突破,创新性地采用单层石墨烯与聚甲基丙烯酸甲酯的复合结构,相关成果处于国际领先水平。聚甲基丙烯酸甲酯的单体为甲基丙烯酸甲酯(化学式 , 结构如图所示),下列关于甲基丙烯酸甲酯()的说法正确的是
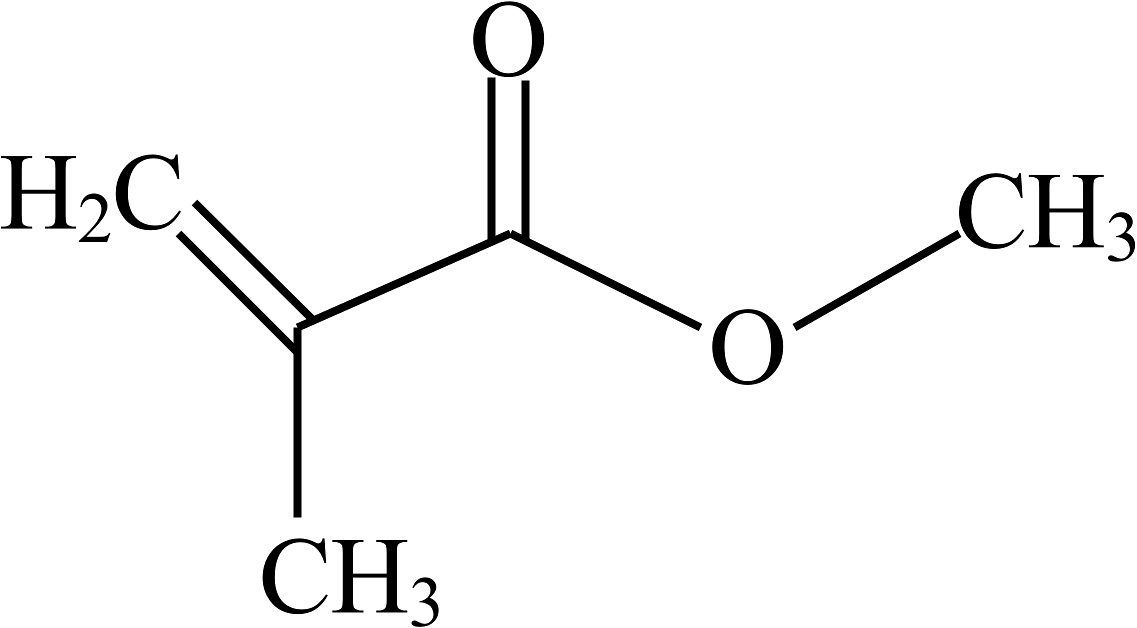 A、由15个原子构成 B、属于氧化物 C、氢元素的质量分数最大 D、碳、氧元素质量比为
A、由15个原子构成 B、属于氧化物 C、氢元素的质量分数最大 D、碳、氧元素质量比为 -
9、嫦娥六号在月球背面展示的国旗的原材料是玄武岩。玄武岩的组成元素有硅、铝、铁、钙、氧等,下列说法及用语表达正确的是
 A、地壳中含量第一的金属元素:Si B、亚铁离子: C、2个钙原子: D、1个氧分子:
A、地壳中含量第一的金属元素:Si B、亚铁离子: C、2个钙原子: D、1个氧分子: -
10、安全是生产生活中的第一要素。2025年春节期间,四川一“小孩哥”将点燃的爆竹扔进化粪池,引发剧烈爆炸,造成路面严重损毁、多辆车辆受损。下列有关安全知识的说法正确的是
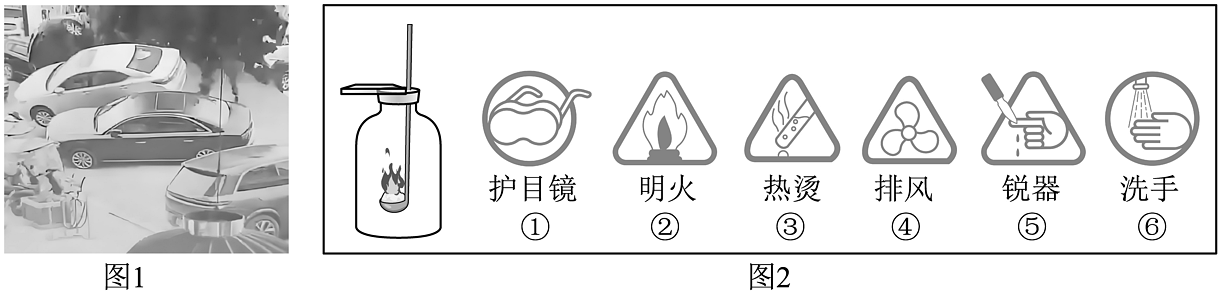 A、用甲醛溶液长期浸泡食物 B、炒菜时油锅中的油着火,可用水浇灭 C、化粪池、面粉加工厂、煤矿井等场所都必须严禁烟火 D、关于硫的燃烧的实验说明,无需标注图2中的③④
A、用甲醛溶液长期浸泡食物 B、炒菜时油锅中的油着火,可用水浇灭 C、化粪池、面粉加工厂、煤矿井等场所都必须严禁烟火 D、关于硫的燃烧的实验说明,无需标注图2中的③④ -
11、2025年4月30日,神舟十九号载人飞船返回舱成功着陆。返回舱部分材质为铝合金。其成分中铝的工业制法原理为2Al2O34Al+3O2↑,生产54t铝需要电解的氧化铝铝质量是多少?
-
12、我省部分地区土壤存在“白霜”现象,影响植物生长。某化学兴趣小组针对这一现象展开了项目式实践活动。
【活动一】兴趣小组了解到土壤的酸化成碱化会影响部分植物生长,于是就地取材,用黑枸杞浸取液制作酸碱指示剂和比色卡(如下图),对“白稻”的酸碱性进行了检验。
 取适量“白霜”样品于烧杯中,加入一定量蒸馏水。充分搅拌后静置。(1)、取少量上层清液于试管中加入指示剂,溶液显蓝色,说明“白霜”呈性。(2)、查阅资料得知。白霜呈上述性质与Na2CO3有关。请你帮兴趣小组设计一种实验方案,证明“白霜”中含Na2CO3(简要说明实验试剂、操作及现象)(3)、【活动二】以地适种即改良土壤,适宜植物生长。结合酸碱盐相关知识,组内三位同学分别选择了一种他们认为可以降低土壤中碳酸钠含量的试剂。所选试剂及原理如下表所示。
取适量“白霜”样品于烧杯中,加入一定量蒸馏水。充分搅拌后静置。(1)、取少量上层清液于试管中加入指示剂,溶液显蓝色,说明“白霜”呈性。(2)、查阅资料得知。白霜呈上述性质与Na2CO3有关。请你帮兴趣小组设计一种实验方案,证明“白霜”中含Na2CO3(简要说明实验试剂、操作及现象)(3)、【活动二】以地适种即改良土壤,适宜植物生长。结合酸碱盐相关知识,组内三位同学分别选择了一种他们认为可以降低土壤中碳酸钠含量的试剂。所选试剂及原理如下表所示。同学
化学试剂
化学反应原理
甲
H2SO4
H2SO4+Na2CO3=Na2SO3+CO2↑+H2O
乙
Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
丙
CaCl2
……
⑴丙同学选用CaCl2降低土壤中含量的化学方程式为。
⑵从反应前后物质类别分析,乙同学所选试剂不合适的原因是。
(4)、同学们与当地农业技术人员交流后得知,H2SO4使用不当会导致土壤酸化。CaCl2存在成本较高等问题。【项目成果】兴趣小组同学最终选择了兼有杀菌消毒作用的硫粉(S)和物美价廉的石音(主要成分为CaSO4)作为土壤改良剂。他们深刻体会到实验室探究与解决真实问题存在差异。在实际应用时除了考虑化学反应原理。还需要综合考虑等因素。
【拓展延伸】兴趣小组还了解到,我省从过去以地适种为主。变为如今以地适种和以种适地结合的方法,实现土壤的综合治理。
⑴结合下表,他们认为该地区适合种植的农作物为。
作物
马铃薯
油菜
小麦
沙枣
适宜生长的pH范围
4.5-6.5
5.8-6.7
6.0-7.0
8.0-8.7
⑵该地区土壤缺乏氮,磷元素。现有尿素[CO(NH2)2]、磷酸二氢铵(NH4H2PO4),氯化钾(KCl)三种化肥,为提高土壤肥力,你认为该地区最合适的化肥为。
【前景展望】我省已在柴达木盆地试种蕨麻成功,同学们对该地区种植更多农作物的前景充满期待。
-
13、水是生命之源,其组成奥秘直至十八世纪末才被揭开。让我们沿着时间脉络回顾科学家是如何揭秘“水的组成”的。
 请结合材料回答;(1)、“易燃空气”实际是(写化学式),玻璃瓶内壁出现液滴的原因是(用化学方程式表示〕。普利斯特里与卡文迪什的实验虽发现了水的生成,但受“燃素说”影响未能揭示水的组成。(2)、拉瓦锅所做实验的原理是3Fe+4H2OFe3O4+4H2该反应属于基本反应类型中的反应。通过分析得出水是(填“化合物”或“单质”)。(3)、后来人们根据相关理论以及尼科尔森等人的实验数据,进一步认识到一个水分子由构成。
请结合材料回答;(1)、“易燃空气”实际是(写化学式),玻璃瓶内壁出现液滴的原因是(用化学方程式表示〕。普利斯特里与卡文迪什的实验虽发现了水的生成,但受“燃素说”影响未能揭示水的组成。(2)、拉瓦锅所做实验的原理是3Fe+4H2OFe3O4+4H2该反应属于基本反应类型中的反应。通过分析得出水是(填“化合物”或“单质”)。(3)、后来人们根据相关理论以及尼科尔森等人的实验数据,进一步认识到一个水分子由构成。 -
14、我因拥有世界上海拔最高、线路最长、速度最快的高原铁路———青藏铁路。让我们踏上达条神奇的“天路”,开启研学之旅,了解青藏铁路建设者如何攻克多年冻土、高原缺氧和生态脆弱三大世界性工程难题,体会“挑战极限,勇创一流”的青聚铁路精神。(1)、热棒降温技术解决了高原冻土难题,其原理如图所示,热棒中的液氨能吸收冻土层热量,发生汽化,使冻土温度(填“升高”或“降低”),保持冻土稳定。液氨汽化过程中(填“物理”或“化学”)性质保持不变。热棒的金属外壳有防腐涂层。以隔绝 , 延长热棒使用寿命。
 (2)、青藏铁路铁轨采用特殊铁合金材质,合金的优点是(任写一条);合金在其他领域也有广泛应用,如钛合金可用于航空航天。铁元素和钛元素的本质区别是(填“质子数”“中子数”或“电子数”)不同。(3)、青藏铁路修建地区海拔高、尽管氧气约占空气总体积的 , 但因气压低导致空气稀薄,易引发高原反应。一旦出现高原反应,可饮用适量葡萄糖。其属于六类营养物质中的 , 同时可使用分子筛制氧机保障供氧,其原理如图所示,该过程属于变化。请写出一个实验室制取氧气的化学方程式。
(2)、青藏铁路铁轨采用特殊铁合金材质,合金的优点是(任写一条);合金在其他领域也有广泛应用,如钛合金可用于航空航天。铁元素和钛元素的本质区别是(填“质子数”“中子数”或“电子数”)不同。(3)、青藏铁路修建地区海拔高、尽管氧气约占空气总体积的 , 但因气压低导致空气稀薄,易引发高原反应。一旦出现高原反应,可饮用适量葡萄糖。其属于六类营养物质中的 , 同时可使用分子筛制氧机保障供氧,其原理如图所示,该过程属于变化。请写出一个实验室制取氧气的化学方程式。 (4)、青藏铁路建设者打造出一条“绿色长廊”,精心维护着高原脆弱的生态。下列措施不能有效维护沿线生态稳定的是( )A、生活污水未经处理直接排放 B、沿线建立植被保护示范点 C、在沿线积极开展防风固沙行动 D、“以桥代路”保障动物自由迁徙
(4)、青藏铁路建设者打造出一条“绿色长廊”,精心维护着高原脆弱的生态。下列措施不能有效维护沿线生态稳定的是( )A、生活污水未经处理直接排放 B、沿线建立植被保护示范点 C、在沿线积极开展防风固沙行动 D、“以桥代路”保障动物自由迁徙 -
15、化学学习过程中,归纳总结有利于提升学习能力。下列知识归纳全都正确的一组是( )
A.化学与资源 B.化学与安全 ①煤是化石燃料
②合理开采矿产资源①油锅着火用水浇灭
②点燃可燃性气体前要验纯C.化学与健康 D.化学与环境 ①不食用过期或霉变食品
②人体缺碘会导致骨质疏松①废纸盒是不可回收垃圾
②PM2.5是空气污染物A、A B、B C、C D、D -
16、利用性质差异可以区分物质,下列方法能达到目的的是( )A、带火星木条区分二氧化碳和氮气 B、观察区分铁粉和木炭粉 C、灼烧法区分羊毛纤维和棉纤维 D、溶解区分食盐和白砂糖
-
17、《开宝本草》中记载“所在山泽,冬月地上有霜,扫取以水淋汁后,乃欺炼而成”,此处“霜”主要成分为KNO3。结合下图,下列说法不正确的是( )
 A、20℃时,KNO3的溶解度是63.9g B、“扫取以水淋汁”体现了硝酸钾易溶于水 C、40℃时.将70g KNO3加入100g水中得到饱和溶液 D、“冬月地上有霜”证明KNO3的溶解度随温度的降低而降低
A、20℃时,KNO3的溶解度是63.9g B、“扫取以水淋汁”体现了硝酸钾易溶于水 C、40℃时.将70g KNO3加入100g水中得到饱和溶液 D、“冬月地上有霜”证明KNO3的溶解度随温度的降低而降低 -
18、桃之夭夭。灼灼其华。古代桃红胭脂的染料主要成分为苏木红素(C16H14O5),下列有关苏木红素的说法正确的是( )A、苏木红素是无机化合物 B、苏木红素由三种元素组成 C、苏木红素中C、O元素质量比为16:5 D、苏木红素中氢元素质量分数最高
-
19、人类一直渴望将阳光装进瓶子里,随时携带、随处使用。“液态阳光”可实现这一愿景。其过程如图所示,请完成下列小题。
 (1)、图中电解装置所需的电能由( )转化而来。A、风能 B、氢能 C、核能 D、太阳能(2)、水中氢元素的化合价是( )A、0 B、+1 C、+2 D、-1(3)、合成装置中的反应是CO2+3H2CH3OH+X,X的化学式为( )A、CO B、CH4 C、H2O D、H2O2
(1)、图中电解装置所需的电能由( )转化而来。A、风能 B、氢能 C、核能 D、太阳能(2)、水中氢元素的化合价是( )A、0 B、+1 C、+2 D、-1(3)、合成装置中的反应是CO2+3H2CH3OH+X,X的化学式为( )A、CO B、CH4 C、H2O D、H2O2 -
20、下列实验方案不能达到目的的是( )
实验方案




实验目的
A.验证质量守恒定律
B.比较锌、铁、铜的金属活动性顺序
C.探究燃烧条件
D.收集O2
A、A B、B C、C D、D